杂合肽Melitten-cathelicidin_BF的生物信息学分析
2022-10-27连家胜邬嘉琦宋彩银康丹菊周光现
连家胜, 邬嘉琦, 宋彩银, 康丹菊, 周光现
(广东海洋大学滨海农业学院,广东 湛江 524088)
抗生素耐药性在全球广泛存在,近些年报道每年都有几十万人死于抗生素耐药。耐药细菌产生主要归于人们对抗生素的滥用,尤其是在畜牧业中的应用,2012年美国在畜牧生产领域售卖14 800 t抗生素,欧盟国家售卖8 000 t抗生素[1]。1950—2020年,抗生素在畜牧业饲料添加应用已有70年历史[2-3]。抗生素在畜牧业中使用量已超过人用量,抗生素在畜牧业养殖种起着重要作用。但为了人民生活健康,各国陆陆续续开始了抗生素在饲料添加剂中的禁用。抗生素的禁用,对养殖有不小冲击。因此,新型的抗菌方案孕育而生。抗菌肽作为新型抗菌物质,具有抗菌谱广、热稳定性好等优良特性,在畜牧业具有较大应用价值和潜力,具备完全替代抗生素的能力[4-5]。天然抗菌肽并非完美,有的在抗菌的同时对机体有一定损伤,如溶血性和细胞毒性。通过人工设计优化抗菌肽,可以增强抗菌活性降低溶血性风险[6]。
蜂毒肽(melitten)为蛋白质多肽类,由26个氨基酸组成,据报道研究表明该多肽具有抗菌、抗病毒和抗炎等多种药理学作用[7-8]。蜂毒肽可融入质膜,可以使细菌内物质泄漏或使细菌质壁分离,从而导致细菌死亡。金环蛇抗菌肽(cathelicidin_BF)由30个氨基酸组成,具有广谱的抗菌活性,不仅对细菌、某些真菌以及病毒具有非常强的杀菌活性[9]。抗菌肽的获取面临两大难题,一是获取具有良好抗菌效果且对动物机体无损伤的抗菌肽,一是抗菌肽制备工艺问题。天然抗菌肽含量丰富但提取成本较高,合成抗菌肽也面临成本较高问题,不利于经济生产。
国内外研究表明设计合成许多种杂合肽,在抑菌等效果明显优于天然肽,且降低了毒性和溶血性。抗菌肽作为新型饲料添加剂,抗生素替代品,具有较高的研究价值。改造已有抗菌肽,并设计新抗菌肽分子是创造高活力抗菌肽的有效途径,通过生物合成降低抗菌肽获取成本。为了获得优良的抗菌肽,这就需要在设计改造前对抗菌肽进行生物信息等理化性质分析,从而为抗菌肽分子的改造和设计提供足够的理论依据。总之,新型杂合肽的设计优化等研发对解决天然抗菌肽存在的问题有着重要的意义和实用价值。
1 材料与方法
1.1 材 料
选取蜂毒肽(GI:EU753183.1)C端序列GIGAVLKVLTTGLPALISWIKRKRQQ为新杂合肽N端序列,选取金环蛇抗菌肽(GI:JQ867103.1)C端序列KFFRKLKKSVKKRAKEFFKKPRVIGVSIPF为新杂合肽C端序列。
1.2 方 法
1.2.1 杂合肽Melitten-cathelicidin_BF的理化性质分析 借助ProtParam工具[10](https://web.expasy.org/protparam/)对杂合抗菌肽Melitten-cathelicidin_BF进行分子量、等电点、相对分子质量、亲水疏水性等理化参数预测。
1.2.2 杂合肽Melitten-cathelicidin_BF的亲疏水性分析 利用ProtScale工具[11](https://web.expasy.org/protscale/)分析杂合肽Melitten-cathelicidin_BF氨基酸位点的疏水性/亲水性,分别选择Hphob./Kyte & Doolittle和Hphob./Hopp & Woods算法进行分析,滑窗大小为9,线性加权模型。
1.2.3 杂合肽Melitten-cathelicidin_BF的跨膜区和信号肽分析 利用TMHMM-2.0工具[12](https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)分析杂合肽Melitten-cathelicidin_BF的跨膜区。利用SignalP 5.0 Server工具[13](http://www.cbs.dtu.dk/services/SignalP/)预测杂合肽Melitten-cathelicidin_BF的信号肽,选择真核生物类别进行分析。
1.2.4 杂合肽Melitten-cathelicidin_BF的糖基化和磷酸化位点预测 利用NetOGlyc 4.0 Server工具[14](http://www.cbs.dtu.dk/services/NetOGlyc/)和NetPhos 3.1 Server工具[15](http://www.cbs.dtu.dk/services/NetPhos/)分析杂合肽Melitten-cathelicidin_BF的糖基化和磷酸化位点。
1.2.5 杂合肽Melitten-cathelicidin_BF的二级结构分析 利用SOPMA工具(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析杂合肽Melitten-cathelicidin_BF的二级结构组成与分布,选择构象状态数4(包括螺旋、折叠、转角和无规卷曲)、相似阈8、窗口宽度17。
1.2.6 杂合肽Melitten-cathelicidin_BF的酶切位点分析 通过PeptideCutterL在线工具https://web.expasy.org/peptide-cutter/分析该杂合肽蛋白酶切割的潜在位点。解析其安全性。
1.2.7 杂合肽Melitten-cathelicidin_BF的三维结构分析 通过SWISS-MODEL在线工具https://swissmodel.expasy.org/interactive分析比对杂合肽Melitten-cathelicidin_BF匹配情况,再通过I-TASSER在线工具https://zhanggroup.org/I-TASSER/构建杂合肽三维结构。
1.2.8 杂合肽Melitten-cathelicidin_BF的功能分析 通过interpro在线工具http://www.ebi.ac.uk/interpro分析杂合肽Melitten-cathelicidin_BF功能作用。
2 结果与分析
2.1 杂合抗菌肽Melitten-cathelicidin_BF的理化性质分析
该杂合肽一级序列为GIGAVLKVLTTGLPALISWIKRKRQQKFFRKLKKSVKKRAKEFFKKPRVIGVSIPF。利用ProtParam进行理化性质分析,结果表明Melitten-cathelicidin_BF共含有56个氨基酸残基,分子式为C307H516N86O66,预测分子量为6.47 kDa,理论等电点为12.20。该杂合肽由14种基本氨基酸组成,其中赖氨酸(Lys)含量最高,占氨基酸总数的21.4%,其次为精氨酸(Arg)、异亮氨酸(Ile)、亮氨酸(Leu)、苯丙氨酸(Phe)和缬氨酸(Val),分别均占氨基酸总数的8.9%,带负电的残基(Asp+Glu)数为1个,带正电荷的残基(Arg+Lys)数为17个(表1)。该杂合肽在不同环境中半衰期预测,在哺乳动物细胞中约为30 h,在酵母中>20 h,在大肠杆菌中>10 h。不稳定指数为25.95,脂肪族氨基酸指数为100.89,总亲水性平均系数GRAVY值为-0.161,表明该杂合肽为亲水性蛋白。
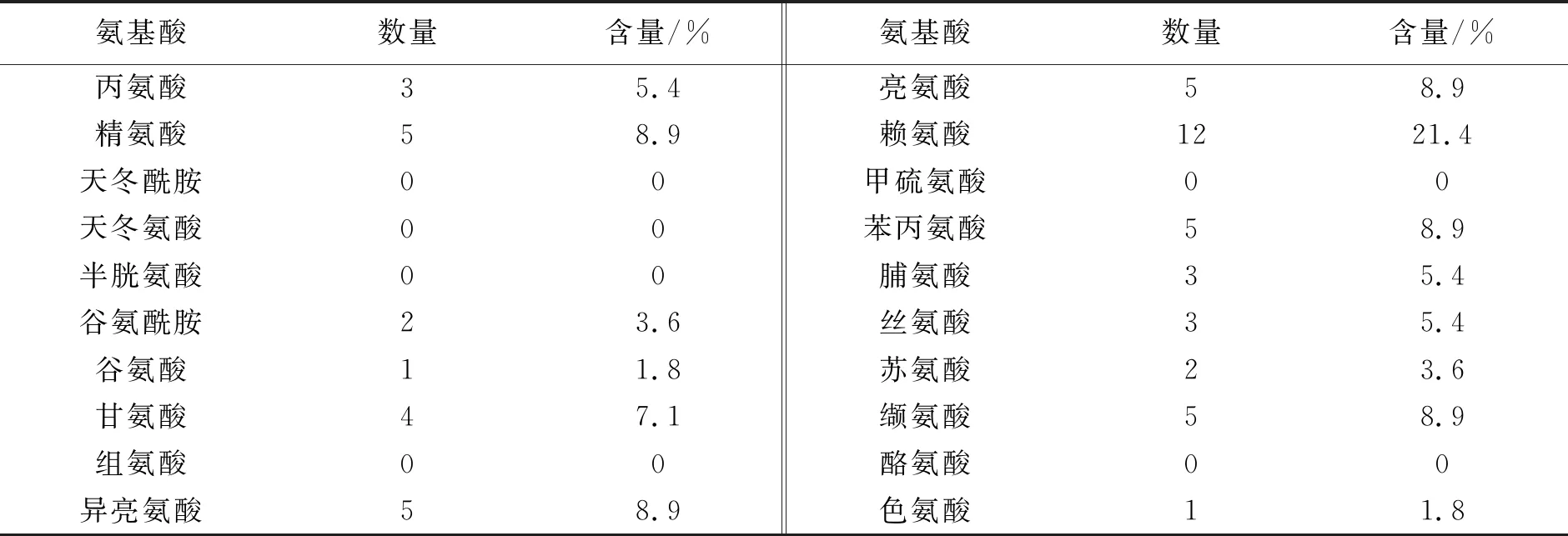
表1 杂合肽Melitten-cathelicidin_BF的氨基酸组成
2.2 杂合肽Melitten-cathelicidin_BF的亲疏水性分析
利用ProtScale进行杂合肽Melitten-cathelicidin_BF氨基酸位点的亲疏水性预测。Hphob./Kyte & Doolittle方法其值大于0表示具有较强疏水性,小于0具有较强的亲水性;Hphob./Hopp & Woods方法其小于0表示具有较强疏水性,大于0具有较强亲水性。综合两种方法,该杂合肽在预测结果显示位点5~19区域具有强疏水性;位点20~49区域表现为亲水性。虽然Hphob./Kyte & Doolittle和Hphob./Hopp & Woods算法不同,但每个氨基酸亲疏水性强弱都能够在一定程度上得到展现。这两种算法,都表明该杂合肽整体呈亲水性。

注:横坐标表示氨基酸位置,纵坐标表示不同算法的值。
2.3 杂合肽Melitten-cathelicidin_BF的跨膜区和信号肽分析
经TMHMM-2.0分析杂合肽Melitten-cathelicidin_BF无跨膜区(图2A)。第4~21氨基酸,在膜上和在里面的概率在0.1~0.2,而在外的概率均大于0.6。第22~56氨基酸,在外的概率均大于0.7,在膜上概率为0。SignalP分析结果表明杂合肽Melitten-cathelicidin_BF无信号肽(图2B)。

注:A-跨膜区预测;B-信号肽预测。
2.4 杂合肽Melitten-cathelicidin_BF的糖基化和磷酸化位点分析
经NetOGlyc软件分析,杂合肽Melitten-cathelicidin_BF存在5个糖基化位点,分别是第10和11位的苏氨酸残基,第18、35和53位的丝氨酸残基,得分分别为0.175,0.264,0.220,0.100,0.052。经NetPhos软件分析,杂合肽Melitten-cathelicidin_BF共有1个丝氨苏氨酸磷酸化位点(得分0.886)和1个苏氨酸磷酸化位点(得分均>0.5)(图3)。

图3 杂合肽Melitten-cathelicidin_BF的磷酸化位点预测
2.5 杂合肽Melitten-cathelicidin_BF的二级结构分析
经SOPMA软件分析,杂合肽Melitten-cathelicidin_BF的二级结构中,α螺旋占比64.29%,由36个氨基酸残基参与;延伸带占比8.93%,由5个氨基酸残基参与;转角占比7.14%,由4个氨基酸残基参与;无规则卷曲占比19.64%,由11个氨基酸残基参与(图4)。表明杂合肽Melitten-cathelicidin_BF二级结构的主要元件为α螺旋和无规则卷曲。

注:①为α螺旋,②为延伸带,③为无规则卷曲,④为β转角。
2.6 杂合肽Melitten-cathelicidin_BF的酶切位点分析
由表5可知:杂合肽Melitten-cathelicidin_BF可被17种蛋白酶剪切,同一位点可被多种蛋白酶剪切,该肽含有的56个氨基酸残基均可作为酶切位点。其中,13种蛋白酶有≥5个剪切位点,天冬氨酸-N端+谷氨酸-N端肽链内切酶、粪臭素酶、谷酰基肽链内切酶、Iodosobenzoic acid、脯氨酸肽链内切酶和葡萄球菌的肽酶I仅有1个剪切位点。

表5 杂合肽Melitten-cathelicidin_BF的酶切位点
2.7 杂合肽Melitten-cathelicidin_BF的三维结构分析
利用SWISS-MODEL数据库比对杂合肽Melitten-cathelicidin_BF结构信息。比对发现该杂合肽分别与数据库中Melittin(SMTL ID:3qrx.1)(图5A)和Cathelicidin-like peptide(SMTL ID:2mwt.1)匹配率高(图5B),相似度达到100%和73.53%,GMEQ值分别为0.19和0.44。通过I-TASSER在线软件对杂合肽建模分析(图5C),其C-score值为-2.17,说明蛋白质模型相对可靠。

注:A,与Melittin匹配模型;B,与Cathelicidin-like peptide匹配模型;C,I-TASSER在线分析模型。
2.8 杂合肽Melitten-cathelicidin_BF功能分析
杂合肽Melitten-cathelicidin_BF为人工合成肽,具有蜂毒肽和金环蛇抗菌肽部分或全部功能。通过功能分析,该杂合肽为蛋白酶抑制剂类肽,具有蛋白酶抑制剂系列功能(图6)。该杂合肽无信号肽、无跨膜区,且该杂合肽为阳离子肽,可通过静电吸附作用贴在细菌表面形成“毡子”结构,从而破坏细胞膜结构。

图6 杂合肽Melitten-cathelicidin_BF功能预测分析
3 讨 论
绝大部分抗菌肽为阳离子肽,可以通过与带负电荷的细胞膜相互作用,破坏膜完整性从而杀死细胞,也可通过抑制蛋白质、DNA和RNA的合成,或相互作用有特定的细胞内目标,从而达到抑菌或杀菌效果[16-19]。然而抗菌肽的抗菌活性及其生物学特性,受到肽链长度、氨基酸组成和空间结构等因素的影响[20-21]。因此,可以通过优化肽氨基酸组成及其数量,改变肽链长度或是拼接组成新型杂合抗菌肽,获取较理想的抗菌肽片段。自然界中虽存在大量抗菌肽,但提取不易、提取成本高,故此采用基因工程技术生产抗菌肽是目前首选的方式。该技术成熟并具有一定的预测性。生产前可以通过生物信息学方式,对抗菌肽理化性质进行系统分析,进而对所生产抗菌肽抗菌效果及其抗菌方式进行评估。
本研究选取抗菌肽为蜂毒肽和金环蛇抗菌肽,分别源于蜜蜂和金环蛇两个物种。蜂毒肽是蜂毒的主要成分,由26个氨基酸组成,具有两极性。小剂量蜂毒肽具有广泛的抗炎作用,高剂量蜂毒肽会引起局部疼痛、瘙痒和发炎等症状[22];蜂毒肽为致敏肽,需要降低致敏性再投入使用。金环蛇抗菌肽由30个氨基酸组成,具有抗菌、抗炎、调节机体免疫作用,其负面报道鲜少[23]。本研究将蜂毒肽和金环蛇抗菌肽融合表达形成56个氨基酸新肽,其作用是否具有二者效果有待进一步研究。通过生物信息学分析,发现新肽具有抗菌肽显著特点,新型杂合肽为阳离子肽,具有两亲性,主要有α螺旋和β折叠结构组成。推测该融合肽具有一定抗菌效果。该合成肽通过蛋白质功能预测发现该肽为蛋白酶抑制剂类肽动物机体内酶系繁多,可降解不同底物。本研究通过酶切位点分析发现,杂合肽Melitten-cathelicidin_BF能被18种蛋白酶消化,虽不利于该杂合肽在机体内稳定存在,但有助于消除生物潜在危害,提高抗菌肽生物安全性。杂合肽Melitten-cathelicidin_BF多次被酶解转化,易形成小分子氨基酸类物质,易于机体吸收。基于杂合肽Melitten-cathelicidin_BF潜在威胁较小,有望成为新型抗生素替代添加剂饲料,从而解决畜牧业中微生物耐药等健康养殖问题。
3 结 论
杂合肽Melitten-cathelicidin_BF为人工合成小分子、无信号肽、无跨膜区,且该杂合肽为阳离子肽,可通过静电吸附作用达到抗菌效果。该肽易被生物体内多种蛋白酶酶解,故此具有良好的安全性,具有作为抗菌饲料添加剂潜力。
