EGFR、TSP1在贲门癌组织中的表达及临床意义
2022-10-27左德宇刘亚清
王 田 左德宇 刘亚清
河南省商丘市第一人民医院消化内科 476100
贲门癌(Adenocarcinoma of gastric cardia,AGC)又称胃食管交界腺癌,指胃部和食管黏膜交界处线下3cm范围内的恶性肿瘤,临床上具有早期诊断滞后、预后差等特点[1-2]。近几年发病率逐渐升高,已成为威胁人们健康的恶性肿瘤之一,因此研究AGC的发病机理和术后观察具有重要意义。有研究表明,表皮生长因子受体(Epidermal growth factor receptor,EGFR)的表达有助于肿瘤的发展、血管生成、转移和浸润,目前已成为肿瘤分子治疗的靶点[3-4]。凝血酶敏感蛋白-1(Thrombin sensitive protein, TSP1)属于内源性的血管生成抑制剂,可通过抑制血小板的聚集,降低细胞黏附性,减少血管生成来抑制肿瘤的发生与发展[5-6]。在正常的生理状态下,促血管生成因子和抑血管生成因子保持着微妙的动态平衡,当机体发生癌变时,这种平衡状态将会被打破,促血管生成因子增多或/和抑血管因子减少[7]。因此,在临床上研究促血管生成因子与抑血管生成因子的表达水平具有重大的意义。但是关于AGC组织中EGFR、TSP1水平研究未见报道,本文采用免疫组化法探究二者在AGC患者体内的表达情况及与预后关系,以期为AGC发生发展的研究提供一定的参考指标。
1 资料与方法
1.1 临床资料 收集我院2016年3月—2018年3月收治的AGC患者90例。所有患者均经手术治疗,且均经临床病理科证实为AGC患者。本组患者年龄24~82岁,平均年龄(48.27±5.47)岁;男59例,女31例;TNM分期:Ⅰ~Ⅱ期29例,Ⅲ期61例;有淋巴结转移58例,无淋巴结转移32例;病理类型:高分化腺癌21例、中分化腺癌32例,低分化腺癌37例。纳入标准:(1)患者及家属对本次研究知情;(2)患者经临床病理诊断确诊为AGC,术前均未接受放疗或化疗等治疗手段。排除标准:(1)心脏病、高血压、肾脏、肝脏等疾病;(2)合并有其他恶性肿瘤不可进行手术治疗者。同时选取每例患者距离肿瘤边缘5cm以上切缘正常的胃黏膜组织作为对照组。
1.2 试剂和仪器 鼠抗人EGFR,鼠抗人TSP1购于美国Neomarker公司(稀释比例为1∶100)。
1.3 样品收集和保存 (1)组织样品:所有患者均在手术中取贲门处病灶组织6块(体积约为1cm3,AGC组)和距离肿瘤边缘5cm以上切缘正常的胃黏膜组织(对照组),用无菌水冲洗3次后置于液氮罐中过夜,最后放置于-80℃冰箱中(所有操作在取样10min内完成)。
1.4 实验方法 采用免疫组化法测定受试者贲门组织中EGFR、TSP1表达情况,用已知阳性的病理切片、PBS代替一抗分别作为阳性和空白对照。操作步骤如下:将石蜡包埋的组织切成厚度3~5μm的切片,烘干、二甲苯脱蜡,脱水、修复后滴加鼠抗人EGFR、TSP1单克隆抗体,经过孵育、PBS冲洗后滴加二抗,随后在经过孵育、复染等过程后固定,显微镜下观察。
1.5 结果判定 实验结果由三位专业人员共同进行评定,EGFR阳性主要表达于细胞膜或细胞质,TSP1阳性主要表达于细胞质。阳性强度评分为0、1、2、3分,分别代表无染色、浅黄色、黄色、棕黄色;任意选3个高倍视野计算阳性细胞所占比例,评分为0、1、2、3分,阳性细胞所占比例分别为<10%、10%~<30%、30%~<60%、≥60%。以染色强度与阳性细胞所占比例的评分乘积评估EGFR、TSP1表达情况,将评分划分为4个等级,即0~1分、2~3分、4~6分、7~9分,分别表示阴性(-)、弱阳性(+)、中度阳性(++)、强阳性(+++)。其中-和+为EGFR、TSP1低表达,++和+++为EGFR、TSP1高表达。
1.6 统计学方法 用SPSS22.0软件处理数据及绘图,计数资料以[n(%)]表示,行χ2检验;计量资料以均数±标准差表示,行t检验。EGFR、TSP1水平与AGC患者生存率的关系以Kaplan-Meier生存曲线进行分析,并使用COX回归模型分析影响AGC患者预后的危险因素。以P<0.05表示差异有统计学意义。
1.7 随访 患者治疗后接受12~48个月的随访,随访形式为门诊复查、上门或电话询问,随访终点为患者死亡或随访至2018年4月30日,记录患者的死亡时间和生存人数。
2 结果
2.1 AGC组织及正常组织EGFR、TSP1水平对比 AGC组织中EGFR阳性表达率显著高于对照组(P<0.05);TSP1阳性表达率明显低于对照组(P<0.05)。见表1。

表1两组EGFR、TSP1表达水平对比[n(%)]
2.2 EGFR、TSP1水平与AGC患者临床病理指标的关系 EGFR、TSP1水平与AGC的分化程度、淋巴转移、TNM分期密切相关(P<0.05);与AGC患者的年龄、性别没有相关性(P>0.05)。见表2。
2.3 EGFR、TSP1水平与AGC患者生存率的关系 EGFR高表达者中位生存时间明显短于EGFR低表达者(17.44个月VS 25.54个月,P<0.05),见图1;TSP1低表达者中位生存时间明显短于TSP1高表达者(16.83个月VS 25.40个月,P<0.05),见图2。
2.4 影响AGC患者预后的危险因素分析 TNM分期(Ⅲ)、EGFR高表达、TSP1低表达是影响AGC患者不良预后的独立危险因素(P均<0.05),见表3。
3 讨论
AGC过去一般被认为是胃癌或者食管癌的一种,但是随着医学技术的进步,通过胃镜检查和病理学诊断将其独立出来进行研究。到目前为止AGC的发生发展原因尚不清楚,学术界大多认为AGC的发生发展是多阶段病理改变的过程,是环境因素和遗传因素共同作用的结果。近几年AGC患者呈年轻化的趋势发展,并且AGC患者死亡率高、医疗花费高,因而给患者及家属带来巨大的精神和经济压力,因此研究与AGC发生发展相关的生物标志物用于AGC的早期诊断或术后观察已成为目前研究的热点内容。
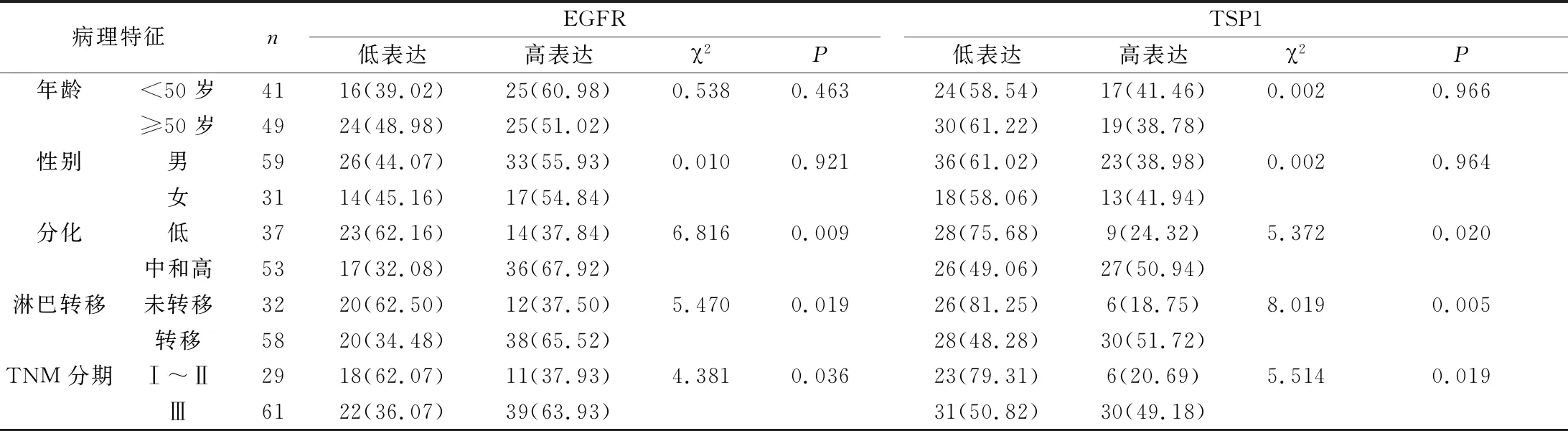
表2EGFR、TSP1与AGC患者临床病理指标的关系[n(%)]
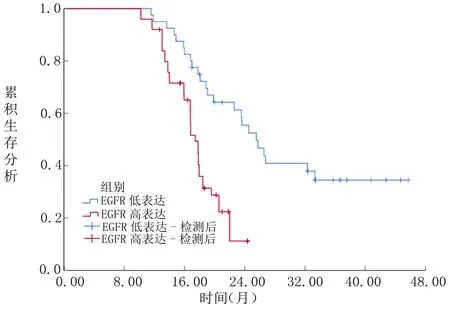
图1EGFR水平与AGC患者生存率的关系
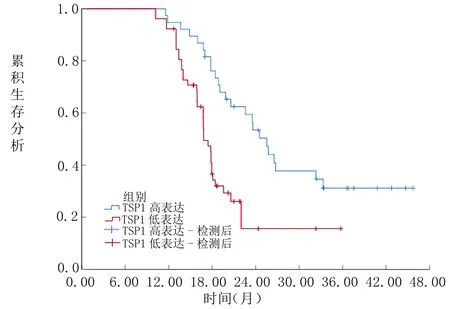
图2TSP1水平AGC患者生存率的关系
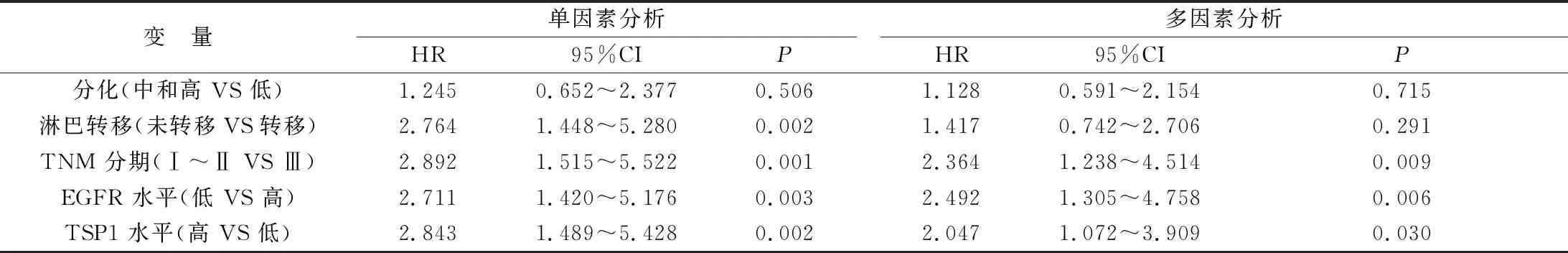
表3影响AGC患者预后的危险因素分析
肿瘤的发生是局部组织细胞发生无控增殖的现象,肿瘤的生成需要血管输送大量营养物质,因此阻断血管生成切断肿瘤营养补给线是治疗肿瘤的新途径。EGFR是硌氨酸激酶家族中的一员,在胃癌、肺腺癌、乳腺癌、结肠癌等组织中可高表达。蒋龙翔等[8]研究发现EGFR在肺腺癌患者的胸腔积液和腺癌组织中具有较高的阳性表达率,可作为肺腺癌靶向治疗的临床指标。姜明明等[9]研究表明EGFR在肺腺癌患者基因突变率显著提高,为临床肺腺癌的诊治提供了理论依据。本文结果表明,与对照组相比,AGC组EGFR阳性率升高,说明EGFR与AGC相关。此外发现,EGFR水平与AGC的分化程度、淋巴转移、TNM分期密切相关,提示EGFR可能发挥促血管生成作用参与AGC的发生发展过程。生存分析表明EGFR高表达AGC患者中位生存时间短于EGFR低表达患者,COX多因素分析说明EGFR高表达是影响AGC患者不良预后的危险因素,提示EGFR高表达AGC患者预后差,此类患者应注重术后恢复,以免复发。
TSP1是一种细胞外糖基质蛋白,是血管生成抑制因子之一,作为候选抑癌基因被广泛研究报道。田生平等[10]研究发现在肾上腺皮质肿瘤组织中,mTOR信号通路过度激活能够上调VEGF表达水平,下调TSP1表达水平,从而促进细胞侵袭和血管生成。Lopez-Ramirez等[11]研究表明下调TSP1表达水平有助于小鼠脑微血管内皮细胞增殖,导致脑海绵状畸形,使用血管生成抑制剂可缓解病症。本文发现,与对照组相比,AGC患者组织中的TSP1阳性率明显降低,提示TSP1与贲门癌相关。此外发现,TSP1水平与AGC的分化程度、淋巴转移、TNM分期密切相关,说明TSP1低表达不能有效抑制癌变组织血管的生成,从而参与AGC的发生发展过程。生存分析表明TSP1低表达AGC患者中位生存时间短于TSP1高表达患者,COX多因素分析说明TSP1低表达是影响AGC患者不良预后的危险因素,提示TSP1低表达AGC患者预后差,此类患者应定期复查。在贲门癌中,TSP1甲基化导致机体正常生理条件下血管生成平衡,可能导致具有促血管生成和免疫抑制的TGF-β升高[12]。随后有研究发现,TGF-β通过典型的Smad3和ERK/Sp1信号传导途径使EGFR活化并促进乳腺癌的迁移和侵袭[13]。说明二者可能通过某种机制共同参与AGC的发生与发展,可能TSP1低表达,使得机体血管生成平衡打破,导致EGFR高表达。但具体作用机制未见相关报道,后续二者相互作用的机制研究是以后工作的重点。
综上所述,EGFR在AGC患者组织中呈高表达,TSP1呈低表达,与AGC的分化程度、淋巴转移、TNM分期密切相关,是影响AGC患者不良预后的危险因素。但是由于本研究纳入样本量较少,关于二者在AGC发生发展中的具体机制还有待进一步深入分析。
