SOMATOMForce双源CT颅脑灌注联合sdLDL-C、MOTS-c在急性脑梗死中的诊断价值*
2022-10-27刘国芬李志钊郭炜邹玉林
刘国芬,李志钊,郭炜,邹玉林
(广州医科大学第三附属医院1. 放射科,2.神经科,广东 广州 510150;3.浙江大学医学院附属第四医院 放射科,浙江 义乌 322000)
急性脑梗死(acute cerebral infarction, ACI)又称为急性缺血性脑卒中,是常见的神经系统疾病。ACI 患者脑部动脉血管粥样硬化,导致血栓形成,造成脑部的血流灌注缺乏,以及脑组织的缺血、缺氧,进一步损坏脑组织[1]。近年来,颅脑CT 灌注成像(CT perfusion imaging, CTP)已逐步应用于ACI 的诊断,通过实时反映缺血的脑组织具体血流动力学情况,可早期明确显示具体的缺血位置、范围及程度,其中双源CT 灌注成像可降低管电压及辐射剂量,并保证良好的图像质量[2-3]。同时,寻找敏感的生物标志物一直是临床研究的重点,可辅助影像学检查,对准确诊断ACI 及有效评估预后具有重要意义。尽管既往研究报道[4]白细胞介素-6、C 反应蛋白等炎症标志物与疾病有相关性,但诊断特异性偏低,容易导致假阳性,影响治疗的准确性或过度治疗。小而密低密度脂蛋白胆固醇(small dense low density lipoprotein cholesterol,sdLDL-C)、线粒体衍生肽(mitochondrial open reading frame of the 12S rRNA-c, MOTS-c)均与动脉粥样硬化的发生、发展密切相关,其中sdLDL-C 可诱导血管内泡沫细胞的形成而促进动脉粥样硬化,MOTS-c 可抑制内皮细胞的炎症反应、保护血管内皮功能,从而抑制动脉粥样硬化发生[5-6]。本文拟探讨SOMATOM Force 双源CT 颅脑灌注参数、sdLDL-C、MOTS-c 与ACI 的相关性,以及对ACI 的诊断价值,旨在为临床早期诊断ACI 提供指导。
1 资料与方法
1.1 一般资料
选取广州医科大学第三附属医院2019年5月—2020年8月治疗的疑似ACI 患者102 例。纳入标准:①所有患者均符合2018年版《中国急性缺血性脑卒中诊治指南2018》[7]的诊断标准,感觉障碍麻木、失语、共济失调、偏瘫,伴有头痛、呕吐等;②所有患者均在发病6 h 内接受SOMATOM Force 双源CT 颅脑灌注检测;③既往并未出现缺血性、出血性脑卒中;④头颅CT 或MRI 证实并除外脑出血。排除标准:①大面积的脑梗死、昏迷患者;②合并严重心、肝、肾功能不全;③有活动性出血性疾病、颅内出血、凝血障碍、颅内肿瘤、动静脉畸形及动脉瘤者;④对碘对比剂过敏,妊娠及哺乳期女性。本研究经医院医学伦理委员会批准,患者及其监护人均知情且自愿签署知情同意书。
1.2 方法
采用西门子SOMATOM Force 系列双源CT(德国西门子公司)进行扫描。首先行头颅CT 平扫,从颅底到颅顶,头先进。扫描参数设置如下:自动管电流调制技术(344、303 mA),管电压100 kV,层厚5 mm,层间距3 mm,矩阵512×512。颅脑灌注扫描方案:首先使用双筒高压注射器(美国泰科国际有限公司)以5 mL/s 的速率注射50 mL 碘克沙醇(含碘320 mg/mL)(江苏恒瑞医药股份有限公司),管电压100 kV,矩阵512×512,管电流根据软件自动调制(30~440 mA),延迟时间4 s,行高级模拟迭代重组,集频次21 次,总扫描37.5 s。扫描结束传输数据至Syngo 图像工作站,采用Neuro Perfusion 软件处理图像,选择圆形工具勾画感兴趣区,勾画面积约为0.5 cm2,可获得相应灌注参数:脑血容量(cerebral blood volume, CBV)、脑血流量(cerebral blood flow,CBF)、达峰时间(time to peak, TTP)、平均通过时间(mean transit time, MTT)。所有患者入院次日清晨采集空腹外周肘静脉血4 mL,3 000 r/min 离心10 min,取上清液,采用全自动生化分析仪和酶联免疫吸附试验检测sdLDL-C 和MOTS-c 水平,试剂盒购自上海酶联生物科技有限公司。
1.3 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料以均数±标准差(±s)表示,比较采用t检验;计数资料以构成比或率(%)表示,比较采用χ2检验;相关性分析采用Pearson 法;影响因素的分析用逐步多因素Logistic 回归分析;绘制ROC 曲线。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者一般资料的比较
102 例患者经脑部CT 及磁共振成像检查确诊ACI 78 例(ACI 组),无ACI 24 例(无ACI 组)。两组患者的性别构成、年龄、吸烟、体质量指数、高血压、高脂血症、糖尿病比较,差异无统计学意义(P>0.05);两组患者的CBV、CBF、MTT、TTP、MOTS-c、sdLDL-C 比较,差异有统计学意义(P<0.05),ACI 组患者CBV、CBF、MOTS-c 低于无ACI 组,MTT、TTP、sdLDL-C 高于无ACI 组(见表1)。ACI 典型病例的脑部CT 及磁共振成像见图1。

图1 ACI典型病例的脑部CT及磁共振成像

表1 两组患者一般资料的比较
2.2 血清MOTS-c、sdLDL-C 与SOMATOM Force双源CT灌注参数的相关性
Pearson 相关分析显示,MOTS-c 与CBV、CBF 呈正相关(r=0.435 和0.457,均P=0.000),与MTT、TTP 呈负相关(r=-0.523 和-0.422,均P=0.000);sdLDL-C 与CBV、CBF 呈负相关(r=-0.427 和-0.443,均P=0.000),与MTT、TTP 呈正相关(r=0.486 和0.414,均P=0.000)。见表2。

表2 血清MOTS-c、sdLDL-C与SOMATOM Force双源CT灌注参数的相关性
2.3 ACI危险因素的逐步多因素Logistic回归分析
以ACI 为因变量(1 =是,0 =否),以CBV、CBF、MTT、TTP、MOTS-c、sdLDL-C 为自变量(均以实际值进行赋值),采用逐步多因素Logistic 回归分析,α入=0.05,α出=0.10,结果:CBV [=0.352(95% CI:0.145,0.858)]、CBF [=0.397(95% CI:0.194,0.816)]、MOTS-c [=0.456(95% CI:0.255,0.815)]为ACI 的保护因素(P<0.05);MTT [=2.022(95% CI:1.392,3.075)]、TTP [=1.931(95% CI:1.085,3.436)]、sdLDL-C [=2.416(95% CI:1.085,5.513)]为ACI 的危险因素(P<0.05)。见表3。

表3 ACI危险因素的逐步多因素Logistic回归分析参数
2.4 MOTS-c、sdLDL-C、SOMATOM Force 双源CT颅脑灌注对ACI的诊断价值
ROC 曲线显示,MOTS-c、sdLDL-C、SOMATOM Force 双源CT 颅脑灌注及联合诊断的敏感性分别为71.8%、83.3%、79.5% 和85.9%,特异性分别为83.3%、83.3%、70.8%和87.5%,MOTS-c、sdLDL-C、SOMATOM Force 双源CT 颅脑灌注曲线下面积分别为0.818(95% CI:0.705,0.932)、0.788(95% CI:0.670,0.907)、0.804(95% CI:0.712,0.896),均明显小于联合诊断的0.877(95%CI:0.779,0.973)。见表4和图2。
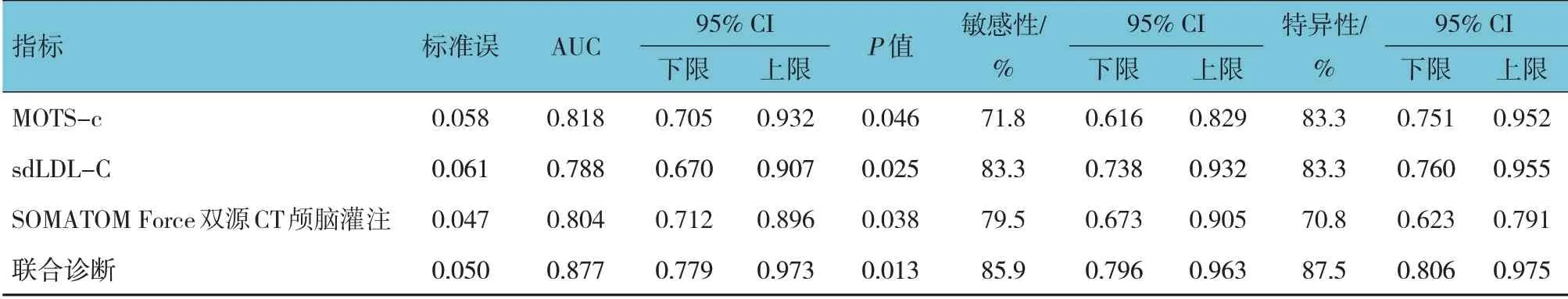
表4 MOTS-c、sdLDL-C、SOMATOM Force双源CT颅脑灌注及联合诊断对ACI的诊断效能
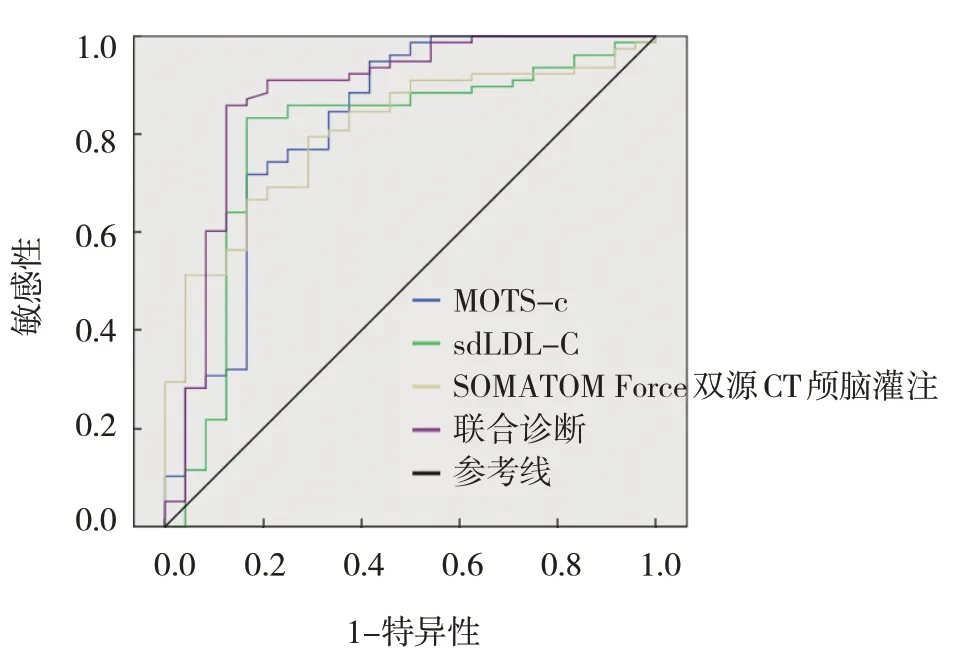
图2 MOTS-c、sdLDL-C、SOMATOM Force双源CT颅脑灌注及联合诊断ACI的ROC曲线
3 讨论
ACI 主要临床症状包括感觉运动障碍、恶心呕吐,严重者昏迷不醒,统计数据显示1年内死亡/残疾率高达45%,甚至影响患者生活质量并危及生命,因此及早诊疗具有重要临床意义[8]。目前,ACI 的诊断包括CT 扫描、磁共振成像等影像学手段及卒中量表评分,其中影像学检查可有效排除出血性脑卒中,但磁共振不适用于体内有金属支架的患者,而CT 检查在梗死早期不能良好显示缺血病灶,因此临床应用存在局限性[9]。CTP 检查禁忌证较少,检查速度快,通过及时反映缺血脑组织的血流灌注状态而准确显示脑缺血情况,其中灌注参数(CBV、CBF、MTT 和TTP)可定量描述,识别可逆转缺血半暗带与不可逆性核心梗死区,以及评估狭窄或闭塞的供血动脉,对ACI 的早期诊断具有重要指导意义[10]。本研究的102例疑似ACI 患者中,78 例经脑部CT 及磁共振成像确诊,其中ACI 组患者的CBV、CBF 低于无ACI 组,MTT、TTP 高于无ACI 组,表明ACI 患者的CBV、CBF及血流灌注速率偏低,与既往研究结果一致。ACI 患者脑部动脉血管粥样硬化,脑部血流灌注不足,如脑微小动脉、深部穿通动脉病变导致局部脑组织缺血,在缺血发生30 min 后可在CTP 图像上发现对应的灌注异常区,灌注参数异常,表明患者灌注缺损[11]。CT颅脑灌注对ACI 的诊断具有延后性,即需要临床表现出较为明显的脑部血流灌注不足,才能有效确诊,另外CTP 对于基底节区、脑干较小的早期脑梗死病灶敏感性较低,该类可疑患者即使CT 灌注成像显示为阴性,临床上仍需提高警惕[11-12]。
血清标志物取材、检测简便快速,且普遍具有极高的敏感性,已成为临床辅助诊断、评估ACI 的重要手段。脑部动脉血管粥样硬化在ACI 的发生、发展中具有重要调控作用,引起的脑组织缺血缺氧可导致自由基损伤、炎症反应、细胞凋亡,血清sdLDL-C、MOTS-c 分别在动脉粥样硬化中发挥正性、负性调控作用,目前关于两者与ACI 的关系尚未有明确报道。本研究结果显示,ACI 组患者的血清MOTS-c 水平低于无ACI 组,sdLDL-C 高于无ACI 组,表明sdLDL-C、MOTS-c 与ACI 的发生密切关联。MOTS-c 是线粒体分泌的保护血管内皮细胞的短肽,通过活化AMP 依赖的蛋白激酶(adenosine 5'-monophosphate-activated protein kinase, AMPK)调节内皮细胞能量供给、抑制凋亡、活化内皮一氧化氮合酶以及抑制炎症反应,对维持血管内皮细胞稳态以及稳定动脉硬化粥样斑块具有重要作用[13-14]。sdLDL-C 是心血管疾病的独立预测因素,可通过诱导血管内单核细胞产生巨噬细胞,继而促进泡沫细胞的产生,加重动脉粥样硬化进展,与脑梗死的发病及脑损伤病情严重程度有关[15]。同时,本研究通过Pearson 相关分析显示血清sdLDLC、MOTS-c 与CT 颅脑灌注参数有相关性,进一步证实血清sdLDL-C、MOTS-c 可通过调控机体动脉粥样硬化状态而影响颅脑血流灌注,反映ACI 进展。另外,逐步多因素Logistic 回归分析显示CBV、CBF、MOTS-c 是ACI 的保护因素,而MTT、TTP、sdLDL-C 是ACI 的危险因素,表明sdLDL-C、MOTS-c 与CT 颅脑灌注参数可用于评估ACI 的发生风险。ROC 曲线显示,MOTS-c、sdLDL-C、CT 颅脑灌注诊断ACI 的曲线下面积均接近0.818,低于联合诊断的0.877,表明在CT 颅脑灌注诊断基础上配合血清标志物(MOTS-c、sdLDL-C)检测可提高ACI 的诊断效能。陈鹏军等[11]通过分析低剂量双源CT 颅脑灌注成像对超急性期脑梗死的诊断价值,发现部分脑梗死前期患者脱落的微小栓子部分堵塞供血动脉,进而导致继发性动脉反射性痉挛,功能区脑组织缺血,CT 颅脑灌注成像显示灌注异常,之后由于内源性、外源性的溶栓酶集聚而再通脑血管,脑组织恢复再灌注,故而1 周内MRI复查显示未见明确脑梗死征象,这种短暂性脑缺血发作缓解期的不稳定性容易导致CT 颅脑灌注的误诊,从而影响诊断效能。血清MOTS-c、sdLDL-C 可直接反映动脉粥样硬化斑块的稳定性,如血清MOTS-c 水平的降低导致纤维细胞表达的胶原蛋白减少,纤维帽变薄,进而增加斑块的不稳定性,使得斑块易于破裂,增加血栓形成及血管堵塞风险[16],因此配合CT 颅脑灌注成像可从动脉粥样硬化斑块状态、颅脑血流状态等多个方面评估ACI 的进展,从而利于临床早期诊断。CT 灌注成像是发病6 h 内的图像,而血清是次日清晨采集的,本身存在人为误差,血清采集的延迟对指标水平的影响程度尚不明确,因此可进一步选择次日清晨采血为发病6 h 以内的患者为研究对象,从而避免血清采集延迟的影响。
综上所述,sdLDL-C、MOTS-c 在ACI 患者中异常表达,与CT 颅脑灌注参数存在相关性,联合检测ACI有较高诊断价值。
