血清sHLA-G、PGR联合幽门螺杆菌检测在老年人群早期胃癌筛查中的价值
2022-10-27马沁妍赵君宁周希乔
马沁妍,赵君宁,周希乔
(1.南京医科大学第一附属医院 消化内科,江苏 南京 210029;2.江苏省省级机关医院消化内科,江苏 南京 210024)
胃癌是临床中常见的恶性肿瘤之一,其发病率、病死率分别居全球恶性肿瘤第四位和第二位[1]。胃癌早期由于缺乏明显的临床体征、症状,临床早期确诊难度较大,但早期筛查对临床治疗和改善预后意义重大,及早发现患者癌变情况有利于提高临床治疗效果,延长生存期,降低病死率[2]。近年来,老年人群胃癌比例升高,而老年人群多伴有较多基础疾病,存在不能耐受胃镜检查等情况,限制其通过胃镜筛查胃癌,因此,简便易行的血清学联合检测对老年人群的胃癌筛查更易普遍实施,具有重要意义[3]。目前临床中常通过检测胃蛋白酶原比值(pepsinogen ratio, PGR)对胃癌进行筛查,但采用单一指标对癌前病变及早期胃癌的诊断效果不甚理想,还有待进一步提高[4-5],亟待寻找更有效的方法对早期胃癌进行筛查。血清可溶性人白细胞抗原-G(soluble human leukocyte antigen-G, sHLA-G)是一种经典的主要组织相容性抗原,其在肿瘤的免疫逃逸中可能具有重要作用,肿瘤细胞sHLA-G 过表达可通过抑制肿瘤T 细胞及NK 细胞的增殖,进而有利于肿瘤细胞逃避宿主的免疫反应[6]。幽门螺杆菌(helicobacter pylori, Hp)感染是诱发胃癌的主要因素之一,Hp 被认为是胃癌的致病源,与胃癌的发生密切相关[7]。血清sHLA-G、PGR、Hp 及三者联合检测是否能够提高对老年人群早期胃癌筛查的诊断效能目前尚不可知。鉴于此,本研究回顾性分析223 例因胃部不适进行检查的患者的临床资料,探讨血清sHLA-G、PGR 联合Hp 检测对老年人群早期胃癌筛查的意义。
1 资料与方法
1.1 临床资料
回顾性分析2020年2月—2021年12月 江 苏省省级机关医院消化内科因胃部不适进行检查的223 例患者的临床资料。其中,男性137 例,女性86 例;年龄67~92 岁,平均(75.40±9.23)岁;体质量指数(BMI)19.14~26.35 kg/m2,平均(22.19±3.06)kg/m2。纳入标准:①临床资料完整;②年龄>65 岁;均进行血清sHLA-G、PGR 及Hp 检测;④进行临床病理检查。排除标准:①已确诊为癌前病变或胃癌,并进行治疗者;②重要脏器功能障碍者;③有胃切除或黏膜切除手术史;④近3 个月服用过影响sHLA-G、PGR 等指标药物者;⑤不配合检查者;⑥近6 个月有Hp 根除史。本研究经医院医学伦理委员会批准,患者及家属签署知情同意书。
1.2 血清sHLA-G、PGR、Hp检测及病理检查
抽取所有研究对象清晨空腹静脉血5 mL,常温下静置30 min 后,1 200 r/min 离心10 min 后分离血清(离心半径为8 cm),采用双抗体夹心酶联免疫吸附试验[8]检测sHLA-G 水平;采用化学发光法[9]检测胃蛋白酶原Ⅰ(Pepsinogen I,PGⅠ)、胃蛋白酶原Ⅱ(Pepsinogen Ⅱ,PGⅡ),并计算PGR(检测试剂盒购自上海通蔚生物科技有限公司)。采用13C 尿素呼气试验对患者行Hp 定性检测,12C/13C 比值>4则判定为阳性[10](试剂盒购自北京瑞美科技有限公司)。
病理检查[11]:所有患者均行常规胃镜病理检查,置入电子胃镜后,在其胃窦和胃体大小弯、胃角病变处取小块标本,取材深度达黏膜肌层,并用甲醛固定,石蜡包埋后进行切片(厚度约5 μm),染色后于光学显微镜下观察。
1.3 观察指标
可能影响早期胃癌发生的临床资料,包括性别、年龄、是否合并基础疾病(高血压、糖尿病、冠心病)、吸烟史、饮酒史、是否有恶性肿瘤家族病史、饮食是否规律、饮食喜好(喜硬/干食、喜烫/凉食、喜重盐饮食)及白蛋白、血红蛋白、肌酐、胃泌素-17、sHLA-G、PGⅠ、PGⅡ、PGR 水平,以及Hp 阳性率。
1.4 统计学方法
数据分析采用SPSS 18.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或方差分析,进一步两两比较用LSD-t法;计数资料以例(%)表示,比较用χ2检验;多因素Logistic 回归分析影响早期胃癌发生的危险因素;绘制受试者工作特征(ROC)曲线,以曲线下面积(AUC)对筛查价值进行评估。P<0.05 为差异有统计学意义。
2 结果
2.1 临床病理诊断结果
223 例患者病理检查结果经临床确诊,早期胃癌36 例,癌前病变52 例(慢性萎缩性胃炎伴肠上皮化生24 例、异型增生28 例),慢性萎缩性胃炎(不伴有肠上皮化生)60 例,慢性浅表性胃炎75 例。
2.2 不同病变类型患者血清sHLA-G、PGR 及Hp阳性率比较
胃癌、癌前病变、慢性萎缩性胃炎及慢性浅表性胃炎患者血清sHLA-G、PGR 水平及Hp 阳性率比较,经方差分析,差异有统计学意义(P<0.05),胃癌、癌前病变及慢性萎缩性胃炎患者血清sHLA-G、Hp 阳性率高于慢性浅表性胃炎患者(P<0.05),PGR 低于慢性浅表性胃炎患者(P<0.05);胃癌、癌前病变患者血清sHLA-G、Hp 阳性率高于萎缩性胃炎患者(P<0.05),PGR 低于萎缩性胃炎患者(P<0.05);胃癌患者血清sHLA-G、Hp 阳性率高于癌前病变患者(P<0.05),PGR 低于癌前病变患者(P<0.05)。见表1。

表1 不同病变类型患者血清sHLA-G、PGR水平及Hp阳性率比较
2.3 胃癌与非胃癌患者临床资料的比较
胃癌与非胃癌患者性别、年龄、BMI、合并症、吸烟史、饮酒史、恶性肿瘤家族病史、喜硬/干食、白蛋白、血红蛋白及肌酐水平比较,经χ2或t检验,差异无统计学意义(P>0.05);胃癌与非胃癌患者饮食不规律、喜烫/凉食、喜重盐饮食及胃泌素-17、sHLA-G、PGⅠ、PGⅡ、PGR,以及Hp 阳性率比较,经χ2或t检验,差异有统计学意义(P<0.05),胃癌患者饮食不规律、喜烫/凉食、喜重盐饮食及胃泌素-17、sHLA-G、PGⅡ及Hp 阳性率均高于非胃癌患者,PGⅠ、PGR 低于非胃癌患者。见表2。
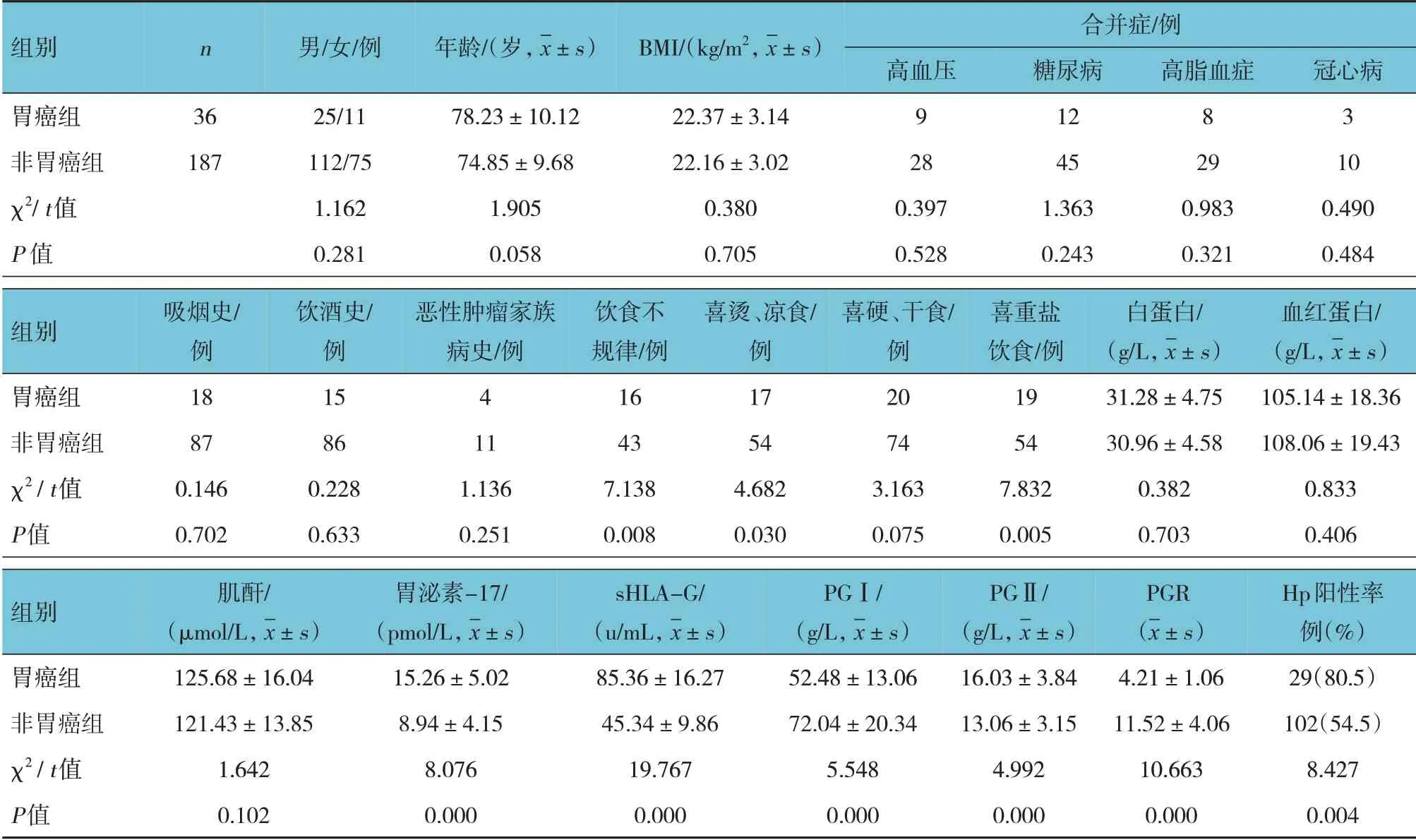
表2 胃癌与非胃癌患者临床资料的比较
2.4 影响老年人群早期胃癌发生的多因素Logistic回归分析
以饮食规律(是=1,否=0)、喜烫/凉食(是=1,否=0)、喜重盐饮食(是=1,否=0)、Hp(阳性=1,阴性=0)、胃泌素-17、sHLA-G、PGⅠ、PGⅡ及PGR(均为连续变量)为自变量,以是否发生早期胃癌为因变量(胃癌=1,非胃癌=0)进行多因素Logistic 回归分析,共有5 个自变量进入回归方程,5 个自变量对因变量的影响由大到小依次为sHLA-G、PGR、Hp 阳性、胃泌素-17、喜重盐饮食,5 个自变量的决定系数为R2=0.365(校正R2=0.361);多因素Logistic回归分析结果显示,喜重盐饮食[=2.790(95% CI:1.009,4.873)]、胃泌素-17[=2.956(95% CI:1.056,5.083)]、sHLA-G[=3.766(95% CI:2.083,10.459)]、PGR [=3.374(95% CI:1.845,76.762)]、Hp 阳 性[=3.124(95% CI:1.349,5.386)]是影响老年人群早期胃癌发生的危险因素(P<0.05)。见表3。

表3 影响老年人群早期胃癌发生的多因素Logistic回归分析参数
2.5 血清sHLA-G、PGR、Hp及三者联合对老年人群早期胃癌的筛查价值
ROC 曲线分析结果显示,血清sHLA-G、PGR、Hp 及三者联合对老年人群早期胃癌筛查的敏感性分别为77.78%(95% CI:0.604,0.893)、72.22%(95%CI:0.546,0.852)、80.56%(95% CI:0.634,0.912)和69.44%(95% CI:0.517,0.831),特异性分别为65.24%(95%CI:0.579,0.720)、74.87%(95%CI:0.679,0.808)、54.55%(95% CI:471,0.618)和96.79%(95% CI:0.928,0.987),AUC 分别为0.717(95%CI:0.653,0.775)、0.686(95%CI:0.621,0.746)、0.676(95%CI:0.610,0.736)和 0.883(95%CI:0.833,0.922)。见表4 和图1。
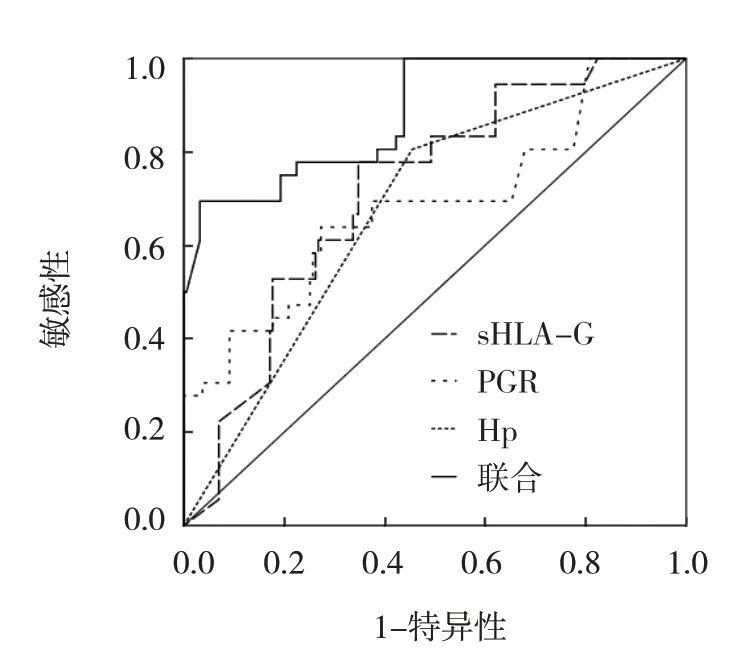
图1 血清sHLA-G、PGR、Hp及三者联合对老年人群早期胃癌筛查的ROC曲线
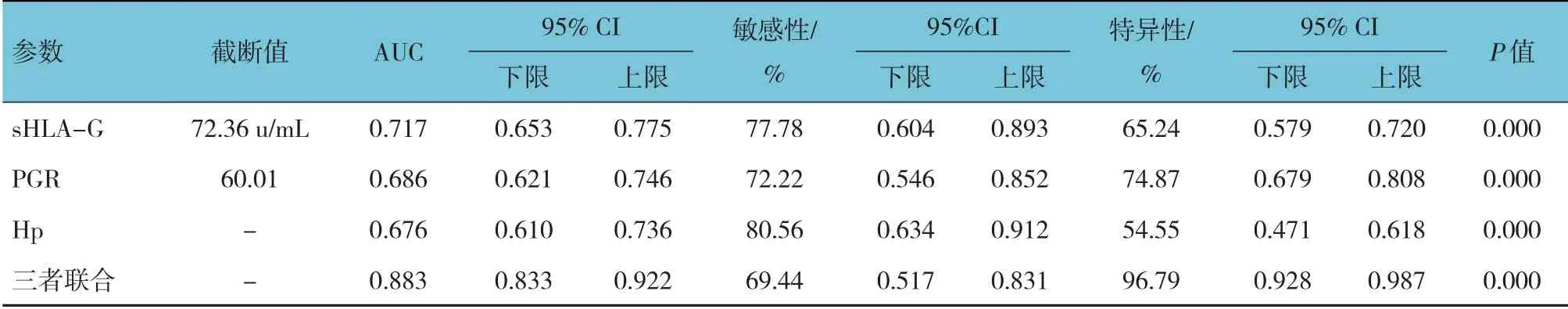
表4 血清sHLA-G、PGR、Hp及三者联合对老年人群早期胃癌筛查的诊断效能
3 讨论
胃癌起病较为隐匿,多数患者在出现腹痛、呕血等消化道症状后到医院就诊时已处于进展期[12]。据相关研究报道[13],早期胃癌5年生存率约为92%,远远高于进展期胃癌,故早期发现胃癌并及时进行治疗对改善患者预后至关重要。目前如何有效对早期胃癌进行筛查是临床医务工作者的研究热点。既往胃癌诊断的金标准为病理检查,其诊断效果确切但创伤较大,在临床应用中具有一定的局限性[14-15]。因此,血清sHLA-G、PGR 联合Hp 检测对老年人群早期胃癌的筛查具有十分重要的参考价值。
本研究中,223 例患者病理检查结果最终经临床确诊,早期胃癌36 例,癌前病变52 例,慢性萎缩性胃炎60 例,慢性浅表性胃炎75 例。本研究结果显示,胃癌患者血清sHLA-G、Hp 阳性率高于癌前病变、萎缩性胃炎及癌前病变患者,PGR 低于癌前病变、萎缩性胃炎及癌前病变患者,提示随着病变程度的加重,血清sHLA-G、Hp 阳性率异常偏高,PGR 异常偏低。本研究结果还显示,癌组饮食不规律、喜烫/凉食、喜重盐饮食及胃泌素-17、sHLA-G、PGⅡ及Hp阳性率均高于非胃癌组,PGⅠ、PGR 低于非胃癌组;并经多因素Logistic 回归分析显示,喜重盐饮食、胃泌素-17、sHLA-G、PGR、Hp 阳性是影响老年人群早期胃癌发生的危险因素,分析原因可能为,喜重盐饮食患者可能由于长时间饮食高盐食物,易损伤胃壁细胞,致使胃黏膜屏障被破坏,进而可在一定程度上增加老年人群早期胃癌的发生危险[16]。胃泌素-17 水平主要由胃内酸度、胃窦G 细胞数量调控,其可能通过介导胃Hp 感染增加胃癌的发生风险[17]。sHLA-G 为机体重要的免疫耐受分子之一,sHLA-G 过表达可直接抑制自然杀伤细胞功能,加速免疫逃逸,抑制机体抗肿瘤的免疫杀伤效应,同时还会妨碍机体对肿瘤免疫的监视,进而促进胃癌的发生发展[18-19]。PG为胃蛋白酶的前体,包括PGⅠ、PGⅡ两种同工酶原,主要由胃底、胃体的主细胞、颈黏液细胞分泌;PGR 可反映胃体黏膜腺体、细胞数量,同时还能够反映黏膜萎缩程度,为胃癌前兆的临床参考指标[20]。Hp 感染患者由于胃部亚硝胺含量增加,无法良好地修复损伤的DNA,可能致使上皮细胞异常增生,进而导致恶性潜能细胞恶化的发生风险[21]。故在临床中应对以上因素进行防控,以降低老年人群早期胃癌的发生率。ROC 曲线分析结果显示,血清sHLA-G、PGR 联合Hp 检测对老年人群早期胃癌筛查的价值较高,可为该类患者胃癌的诊断提供重要的参考价值。分析血清sHLA-G、PGR 及Hp 检测可作为老年人群早期胃癌筛查指标的机制可能为:血清sHLA-G 可在多数胃癌早期阶段表达,其表达水平与肿瘤位置、组织学分型、侵犯深度、机体免疫反应、临床分期、淋巴结转移等密切相关[22]。轻度胃炎可致使循环中PGⅠ、PGⅡ水平升高,同时随着胃炎的发展,逐渐发生胃体黏膜萎缩、肠上皮化生及上皮内瘤变,致使水平持续升高,PGⅠ水平降低,进而导致PGR 降低[23-24]。Hp 感染可在一定程度上增加胃癌的发生风险,萎缩性胃炎患者Hp 感染呈高发状态,其在慢性胃炎发展为胃癌过程中起到一定的启动作用[25]。故血清sHLA-G、PGR 及Hp 三者联合可提高对老年人群早期胃癌筛查的效能。
综上所述,血清sHLA-G、PGR 联合Hp 检测对老年人群早期胃癌筛查的诊断效能较高,可为该类患者胃癌的诊断提供重要的参考价值。在临床中建议加强对老年人群血清sHLA-G、PGR 及Hp 的检测,若存在异常应及时给予有效措施加以调控,以降低老年人群早期胃癌的发生风险。
