内镜下多点活检鉴别诊断克罗恩病和溃疡性结肠炎的临床价值*
2022-10-27王莹李红玲李静如汪银莹
王莹,李红玲,李静如,汪银莹
(1.徐州医科大学附属淮安医院 消化内科,江苏 淮安 223002;2.东部战区总医院淮安医疗区 消化内科,江苏 淮安 223001)
炎症性肠病(inflammatory bowel disease, IBD)是包括克罗恩病(Crohn disease, CD)和溃疡性结肠炎(ulcerative colitis, UC)在内的一组慢性非特异性肠道炎症性疾病[1]。CD 与UC 是两种不同的疾病,但存在诸多相似之处,其病因及发病机制均在探索阶段,临床均表现迁移反复、不易根治,故两者的鉴别诊断一直存在较大难度[2]。随着消化内镜技术的不断发展,胃肠镜及病理检查已成为诊断CD与UC 的主要方式。内镜下多点活检是在胃肠镜下观察到黏膜异常,但无法确定病变性质的情况下,采用活检钳取黏膜组织送病理诊断,从而确诊疾病的一种检查方式[3]。本研究通过回顾性分析47 例CD 患者及53 例UC 患者的临床资料,收集其内镜下活检病理切片,归纳其内镜下表现及活检病理学诊断结果,为IBD 的诊断提供一定参考。
1 资料与方法
1.1 研究对象
回顾性分析2019年3月—2022年3月在徐州医科大学附属淮安医院门诊就诊的47 例CD 患者(CD组)及53 例UC 患者(UC 组)的临床资料。纳入标准:①符合《对我国炎症性肠病诊断治疗规范的共识意见(2007年,济南)》[4]的关于CD 与UC 的诊断标准;②患者表现为腹泻、腹痛及发热等症状;③首次内镜下活检时间距发病2 个月左右。排除标准:①一般细菌性肠炎与特殊结核性肠炎等肠道炎症性疾病,大便培养观察到结核菌、真菌及阿米巴原虫;②临床资料缺失。本研究经医院医学伦理委员会批准,患者对研究内容知情同意并自愿签署知情同意书。
1.2 方法
1.2.1 收集临床资料及实验室指标检测通过医院病历系统收集患者的性别构成、发病年龄及病程;入院后采集患者空腹静脉血5 mL,抗凝后采用迈瑞BC-3000 Plus 全自动血细胞分析仪检查血小板计数;采用魏氏法检测红细胞沉降率。
1.2.2 回顾临床症状回顾患者腹痛、腹泻、血便、发热、贫血、肠外表现(关节肿痛、皮肤表现、口腔溃疡、肝胆表现、眼病变等)等临床症状发生情况。
1.2.3 内镜下检查回顾患者内镜检查结果。患者入院后采用日本Olympus 电子肠镜行多点活检,女性患者避开月经期。无渣半流质饮食3 d,检查前1 晚口服聚乙二醇电解质散进行肠道清洁。在病变部位取材,结直肠及回肠的活检部位≥5 个,且每个部位取材≥2 次。采用40%中性甲醛固定所获取的标本,石蜡包埋,常规制作切片。由两位年资>5年的病理医师共同完成病理学诊断报告。
1.3 统计学方法
数据分析采用SPSS 19.0 统计软件。计量资料以均数±标准差(±s)表示,比较采用t检验;计数资料以率(%)表示,比较用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组的临床资料、实验室指标比较
CD 组与UC 组的性别构成、发病年龄、病程、血小板计数、红细胞沉降率比较,差异无统计学意义(P>0.05)。见表1。

表1 两组临床资料、实验室指标比较
2.2 两组的临床症状比较
CD 组腹痛34 例,腹泻22 例,血便14 例,发热19 例,贫血20 例,有肠外表现9 例;UC 组腹痛32 例,腹泻42 例,血便40 例,发热11 例,贫血10 例,有肠外表现3 例。两组的腹痛率比较,经χ2检验,差异无统计学意义(P>0.05)。两组的腹泻率、血便率、发热率、贫血率及肠外表现率比较,经χ2检验,差异有统计学意义(P<0.05),UC组腹泻率、血便率高于CD 组,发热率、贫血率及肠外表现率低于CD 组。见表2。

表2 两组临床症状比较 %
2.3 两组内镜下表现比较
CD 与UC 内镜下表现见图1。两组内镜下表现,CD 组与UC 组的回盲部病变、乙状结肠病变、升结肠病变、直肠病变、病变节段分布、病变连续分布、环行溃疡、纵行溃疡、结节样增生、阿弗他溃疡、鹅卵石征的构成比比较,经χ2检验,差异有统计学意义(P<0.05),UC 组乙状结肠病变、直肠病变、病变连续分布、环行溃疡的构成比高于CD 组,回盲部病变、升结肠病变、病变节段分布、纵行溃疡、结节样增生、阿弗他溃疡、鹅卵石征的构成比低于CD 组。两组息肉样增生、肠腔狭窄的构成比比较,经χ2检验,差异无统计学意义(P>0.05)。见表3。
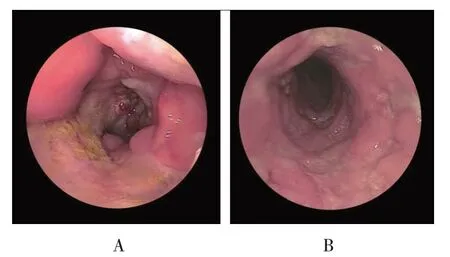
图1 CD与UC内镜下表现

表3 两组内镜下表现比较 例(%)

续表3
2.4 两组内镜下活检病理学诊断结果比较
CD 与UC 内镜下活检病理学表现见图2。两组内镜下活检病理学诊断结果:CD 组与UC 组黏膜表面不规则、绒毛样表面、腺体萎缩、腺体分支、腺体扭曲或不规则、局灶间断性炎症细胞浸润、肉芽肿样小结、表面上皮糜烂或变扁、黏液细胞数量减少、裂隙样溃疡、假幽门腺化生、急性隐窝炎、隐窝脓肿、固有层中性粒细胞数量增多的构成比比较,经χ2检验,差异有统计学意义(P<0.05)。UC 组黏膜表面不规则、绒毛样表面、腺体萎缩、腺体分支、腺体扭曲或不规则、表面上皮糜烂或变扁、黏液细胞数量减少、急性隐窝炎、隐窝脓肿、固有层中性粒细胞数量增多的构成比高于CD 组,黏膜局灶间断性炎症细胞浸润、肉芽肿样小结、裂隙样溃疡、假幽门腺化生的构成比低于CD 组。两组黏膜固有层单个腺核细胞数量增多、腺体基底部细胞数量增多、淋巴细胞滤泡形成或细胞聚集、潘氏细胞化生的构成比比较,经χ2检验,差异无统计学意义(P>0.05)。见表4。

图2 CD与UC内镜下活检病理学表现 (HE染色×400)

表4 两组内镜活检病理表现 例(%)
3 讨论
近年来,随着饮食结构及生活习惯的改变,CD 与UC 的发病率逐年攀升,对社会及患者家庭带来了沉重负担[5-7]。由于两者的治疗、预后均存在较大差异,因此,及时鉴别对于临床意义重大。当前内镜检查在CD 与UC 的诊断中已有较为广泛的应用,但将内镜所观察到的组织改变与通过内镜活检获取的组织病理学诊断结果联合鉴别两种疾病的意义尚未得到充分重视。分析原因为:相较于手术根治标本,内镜下活检获取的材料有限;病理医师对IBD 的病理变化缺少确切的了解;医师对IBD 的鉴别诊断经验不足,尚无成熟、公认的标准可遵循[8-9]。
本研究结果显示,两组的性别构成、发病年龄、血小板计数、红细胞沉降率比较,差异无统计学意义,但CD 组发热、贫血、肠外表现相对较多,UC 组腹泻、血便相对较多。在CD 组与UC 组的内镜下表现中,CD 通常累及近端结肠与回肠末端,但不累及直肠,病变表现为节段性。此外,CD 可累及至整个消化道,研究发现约40%的CD 患者同时累及结肠与小肠[10-11]。阿弗他溃疡是CD 最明显也是最早的黏膜溃疡,形成于黏膜淋巴小结,并表现为多灶样分布[12]。UC 内镜下表现通常为病灶常累及乙状结肠与直肠,病变表现为连续性而非节段性;增生部位通常表现为环形弥漫分布,无肠腔狭窄。
采用活检标本鉴别CD 与UC 时需沿用标准化、系统化的评估方式,包括结构改变、上皮改变及黏膜固有层变化(急性炎症、慢性炎症细胞浸润)[13-14]。本研究结果显示,UC 组黏膜表面不规则、绒毛样改变,腺体分支、萎缩及扭曲不规则等黏膜结构改变构成比明显高于CD 组。因此,当通过病理组织形态学难以鉴别两者时,患者发生以黏膜结构为主的变化应倾向于UC。炎症集中于黏膜底部的隐窝上皮,即急性隐窝炎是UC 最早期、最基本的特征之一,是固有基底层毛细血管中的中性粒细胞浸润入隐窝上皮而成,随着病程的延长逐渐发展为隐窝脓肿,即隐窝中观察到中性粒细胞。NOMURA 等[15]的研究也指出隐窝中观察到中等量炎症细胞浸润高度提示CD。本研究结果显示,UC 患者黏膜急性炎症中隐窝炎、隐窝脓肿及固有层中性粒细胞数量增多的构成比明显高于CD 患者,与黏膜结构改变的趋势一致,分析原因为隐窝炎反复发作及隐窝脓肿导致腺体破坏,腺体反复进行自我修复,最终导致腺体分支、萎缩及扭曲不规则等黏膜结构改变[16-17]。此外,曹立军等[18]指出,通过观察肠壁各层次结构的变化,有助于评估UC 的活动性。本研究结果显示,UC 组黏膜上皮糜烂或变扁、黏膜细胞减少构成比高于CD组,假幽门腺化生、裂隙样溃疡仅出现在CD 组中。UC 上皮慢性炎症将引发黏蛋白丢失,显微镜下可观察到黏液细胞减少。CD 属局限性疾病,因此其活检结果重点在于观察黏膜结构是否正常,病变是弥漫性还是局灶性,是否有肉芽肿小结。KEDIA 等[19]认为,肉芽肿加上至少其他1 个特征才能诊断为CD。
综上所述,在CD 与UC 的鉴别诊断中需将内镜下表现与多点活检组织病理学诊断结果进行综合分析,并结合临床表现,提高诊断的准确性。针对疑似CD 或UC 的患者,首次行内镜下活检,应从形态学分析,并结合临床表现、病变部位等进行鉴别。病变局限于结肠黏膜、增生部位环形弥漫分布、无肠腔狭窄、黏膜结构明显改变及表面上皮糜烂或变扁等可诊断为UC。病变部位局限在回盲部或累及至整个消化道、阿弗他溃疡、肉芽肿样小结及间断性炎症细胞浸润等倾向于CD 诊断。
