AAV 介导的TNFR 关节内基因治疗对血友病性关节病预防和治疗的实验研究
2022-10-25林振洋王冶凡张飞旭2周新月宗晓莹吴侠华宝来4肖啸孙君江
林振洋,王冶凡,张飞旭2,周新月,宗晓莹,吴侠,3,华宝来4,5,肖啸,3,孙君江,3
(1.华东理工大学药学院,上海 200237;2.华东理工大学生物工程学院,上海 200237;3.国家生物器反应工程重点实验室,上海 200237;4.徐州医科大学扬州临床学院,江苏 扬州 225001;5.扬州大学临床医学院血液科,江苏 扬州 225001)
血友病(Hemophilia)是一种先天性凝血因子缺乏病,主要包括Ⅷ因子缺乏所导致的血友病A 型和Ⅸ因子缺乏所导致的血友病B 型。血友病的主要症状表现为全身不同组织和器官自发性出血和创伤性出血,而关节部位的自发性出血占出血事件的70%~80%[1]。关节内反复出血将导致血液积累,引起铁沉积、巨噬细胞增多和炎性细胞因子表达增加,最终引发滑膜炎症、软骨退化以及骨重建等病变[2],导致血友病性关节病(HemophilicArthropathy,HA)的形成。目前对于血友病性关节病的治疗,主要是预防性地使用重组凝血因子蛋白,减少出血概率,但是凝血因子替代疗法价格昂贵、应用有限,而且患者体内容易产生针对凝血因子的抑制物;而对于已患有HA 的患者,只能通过外科手术对关节进行置换,但具有发生严重出血的风险[1,3]。
在关节炎的发展过程中,白介素-1β(IL-1β)、肿瘤坏死因子α(TNFα)、白介素-6(IL-6)等炎性细胞因子起到了关键性的作用[4]。Manetti 等[5]的研究结果显示,HA 患者血液中的TNFα 水平与HA 的严重程度呈正相关,且在HA 患者的膝关节滑膜液中的TNFα 的 含 量 要 显 著 高 于 骨 关 节 炎(Osteoarthritis,OA)患者。可溶性肿瘤坏死因子受体(SolubleTumor NecrosisFactorReceptor,sTNFR)是一种天然存在的可以结合TNFα 的受体蛋白[6]。sTNFR 重组蛋白以及表达sTNFR 的基因治疗药物一直被应用于各种关节炎的治疗[7-13],如sTNFR 的商品化药物依那西普(Etanercept)已经上市并用于治疗类风湿性关节炎[14]。在我们完成的一项临床转化研究中发现,血友病性关节炎小鼠模型中,关节出血引起关节内TNFα 水平升高,而使用抗TNFα 的治疗方法可减轻血友病性关节病症状;在临床研究中,HA 患者的关节内TNFα的水平较外周循环中显著增高,向HA 患者的关节内单次注射sTNFR 重组蛋白后,关节内TNFα 水平随之下降,滑膜炎症得到减缓[15]。然而在该研究中仅单次给药sTNFR 重组蛋白,无法实现长期治疗。因此,希望通过向关节内局部注射重组腺相关病毒(RecombinantAdeno-AssociatedVirus,rAAV),以基因治疗(GeneTherapy)的方式实现单次注射后关节内长期、局部表达sTNFR,从而达到治疗HA 的效果。
本文将表达TNFR 的质粒(pAAV-TNFR:Fc)包装为rAAV5-TNFR:Fc 载体,注射到B 型血友病小鼠关节内,在关节内出血42d 后,提取小鼠关节组织的RNA,利用定量聚合酶链式反应(qPCR) 方法检测TNFα、IL-1β、IL-6 和IL-10 的mRNA 表达水平,同时取关节组织用于病理切片,对病理切片进行不同指标的组织化学染色,并根据相应方法对各病理变化进行定量研究。结果表明TNFR 可以在关节内持续表达,滑膜炎症以及炎性细胞浸润和血管新生的病变的程度显著减轻,探究了关节内的局部基因治疗对血友病性关节病的预防和治疗作用的理论可行性,并奠定了初步的实验基础。
1 实验部分
1.1 原料和试剂
本文所用pAAV-CB 骨架质粒(含CB 启动子的AAV 载体)由本实验室保存,pUC57-TNFR:Fc 质粒(表达TNFR-Fc 目的蛋白的pUC57 载体)由深圳华大基因合成。Trans5α 化学感受态细胞购自北京全式金生物技术有限公司;质粒小量回收试剂盒和胶回收试剂盒购自Omega 公司;质粒大量抽提试剂盒购自Macherey-Nagel 公司;限制性内切酶以及T4 连接酶购自ThermoFisher 公司;用于配制LB 培养基的酵母提取物和胰蛋白胨均购自Oxoid 公司。
人滑膜成纤维细胞(Human Fibroblast-Like Synoviocyte,HFLS)购自北纳创联生物科技有限公司,细胞编号BNCC338586;柠檬酸铁(分析纯)购自上海麦克林生化科技有限公司;DMEM(Dulbecco's Modified Eagle Medium)高 糖 培 养 基、胎 牛 血 清(FBS)和 胰 蛋 白 酶-EDTA(Ethylene Diamine TetraaceticAcid)(φ =0.25%)购自ThermoFisher 公司;抗TNFR1 抗体(ab90121)购自Abcam 公司;抗TNFα抗体(BAF410)购 自R&D Sysyem 公 司;抗GAPDH(Glyceraldehyde-3-PhosphateDehydrogenase,甘油醛-3-磷 酸 脱 氢 酶) 抗 体(ARG10112 ) 购 自Arigo Biolaboratories 公司;抗F4/80抗体(28463-1-AP)和抗血管性血友病因子(vonWillebrandFactor,vWF)抗体(11778-1-AP)购自Proteintech 公司。
B 型血友病小鼠(凝血因子Ⅸ表达基因敲除)购自百奥赛图江苏基因生物技术有限公司;多聚甲醛固定液购自武汉赛维尔生物科技有限公司;乙二胺四乙酸(EDTA)脱钙液购自北京雷根生物技术有限公 司;RIPA(Radio Immunoprecipitation Assay)裂 解液、SDS-PAGE(SodiumDodecylSulfate-Polyacrylamide GelElectrophoresis)凝胶快速配制试剂盒、Western 封闭液、苏木素伊红(H&E)染色试剂盒、柠檬酸钠-EDTA 抗原修复液、内源性过氧化物酶强力封闭液和DAB(Diaminobenzidine)辣根过氧化物酶显色试剂盒购自上海碧云天生物技术有限公司;普鲁士蓝染色试剂盒购自北京索莱宝科技有限公司;1-溴-3-氯丙烷(分析纯)、二甲苯(分析纯)、 φ=75%乙醇(分析纯)、异丙醇(分析纯)和无水乙醇(分析纯)购自上海优试化工有限公司;HistoMount 封片剂和TRIzol 购自ThermoFisher;反转录PrimeScriptMix 购自Takara公司;qPCRSYBRMix 购自南京诺唯赞生物。
1.2 测试与表征
生化培养箱(SHP-250)购自上海精宏实验设备有限公司;二氧化碳培养箱(BB150)购自美国ThermoFisher 公司;台式冷冻离心机(5424R)购自德国Eppendorf 公司;PCR 仪(T100)购自美国Bio-Rad 公司;高通量水平电泳槽(HE-220)、数显式稳压稳流电泳仪(EPS600)、转移电泳槽(VE-586)、全自动凝胶成像系统(2500)和全自动化学发光图像分析系统(5200)购自上海天能科技有限公司;实时荧光定量PCR 仪(qTOWER3G)购自德国AnalytikJena 公司,微量进样器(10μL)购自美国Hamilton 公司,病理切片机(RM2016)购自德国Leica 公司。
1.3 实验步骤
1.3.1 质 粒 构 建 在NCBI ( National Center for BiotechnologyInformation)网站得到的人TNFR1 胞外区序列,经密码子优化后,附上小鼠IgG1-Fc 片段,再在该段基因前加入Kozak 序列,得到最终的目的基因TNFR:Fc 序列。将该目的基因序列提交深圳华大基因科技有限公司合成pUC57-TNFR:Fc 质粒。以pUC57-TNFR:Fc 为 模 板,PCR 扩 增TNFR:Fc基因。利用限制酶BshTⅠ和SacⅠ分别对PCR 产物和pAAV-CB 进行双酶切,经核酸凝胶电泳纯化后,将骨架片段和目的基因片段进行胶回收后,用T4 连接酶对两个片段进行连接,并转化感受态细胞Trans5α,提取质粒使用SmaⅠ酶切鉴定,通过鉴定用于病毒生产,即pAAV-CB-TNFR:Fc。
1.3.2 重组腺病毒的生产、扩增和纯化 本文所用的rAAV5-TNFR:Fc 的包装、扩增和纯化由上海泰儿图生物科技公司完成。
1.3.3 细胞培养 本文所用细胞为HFLS,便于研究体外rAAV5 对滑膜细胞的感染效果。将HFLS 铺于6 孔板中,添加含 φ=10%FBS 的DMEM 培养基进行培养。当汇合度达到孔面积的70%~80%,按每个细胞1×106vg 的感染复数(MultiplicityofInfection,MOI)添加rAAV5-TNFR:Fc,培养72h 收取上清后,向细胞中加入RIPA 裂解液,转移至1.5mLEP(Eppendorf)管中,于4℃,12000r/min 下离心10min,收取细胞裂解液的上清。细胞培养上清和细胞裂解液上清经定量和变性后用于蛋白免疫印迹。
1.3.4 蛋 白 免 疫 印 迹(WesternBlot) 分 别 配 制φ =10%和 φ=15%聚丙烯酰胺凝胶用于TNFR:Fc 和TNFα 蛋白的电泳。上样于凝胶后,分别于80V 和120V电泳1h,取经电泳的凝胶进行转膜2h,封闭液封闭2h,一抗孵育12h,二抗孵育2h,于化学发光图像分析系统对结果进行观察。抗体的使用浓度(抗体原液与抗体稀释液的体积比)分别为:抗TNFR1 抗体,1/2000;抗TNFα 抗体,1/100;抗GAPDH 抗体,1/4000。用ImageJ 软件对免疫印迹所得结果图中的条带进行灰度值分析。
1.3.5 实验动物 本文所用实验动物为6~8 周龄的B 型血友病小鼠。对小鼠右膝关节进行穿刺处理,引起关节出血,积累的血液将引起血友病性关节病(HA)。主要动物实验的小鼠分组包括预防治疗组和延后治疗组,如图1 所示。

图1 主要动物实验的小鼠分组Fig.1 Groupsofmiceformajoranimalexperiments
取一批小鼠作为预防治疗组(n=3),对其右膝关节注射10μLrAAV5-TNFR:Fc,剂量为每个关节1×1011vg,给药14d 后再对小鼠的右膝关节进行穿刺处理诱导出血。同时取另一批小鼠设为相应的PBS(PhosphateBufferedSaline)组(n=3),对其右膝关节注射10μLPBS,注射和穿刺处理时间点与给药组均相同。穿刺处理42d 后(给药56d 后)处死小鼠,取右膝关节用于后续实验。另外,取一批小鼠作为延后治疗组(n=3),对其右膝关节进行穿刺处理诱导出血,出血14d 后再向右膝关节内注射10μLrAAV5-TNFR:Fc,剂量为每个关节1×1011vg。同时取另一批小鼠设为相应的PBS 组(n=3),对其右膝关节注射10 μLPBS,穿刺处理和注射时间点与给药组均相同。穿刺处理42d 后(给药28d 后)处死小鼠,取右膝关节用于后续实验。
两个治疗组的小鼠从关节穿刺到小鼠被处死的时间间隔均为42d。此外,设NC(NegativeControl)组小鼠除不接受给药和穿刺处理之外,其余添加均相同。
1.3.6 提取RNA 取小鼠的右膝关节,经研磨和匀浆处理后,用TRIzol 试剂提取关节中的RNA。
1.3.7 定量聚合酶链式反应(qPCR) 将提取所得的各样本的RNA 进行定量后,用PrimeScriptMix 反转录为cDNA,将cDNA、双蒸水和SYBRMix 混合成扩增体系,用于qPCR 测定TNFR 或细胞因子的mRNA表达变化,检测各指标时均设3 个副孔。
1.3.8 免疫组化染色 取小鼠的右膝关节,经固定、脱钙、包埋等系列处理后用于病理切片。使用切片进行后续的H&E 染色、抗F4/80 染色以及抗vWF 染色。本文中所展示的染色结果均为各组内的代表性结果,针对H&E 染色结果的滑膜炎评分参照文献[16]中所述标准进行,对F4/80 染色结果的巨噬细胞浸润评分和对vWF 染色结果的新生血管计数参照文献[17]中所述方法进行,对每组(n=3)切片的评分均为3 名人员独立评分后得出的均值。
2 结果与讨论
2.1 出血后小鼠关节中TNFα mRNA 水平变化
对B 型血友病小鼠右膝关节进行穿刺处理,28d 后取其膝关节提取RNA,用qPCR 测定TNFα的mRNA 水平变化,见图2。结果显示,经穿刺处理后,出血关节中TNFα 在mRNA 水平为其对照组的1.36倍(p<0.05)。同时,取小鼠膝关节用于WesternBlot检测TNFα 蛋白水平变化,图2(b)示出了其中代表性结果。使用ImageJ 软件对TNFα 的条带进行灰度值分析,出血关节内TNFα 的含量为NC 组中的2.53 倍(p<0.05),说明穿刺处理28d 后,出血关节中的TNFα表达上升。

图2 B型血友病小鼠右膝关节进行穿刺处理28d 后右膝关节TNFα 表达水平的变化Fig.2 ExpressionlevelchangeofTNFαinrightkneejointsofHemophiliaBmice28dafterthepuncture
类似地,Haxaire 等[18]对A 型血友病小鼠膝关节进行穿刺处理,28d 后经穿刺的膝关节中TNFα 的mRNA 水平相对于其对照关节也呈升高趋势(3.6 倍,p<0.05)。而且在本课题组近年的两项研究中,在小鼠关节内发生出血后[15,19],短期内以及长期内关节中TNFα 的含量均显著上升。Ovlisen 等[20]的研究结果显示,对A 型血友病小鼠膝关节穿刺处理后的第3d,经穿刺的膝关节内TNFα 的含量与对照无明显差异,而IL-1β 和IL-6 的含量均显著上升(p<0.0001)。
2.2 质粒构建和载体体外表达验证
根据小鼠关节内出血后其中TNFα 表达上升的结果,本文构建了表达sTNFR 蛋白的AAV 表达载体。在得到AAV 表达载体之前,首先需要用分子克隆的方法获得表达sTNFR 蛋白的质粒,在本文中即将目的基因序列插入两段ITR(Inverted Terminal Repeat)序列的CB 启动子表达盒中,ITR 序列为质粒DNA 在体内由单链转变为双链所必需的元件。而本文所用目的基因片段是人TNFR1 的胞外区序列加小鼠IgG1 的Fc 序列,相对于TNFR2,TNFR1 对TNFα 的亲和力更强[21],而IgG 的添加使得表达的TNFR 能以二聚体形式更加稳定地存在,从而延长了在体内的半衰期[11]。已经上市的Etanercept 就是人TNFR 与人IgG 的融合蛋白的二聚体[14]。
从质粒的SacⅠ单酶切和SacⅠ、BshTⅠ双酶切结果可以看出,其总大小在5000~7500bp 之间(应为6300bp),目的基因大小在1000~2000bp 之间(应为1300bp),说明目的基因已经插入了预期的位点。为鉴定质粒ITR 片段留存情况,使用SmaⅠ酶对质粒进行单酶切后,可以得到3 个片段,且在原质粒大小处(6300bp)无条带(图3(a))。可见目的基因已被克隆到载体骨架上的预期位点,且ITR 片段没有丢失。包装质粒时采用了AAV5 的血清型,其优势在于AAV5 在啮齿类动物的炎症关节中的目的基因转导效率比AAV2 更高[22],且AAV5 在多种常见的天然血清型中拥有极低的中和抗体阳性率[23],因此使用AAV5 更利于疗法扩展至临床应用。
为验证病毒载体对表达目的蛋白的能力,用包装所得的rAAV-TNFR:Fc 感染HFLS,MOI 为每个细胞1×106vg,收取细胞的培养上清和细胞裂解液上清,用于WesternBlot 实验。被感染细胞的细胞裂解液上清样本在膜上有明显条带,其上清样本中也能观察到微弱条带(图3(b)),但在未感染的细胞的样本中未见表达,说明该病毒能够感染HFLS 并使其稳定表达TNFR:Fc,表达的TNFR:Fc 部分分泌到上清中。
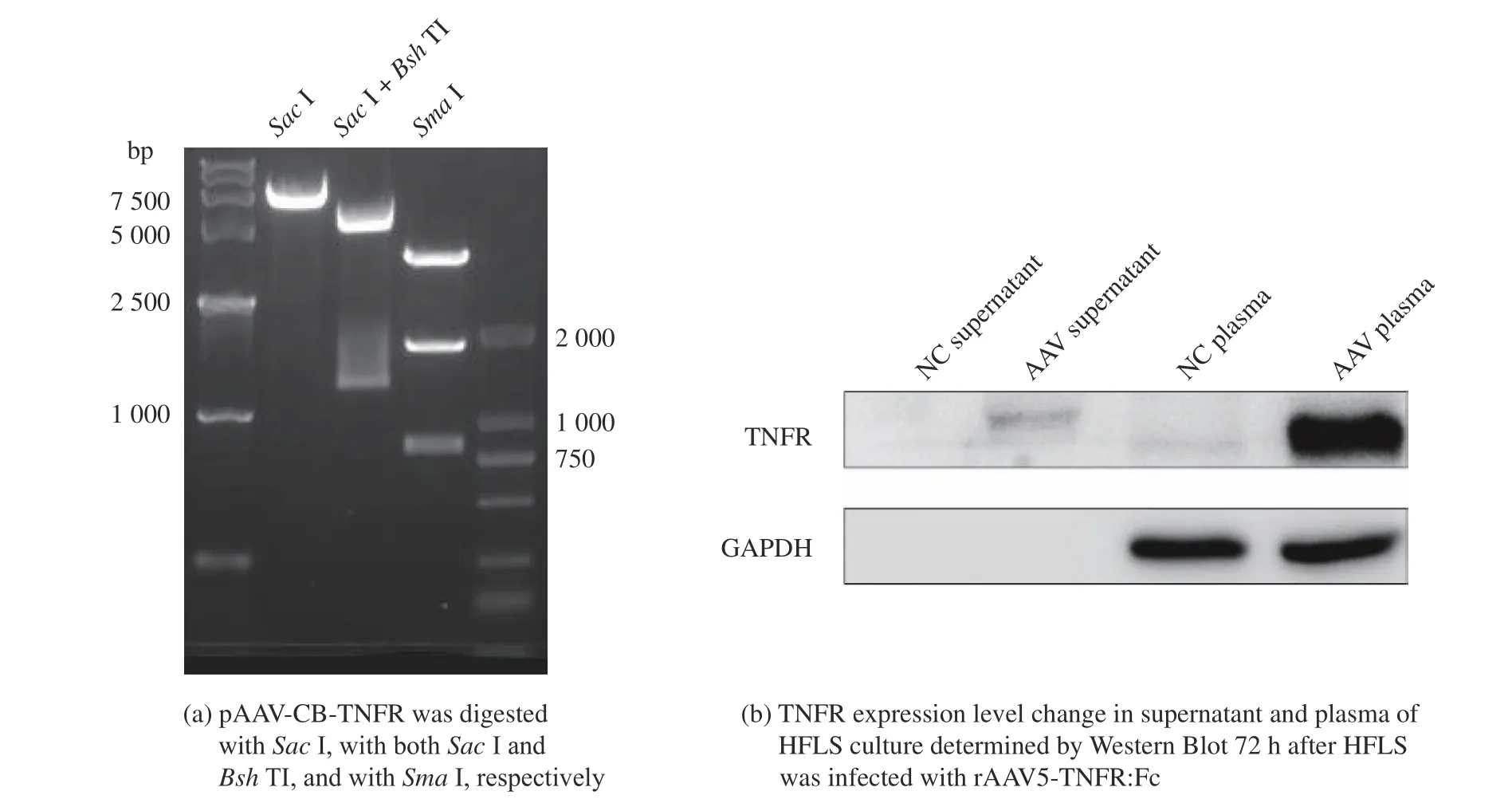
图3 质粒酶切后电泳结果及rAAV5-TNFR:Fc 感染HFLS 后TNFR 表达的WesternBlot 结果Fig.3 ElectrophoresisofdigestedplasmidandWesternBlotofTNFRinHFLSinfectedwithrAAV5-TNFR:Fc
2.3 载体的小鼠体内表达能力验证
在完成载体的体外表达能力验证之后,为进一步验证载体的体内表达能力,向小鼠的右膝关节内注射1×1011vg 的rAAV5-TNFR:Fc,给药28d 后取其膝关节提取RNA 用于qPCR 检测TNFR 的表达,其给药组的TNFRmRNA 水平相比于对照组上升至551.23 倍(p<0.01,图4(a))。同时取小鼠膝关节提取蛋白进行Westernblot 检测TNFR 的表达。相比于对照组,能观察到给药组样本在膜上有TNFR 的明显条带(图4(b))。上述结果说明rAAV5-TNFR:Fc 在小鼠关节内能够持续地表达TNFR:Fc。

图4 向B 型血友病小鼠右膝关节内注射rAAV5-TNFR:Fc28d 后右膝关节组织内的TNFR 的表达水平变化Fig.4 ExpressionlevelchangeofTNFRinrightkneejointsafterHemophiliaBmicewereintra-articularlyinjectedwithrAAV5-TNFR:Fc intorightkneejointsafter28d
类似地,Zhang 等[12]在小鼠关节内注射1.6×1011vg剂量的rAAV-TNFR1,关节内的sTNFR 在28d 时达到峰值,60d 时关节内仍能检测到可观水平的sTNFR。Khoury 等[10]在小鼠关节内注射1.5×109vg的rAAV5-TNFR:Fc,91d 后仍能检测到一定水平的TNFR。Zhou 等[9]向大鼠右膝关节内注射3×1010vg的rAAV2-TNFR:Fc,35d 后,在血浆、给药关节和对侧关节中仍能检测到显著的sTNFR 表达。可见关节内注射的rAAV-TNFR 介导的关节内TNFR 的局部表达具有良好的可持续性。
2.4 关节内注射AAV-TNFR:Fc 对出血后关节内细胞因子表达水平的影响
在预防治疗组中,与NC 组相比,PBS 组的各细胞因子mRNA 水平均不同程度地显著上升(图5(a))。与PBS 组相比,给药组中TNFα 与IL-1β 的mRNA水平显著下降,IL-6 与IL-10 的mRNA 水平则没有明显改变;而与NC 组相比,给药组中TNFα 和IL-1β的mRNA 水平已无显著差异,说明药物显著降低了炎症进程中细胞因子网络中TNFα 和IL-1β 的表达,二者恢复到正常水平,但对IL-6 和IL-10mRNA水平的表达没有影响。
在延后治疗组中,与NC 组相比,PBS 组的各细胞因子mRNA 水平同样均不同程度地显著上升(图5(b));与PBS 组相比,在给药组中,仅IL-1β 的mRNA 水平显著下降,TNFα、IL-6 和IL-10 的mRNA水平无明显差异;然而给药组和NC 组间TNFα 的mRNA 水平已无显著差异,给药组中TNFα 的mRNA表达与NC 组的水平相近。
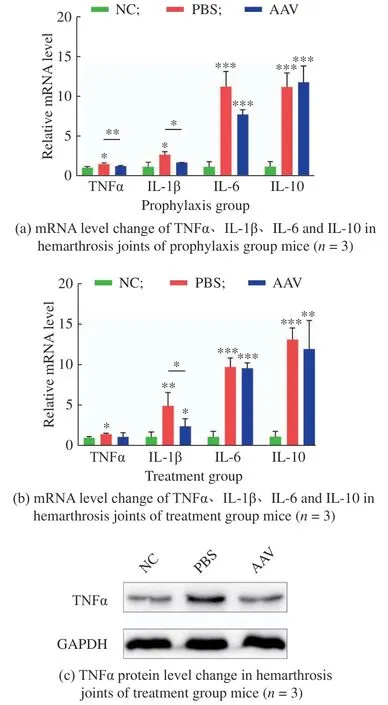
图5 关节内注射rAAV5-TNFR:Fc 对B 型血友病小鼠关节内出血后细胞因子的表达水平的影响Fig.5 Effect of intraarticular injection of rAAV5-TNFR:Fc on cytokine expression levels in hemarthrosis joints of HemophiliaBmice
上述两治疗组关节匀浆的qPCR 结果显示,TNFα 的mRNA 表达水平与NC 已无显著差异,IL-1β 的mRNA 表达水平显著下降,而IL-6 和IL-10 的mRNA 表达水平无明显改变。
取延后治疗组小鼠的右膝关节匀浆用于Western Blot 检测TNFα 表达的变化,图5(c)为实验的代表性结果。使用ImageJ 对WesternBlot 结果中TNFα 条带进行灰度分析,PBS 组和给药组中TNFα的含量分别为NC 组的1.83 倍(p<0.05)和1.14 倍,说明关节内注射rAAV-TNFR:Fc 降低了出血42d 后关节中的TNFα含量。
尽管HA 是由多个因素共同导致的病变,具体的病理机制有待阐明,但关节炎症进程中细胞因子网络中的主要细胞因子的介导机制近年来已有不少系统性的报道,核因子-κB(NF-κB)相关通路在其中发挥了重要作用[24-25]。关节中血液的代谢产物含铁血黄素在滑膜细胞和巨噬细胞中过度积累,引发了对细胞中NF-κB 表达的刺激,由此促进了TNFα、IL-1β、IL-6 和IFNγ 的表达,本文也检测到了TNFα、IL-1β、IL-6 表达水平的上升。这些炎性细胞因子表达的上升又正反馈于NF-κB 通路的活性[24-25],而且也可促进胞外信号调节激酶(ERK,Extracellularsignalregulatedkinase)、p38、信号转导和转录激活因子3(Signal Transducer and Activator of Transcription 3,STAT3)相关通路的活性,促进具有抗炎和软骨保护活性的IL-10 的表达[4],因此在qPCR 的结果中,各种细胞因子的水平均显著上升。
Haxaire 等[18]对血友病A 型小鼠的膝关节进行单次穿刺处理后,对经穿刺关节的软组织中的TNFα的mRNA 水平进行测定,在穿刺之后第3、7、14、30d,TNFα 的mRNA 水平分别为对照组的约13、5、6、4 倍,说明在单次出血造成的HA 中,TNFα 的mRNA表达量本身呈随时间推移而下降的趋势,在本文中该值(第42d)为1.47 倍(p<0.05),而给药组中该值为1.20 倍。Zhou 等[9]向由胶原诱导形成全身炎症的两组大鼠的膝关节内分别注射rAAV 衣壳和rAAV2-TNFR:Fc,同样显示出rAAV-TNFR:Fc 对TNFα的拮抗效果。35d 后其rAAV 衣壳组和rAAV2-TNFR:Fc组大鼠膝关节内TNFα 含量分别为NC 组的约5.40倍(p<0.01)和1.4 倍(p<0.01),均高于本文42d 后对应的两组的TNFα 含量(1.83 倍和1.14 倍),推测前者的差异(5.40 倍相比1.83 倍)是由于胶原诱导形成的全身炎症严重程度大于局部的血友病性关节炎。文献[24]测得在小鼠关节出血后的第60d,IL-1β和IL-6 蛋白水平相比于出血后3h 有所降低但仍处于较高水平,而TNFα 已降至近于对照组水平,IL-10水平则明显高于出血后3h,且显著高于对照组。
2.5 关节内注射AAV-TNFR:Fc 对出血后关节内病变的治疗效果
根据Valentino 等[24]对HA 小鼠滑膜炎模型积分定量分析的方法,对关节组织病理切片的H&E 染色结果(图6(a))的滑膜炎症病变进行观察和评分。从滑膜炎评分结果(图6(b)~6(c))看,预防治疗组中,AAV 组的评分为2.67,其PBS 组的评分为5.00;延后给药组中,AAV 组的评分为3.78,其PBS 组的评分为5.33,NC 组的评分为0.22(图中未展示)。可见两给药组小鼠相对于对应的PBS 组滑膜炎评分均下降,但两给药组与NC 组间仍存在显著差异,说明均未恢复到正常水平。上述结果显示,rAAV5-TNFR:Fc的关节内局部给药在一定程度上能够起到抑制HA 中滑膜炎进展的作用,尽管预防治疗组的评分低于延后给药组,且两治疗组间存在着载体表达时间的差异,但两种治疗方式均能起到显著降低滑膜炎症的效果。

图6 关节内注射rAAV5-TNFR:Fc 治疗B 型血友病小鼠HA,关节组织的H&E 染色结果以及滑膜炎评分Fig.6 H&EstainingofjointtissueandsynovitisscoringafterHemophiliaBmicewereintraarticularinjectedwithrAAV5-TNFR:FctotreatHA
F4/80 是巨噬细胞表面的一种抗原,在本课题组之前的研究中曾针对该抗原对小鼠关节切片进行免疫组化染色,以评估关节内炎症细胞的浸润程度[15]。根据Hoffman 等[17]针对巨噬细胞F4/80 蛋白的染色以及进行巨噬细胞评分的方法,本文将巨噬细胞F4/80 作为抗原对关节病理切片进行免疫组化染色(见图7(a)),并对巨噬细胞浸润程度进行观察和评分图7(b)~7(c)。从巨噬细胞评分的结果(图7(b)~7(c))看,预防给药组中,AAV 组的评分为1.89,其PBS 组的评分为2.78;延后给药组中,AAV 组的评分为2.22,其PBS 组的评分为3.00,NC 组的评分为0(图中未展示),可见两给药组的评分相对于对应的PBS组均下降,但两给药组与NC 组间仍相差较大,说明均未恢复到正常水平。该评分结果显示,在慢性HA 中,rAAV5-TNFR:Fc 的关节内局部给药在一定程度上降低了HA 关节内滑膜中的巨噬细胞的浸润程度,预防治疗和延后治疗两种治疗方式均能减少巨噬细胞浸润程度以保护关节。

图7 关节内注射rAAV5-TNFR:Fc 治疗B 型血友病小鼠HA,关节组织的针对F4/80 抗原的组化染色结果以及巨噬细胞浸润评分Fig.7 Anti-F4/80antigenIHCofjointtissueandmacrophageinfiltrationscoringafterHemophiliaBmicewereintraarticularinjectedwith rAAV5-TNFR:FctotreatHA
vWF 是能够介导血小板黏附于血管损伤部位的一种糖蛋白,还具有稳定血液中的凝血因子Ⅷ(FⅧ)的作用,主要由血管内皮细胞产生[27]。根据Hoffman等[17]针对vWF 蛋白的染色以及进行血管计数的方法,本文将其作为抗原对关节病理切片进行免疫组化染色(见图8(a)),并对高倍镜(40×)下的新生血管进行观察和计数,以评估病变关节内的血管增生程度。从新生血管计数结果(图8(b)~8(c))看,每高倍镜视野下,预防给药组中,AAV 组的新生血管数为5.67,其对应的PBS 组的新生血管数为11.11;延后给药组中,AAV 组的新生血管数为8.78,其对应的PBS 组的新生血管数为13.78,NC 组为2.33(图中未展示),可见两给药组的每高倍镜视野下新生血管数量相对于对应的PBS 组均下降,但两给药组与NC 组间仍存在较大差距,说明仍未恢复到正常水平。上述结果显示,rAAV5-TNFR:Fc 的关节内局部给药在一定程度上能够抑制HA 关节内滑膜中的新生血管的增生程度,预防治疗和延后治疗两种治疗方式均能减少血管的增生程度。

图8 关节内注射rAAV5-TNFR:Fc 治疗B 型血友病小鼠HA,关节组织的针对vWF 抗原的组化染色结果以及巨噬细胞浸润评分Fig.8 Anti-vWFantigenIHCofjointtissueandmacrophageinfiltrationscoringafterHemophiliaBmicewereintraarticularinjectedwith rAAV5-TNFR:FctotreatHA
从对关节组织的滑膜炎评分、巨噬细胞浸润评分以及新生血管计数结果可见,通过预防治疗和延后治疗两种治疗方式,rAAV5-TNFR:Fc 的关节内局部给药在一定程度均能降低关节内的滑膜炎症程度,并减少巨噬细胞浸润以及血管增生的病理变化。预防治疗组和延后治疗组的给药和关节穿刺的先后顺序不同,为了保证从穿刺处理关节到小鼠被处死的时间间隔相同,从而造成了两治疗组目的蛋白的表达时间存在差异,这可能导致延后治疗组在滑膜炎评分、巨噬细胞浸润评分以及每高倍镜视野新生血管数量均高于预防治疗组,尽管如此,延后治疗仍显示出降低这些病变程度的效果。另外,推测导致延后治疗组各评分高于预防治疗组的另一个重要原因是,在发生出血之后14d 才给药,关节积累的血液以及其引起的炎症对关节内的组织已经造成了不可逆的破坏作用,延后的给药无法改善关节内组织已经受到的损伤,而预防给药可以最大程度地减少这种破坏,因此,与使用凝血因子药物预防性地治疗HA 类似,应用抗炎药物治疗HA 时,也应遵循预防优先的原则。
此外,本文旨在探究rAAV5-TNFR:Fc 对血友病性关节病的预防和治疗作用的理论可行性并奠定初步的实验基础,而在临床研究以及临床转化研究中,为阻止人类患者关节内出血情况的恶化,取得更好的抗炎疗效,需要将凝血因子与基因疗法联合起来,这比单独应用基因疗法具有更好的可行性和临床意义。其次,参考zhou 等[7]的临床研究,本文采用的AAV-TNFR:Fc 的剂量也介于其研究结果的安全范围内,在该范围内,HA 对全身循环中细胞因子的影响水平较小[5,19],尽管如此,TNFR:Fc 水平以及全身循环中各细胞因子的水平有待进一步的检测,以探究药物的系统性影响。
3 结束语
在关节内发生出血后,向关节内注射的基因治疗药物rAAV5-TNFR:Fc 能使关节组织持续地局部表达TNFR:Fc,减少关节内炎性细胞因子TNFα 的含量,从而起到抑制关节炎症进展的作用,预防治疗和延后治疗两种方式均能改善关节炎症,减少炎性的巨噬细胞浸润和血管增生的病理变化。然而本文仅探究了单独表达TNFR:Fc 对关节内出血后炎症的抑制作用,并没有配合外源性凝血因子药物的使用,因此对关节仅能起到部分的保护作用,未能完全使病变关节恢复到正常关节水平。向关节内注射rAAV5-TNFR:Fc 用于血友病性关节病的研究值得进一步深入,推测这一疗法同样适用于类风湿性关节炎及骨性关节炎的治疗。
