手性农药选择性生物活性与毒性效应研究进展
2022-10-25郭浩铭魏一木刘雪科刘东晖周志强
郭浩铭, 魏一木, 刘雪科, 刘东晖, 王 鹏, 周志强
(中国农业大学 理学院 农药创新研究中心,北京 100193)
手性化合物对映体呈镜像关系,除旋光特性外几乎具有完全相同的物理化学性质,但与生物体作用时通常差异显著,因而展现出立体选择性的生物学特性。近年来手性农药的选择性得到了广泛关注,如选择性生物活性、毒性毒理、环境行为、不对称合成等。目前我国登记使用的手性农药约270 种,占比近40%,并且这一比例一直呈上升的趋势[1-3]。手性农药对映体通常会具有不同的生物活性,存在高效体、低效体或无效体,所以随着合成工艺的改进,一些手性农药品种以高活性的光学纯单体形式进行生产、登记、销售和使用,如精异丙甲草胺、精甲霜灵、精喹禾灵、精草铵膦和氰氟草酯等[4-9]。除生物活性外,大量的研究表明,手性农药对映体在环境归趋、毒性毒理方面也广泛存在选择性,如内分泌干扰毒性、生殖毒性和神经毒性等[10-12]。
前人关于手性农药的综述多集中于手性农药的环境行为、毒性和合成等,而阐述手性农药生物活性和毒性立体选择性差异未见系统报道。本综述调研了近年手性农药的相关研究,拟对目前国内外手性农药的选择性生物活性和毒性效应的研究进展展开综述,并且对其进行归类整理,旨在为手性农药选择性环境行为的进一步研究以及手性农药高效、环境友好型光学纯单体农药的开发和应用提供理论依据。
1 手性农药生物活性立体选择性
生物活性是评估农药药效的重要指标之一,研究表明,手性农药对映体之间生物活性的差异主要分为4 种类型:1) 仅有一个对映体具有活性,其余为无效体或低效体;2) 对映体之间活性差异10 倍以内;3) 对映体之间活性没有明显差异[13-14];4) 对映体活性类型不同,以下分别总结手性杀虫剂、杀菌剂和除草剂对靶标生物的对映体活性差异。
1.1 手性杀虫剂生物活性立体选择性
目前我国市售手性杀虫剂约110 余种[11],表1列举了一些杀虫剂对映体的生物活性信息。拟除虫菊酯类和有机磷类很多品种具有手性,因此有关对映体立体选择性的研究相对较多。如有机磷农药水胺硫磷,S体对褐飞虱Nilaparvata lugens和二化螟Chilo suppressalis的LC50值分别为341 和8.63 mg/L,而R体对这两种害虫的LC50值分别为1 000 和500 mg/L,说明S-水胺硫磷对上述害虫的杀虫活性分别是R体的2.9和57.9 倍[15];同样,Di 等也发现水胺硫磷S对映体对朱砂叶螨Tetranychus cinnabarinus、东方黏虫Mythimna separata、豌豆蚜Aphis craccivora和小菜蛾Plutella xylostella的杀虫活性约是R-水胺硫磷的13.2~55.6 倍[16];S-水胺硫磷对蝗虫Locust的活性是R-水胺硫磷的130 倍[17]。水胺硫磷对于鳞翅目和同翅目害虫有较好防效,其S体对上述靶标害虫均表现为高效体,具有较大潜力开发为高活性单体农药。拟除虫菊酯类农药中已成功开发高效异构体产品的数量相对较多,如氰戊菊酯,(S,S)-氰戊菊酯对德国小蠊Blattella germanica的杀虫活性是(R,S)-氰戊菊酯的50 倍[18],目前以(S,S)-氰戊菊酯光学纯单体进行销售。此外,甲氰菊酯、溴氰菊酯、乙氰菊酯、联苯菊酯、氟丙菊酯、四溴氟菊酯等均以单体形式作为有效成分进行商品化销售和使用[19]。苯基吡唑类手性杀虫剂有丁虫腈、乙虫腈、氟虫腈等,其选择性生物活性也得到了很好的研究,丁虫腈含一对对映体,其中R-丁虫腈对小菜蛾、东方黏虫、豌豆蚜和褐飞虱的LC50值分别为0.36、1.37、0.95 和0.46 mg/L,其杀虫活性是S-丁虫腈的1.9~5.1 倍[20];乙虫腈具有一个手性中心,R-乙虫腈对豌豆蚜虫Macrosiphum pisi和褐飞虱的活性分别是S-乙虫腈的4.26 倍和2.43 倍[20]。苯基吡唑类手性杀虫剂多为R体为高效体,且对映体之间活性差异约在10 倍以内。其他种类的手性农药杀虫剂如fluralaner、fluxametamide、乙螨唑、茚虫威等对映体之间生物活性差异在10 倍以上,其中S-茚虫威作为高效体,其生物活性是R-茚虫威的1 000 倍以上[21],目前市售茚虫威原药中S-茚虫威与R-茚虫威的比例约为3 : 1。

表1 手性杀虫剂对映体生物活性差异Table 1 Enantiomer bioactivity difference of chiral insecticides

续表1Table 1 (Continued)
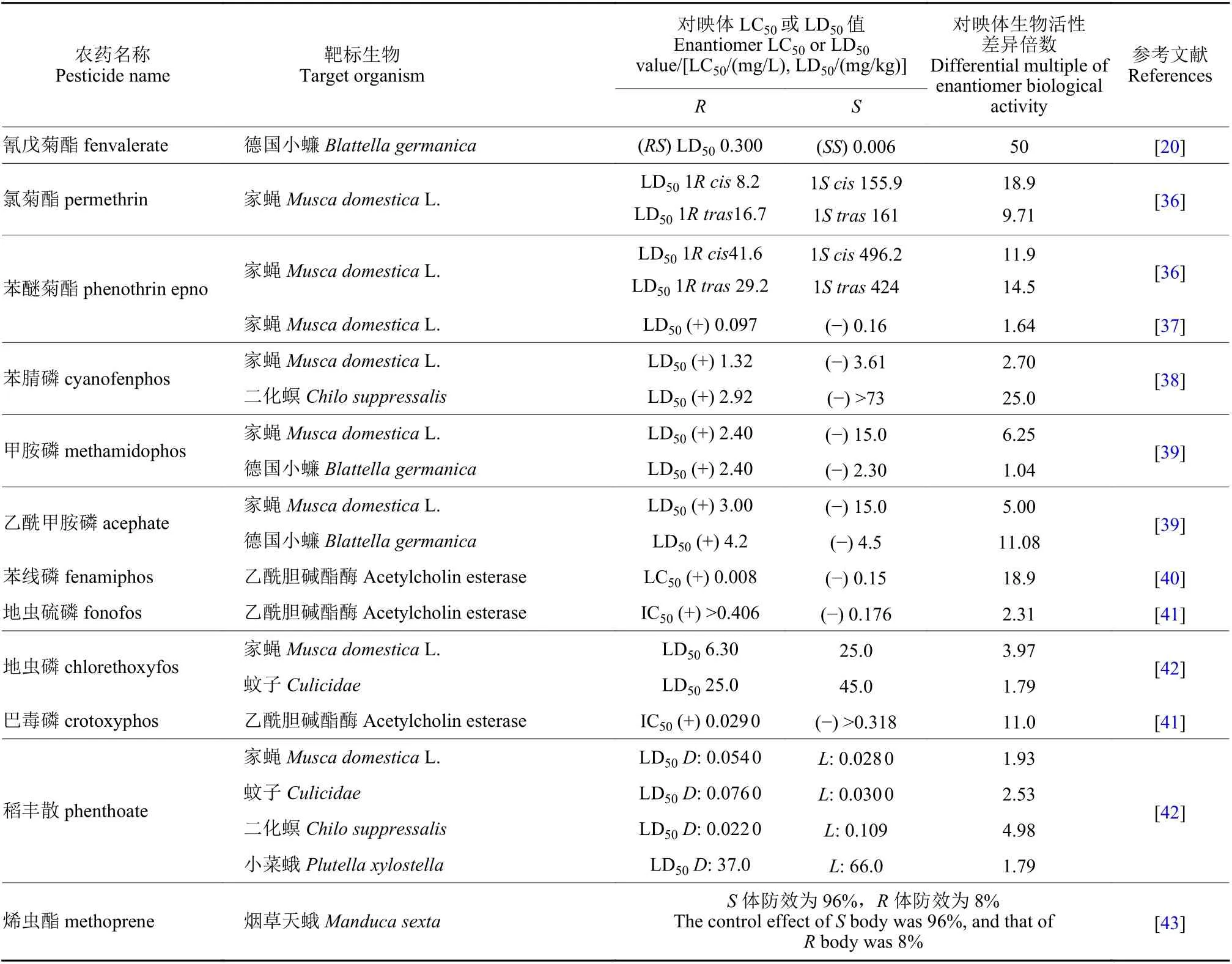
续表1Table 1 (Continued)
1.2 手性杀菌剂生物活性立体选择性
我国已登记使用的杀菌剂中手性杀菌剂约有60 种,表2 中列举了部分手性杀菌剂对映体选择性生物活性的差异情况。目前以光学纯单体登记的手性杀菌剂仅有精甲霜灵和精苯霜灵,均以R体为高效体进行销售和使用。部分杀菌剂对映体生物活性差异在100 倍以上,如丙硫菌唑、氯氟醚菌唑、灭菌唑、双炔酰菌胺和氟唑菌酰羟胺等,其中R-双炔酰菌胺的杀菌活性是S体的232~592 倍[7],此类杀菌剂对映体中只有一个对映体具有杀菌活性,另一对映体为低效体或无效体,其高活性单体具有较大潜力开发为光学纯单体农药。此外,噁唑菌酮对映体对不同靶标的生物活性差异较大,如防治立枯丝核菌时,其R体活性是S体的178 倍,而防治尖孢镰刀菌时其差异仅为不到4 倍,但R体依旧为高效体[44]。丙环唑具有两个手性中心,两对对映体,Tang 等测定了丙环唑4 个对映体分别对新月弯孢菌Curvularia lunata和果香地霉Colletotrichum musae的杀菌活性,对于新月弯孢菌,其活性顺序为(2R,4S)-丙环唑 > (2S,4R)-丙环唑 > (2S,4S)-丙环唑 > (2R,4R)-丙环唑,而对于果香地霉,其活性顺序为(2R,4S)-丙环唑 > (2R,4R)-丙环唑 > (2S,4S)-丙环唑 > (2S,4R)-丙环唑[45]。

表2 手性杀菌剂对映体生物活性差异Table 2 Differences in enantiomer bioactivity of chiral fungicides
1.3 手性除草剂生物活性立体选择性
我国目前已登记的手性除草剂中约有70 种具有手性结构,且多具有一个手性中心[62]。表3 列举了部分手性除草剂对映体间的除草活性差异,多数除草剂高效体为R体,如芳氧苯氧丙酸类除草剂:吡氟禾草灵、禾草灵、氟吡禾草灵、喹禾灵、噁唑禾草灵。氰氟草酯、炔草酯和喔草酯等,R体均为高活性单体[62,8]。由于除草剂用量较大,且手性除草剂光学纯活性单体制备技术突飞猛进,多种手性除草剂以单一活性单体投入商品化使用,如精2 甲4 氯丙酸、精2,4-滴丙酸、精禾草灵、精吡氟禾草灵、精喹禾灵、左旋氰氟草酯、炔草酯、精异丙甲草胺和氯氟草醚等[8]。

表3 手性除草剂对映体生物活性Table 3 Enantioselective bioactivities of chiral herbicides

续表2Table 2 (Continued)
笔者综合调研结果,对上述手性农药对映体活性平均差异倍数进行分类统计,结果如图1 所示:超过50%的手性农药生物活性差异在10 倍以下,对映体间活性差异不大;而对映体生物活性超过10 倍的手性农药占比约为35.72%~42.86%,此类农药对映体间活性差异较大,其中茚虫威、fluxametamide、氟唑菌酰羟胺、双炔酰菌胺、氯氟醚菌唑、吡氟禾草灵和氟丁酰草胺等对映体间生物活性差异超过100 倍,此类手性农药其中一个对映体为低效体或无效体,具有较大潜力开发手性光学纯单体农药。

图1 手性农药对映体生物活性差异倍数分布Fig. 1 Differential fold distribution of enantiomeric bioactivity of chiral pesticides
多数研究证明手性农药对映体间具有选择性生物活性的主要原因是手性农药对映体与靶标位点结合的差异。分子对接是目前揭示手性农药对映体选择性生物活性的主要手段。例如,水胺硫磷通过抑制乙酰胆碱酯酶(acetylcholinesterase,AchE)来发挥杀虫活性[83],Kong 等通过同源建模和分子对接分析了水胺硫磷对映体与蝗虫AchE 之间结合的亲和力,表明S-水胺硫磷与AchE 的结合能量高于R-水胺硫磷, 从而解释了S-水胺硫磷对蝗虫杀虫活性更高的原因[17]。Tian 等模拟果蝇离子型GABAR 亚基,使用R/S-丁虫腈进行分子对接,结果显示,R-丁虫腈能更好地阻断GABAR中氯离子的通过,进而使其具有更好的杀虫活性[18]。苯酰菌胺对映体与病原菌靶标结合位点进行同源建模和分子对接后发现,R/S-苯酰菌胺和靶标位点特定受体间范德华力(van der Waals force)的差异是导致对映体发挥不同杀菌活性的主要原因,同样也是fluxametamide 对映体对小菜蛾产生对映选择性生物活性的主要原因[7,26]。尽管手性农药对映体之间拥有极其相似的物化性质,但进入靶标生物体后,与氨基酸、蛋白质等手性生物大分子发生对映体选择性结合,进而产生选择性生物活性。朱欣凯通过体外测定水胺硫磷对映体对东亚飞蝗Locusta migratoriaAchE 的活性发现,S-水胺硫磷对AchE 的抑制活性是R-水胺硫磷的10 倍,与吡唑硫磷对AchE 的抑制结果相似[84],并且S-水胺硫磷可抑制羧酸脂酶(carboxylic acid lipase,CarE)的活性,而CarE 作为一种解毒酶,可缓解杀虫剂分子对其的毒性[85]。因此,生物体内解毒酶对手性农药对映体的特异性识别可能也是造成对映体选择性生物活性的原因之一。解析手性农药对映体对靶标生物产生选择性生物活性的机制可为提高手性农药对靶标生物的防效提供新的见解与思路,也可为新型高效光学纯单体农药的研发提供理论依据。
2 手性农药对非靶标生物的毒性效应立体选择性
近年来大力倡导化学农药“减施增效”,农药的环境毒理问题受到越来越多研究人员的关注。手性农药进入非靶标生物体后,其对映体会与氨基酸、蛋白质等生物大分子发生特异性结合,进而对非靶标生物造成对映体毒性差异[86]。目前越来越多的研究证明,手性农药对映体对于非靶标生物产生的毒性效应是多方面的,主要包括急性毒性、氧化应激和内分泌干扰等。
2.1 手性农药的急性毒性效应
目前,手性农药对非靶标生物的急性毒性效应的研究主要集中在一些环境模式生物,水生生物如斑马鱼D. rerio、小球藻C. vulgaris、浮萍Lemna minorL.和大型溞Daphnia magnaS.等,土壤生物如赤子爱胜蚓Eisenia foetida等,以及昆虫 (如蜜蜂Apis melliferaL.) 等。表4 列举了部分手性农药对于非靶标生物的选择性毒性效应。部分手性农药对靶标生物具有高活性的对映体对于非靶标生物同样具有相对更高的毒性,如水胺硫磷和呋虫胺等,其S体对靶标生物表现为高活性,对非靶标生物也表现出较高的毒性。部分手性农药对映体对靶标生物高活性,而对于非靶标生物却具有相对更低的毒性,如氟唑菌酰羟胺、仲丁威、灭菌唑等,此类农药有较大的潜力开发为环境友好型光学纯单体农药;部分手性农药对映体对于非靶标生物毒性差异不大 (5 倍以内),如氟虫腈、烯效唑、敌草胺、苯霜灵、乙虫腈、戊唑醇、吡唑磷等;而诸如氟噁唑酰胺、灭菌唑、乳氟禾草灵、噁唑菌酮和七氟菊酯等手性农药对部分非靶标生物所表现出的对映体间的毒性差异则在20 倍以上,其中噁唑菌酮对映体对斑马鱼和赤子爱胜蚓的对映体间急性毒性差异倍数分别为95 和167 倍。从对映体的水平探究手性农药对映体间的环境行为和毒性毒理,了解手性农药对映体对环境生物的潜在风险对于研发环境友好型光学纯单体农药至关重要。

表4 部分手性农药对非靶标生物对映体选择性急性毒性Table 4 Enantioselective acute toxicity of some chiral pesticides on nontarget organisms

续表4Table 4 (Continued)

续表4Table 4 (Continued)
2.2 手性农药对非靶标生物氧化应激效应
当生物受胁迫时,细胞内会积聚大量活性氧(reactive oxygen species,ROS), 如O2-, 会破坏细胞分子结构并干扰生物正常的生理过程。生物体内具有多种复杂的酶和非酶抗氧化系统来抵御氧化胁迫[110]。氧化应激是指氧化与抗氧化失衡的一种状态, 是造成细胞凋亡的重要因素,因此常被用来作为评估外源污染物对环境模式生物安全性的重要指标[111]。已经有大量文献表明农药会对非靶标生物造成氧化应激效应[112],手性农药对映体对非靶标生物造成的氧化应激甚至氧化损伤也得到了广泛研究,其中手性杀虫剂和杀菌剂的毒性效应研究多选用动物作为受试生物,如Li 等测试了三氯杀虫酯对映体对大鼠PC12 细胞的毒性作用,结果显示S-三氯杀虫酯可显著诱导细胞产生ROS,并且降低了超氧化物歧化酶 (superoxide dismutase,SOD) 和过氧化氢酶 (catalase,CAT) 的活性,使ROS 难以清除,造成了严重的氧化损伤,具有细胞毒性[113]。相比于R-呋虫胺,S-呋虫胺可诱导蚯蚓产生更强的氧化应激效应,显著提高了赤子爱胜蚓体内丙二醛(malondialdehyde, MDA)的含量以及严重的DNA 损伤,抑制了蚯蚓的生长和繁殖[106],且当环境中存在其他外源污染物时,呋虫胺对映体对非靶标生物的氧化应激毒性也会受到影响。当与低剂量的镉共暴露时会加剧R-呋虫胺对斑马鱼氧化应激毒性[114]。手性杀菌剂己唑醇对赤子爱胜蚓表现出选择性毒性效应,其中S-己唑醇对赤子爱胜蚓的毒性高于R-己唑醇,并且诱导出对映体特异性氧化应激,S-己唑醇对MDA、细胞色素P450 和8-羟基-2-脱氧鸟苷含量的影响大于R-己唑醇[101]。S-氟唑菌苯胺对斑马鱼毒性是R-氟唑菌苯胺的54 倍,且诱导的氧化应激效应更为严重[115]。Ren 等研究表明,吡噻菌胺对斑马鱼具有选择性毒性效应,其中S-吡噻菌胺可引起斑马鱼肝脏产生氧化应激,并且显著干扰了基因表达,对斑马鱼表现出较高的毒性[116]。此外,除草剂与植物生长调节剂也可对实验动物造成毒性效应,如S-乙草胺对蚯蚓的急性毒性是R-乙草胺的1.9 倍,并且S-乙草胺可显著提高羟基自由基(hydroxyl radical , OH·) 含量以及SOD、CAT、细胞色素P450 的活性[117]。氧化平衡被破坏后可对生物体产生诸多不利影响,如R-多效唑对斑马鱼造成的氧化应激比S-多效唑强,并且过量的ROS 会进攻细胞膜,进而干扰斑马鱼AchE 的活性,对斑马鱼造成神经毒性[118]。暴露于R-烯效唑的斑马鱼氧化应激指标的变化是S-烯效唑的1.27~1.53 倍,表明R-烯效唑会导致更显著的不良反应[91]。
手性农药对植物造成的毒性效应研究多集中于除草剂和植物生长调节剂,如小球藻对于维持水生生态系统稳态十分重要,Liu 等研究了多效唑对映体对小球藻的毒性,结果表明多效唑可显著诱导小球藻产生氧化应激效应,R-多效唑对小球藻细胞结构的破坏作用要强于S-多效唑,严重抑制了小球藻生长激素的含量,抑制其生长[102]。手性农药对陆生植物具有同样的选择性毒性效应,如S-异丙甲草胺处理后,小麦植株内O2-含量和MDA 含量要显著高于空白处理,其产生的氧化应激效应要强于Rac-异丙甲草胺,且抑制小麦植株生长[119]。R-咪唑乙烟酸显著增加了小麦植株中ROS 含量,干扰了Fe2+的释放,并且R-咪唑乙烟酸可破坏小麦细胞结构,干扰光合作用,造成植物细胞毒性[120]。手性农药灭菌唑,R体杀菌活性是S体的100 倍,但S-灭菌唑可对小麦幼苗造成氧化损伤,抑制小麦幼苗生长,并且干扰了赤霉素和乙烯的合成[121]。
2.3 手性农药对非靶标生物的内分泌干扰效应
近年来,一些研究发现某些农药具有内分泌干扰毒性,干扰生物正常的激素分泌并导致非靶标生物生理功能紊乱。手性农药对于生物内分泌干扰具有选择性毒性效应。基于报告基因分析方法,能快速通过体外试验的方法,筛选出农药对映体中具有潜在内分泌干扰作用的单体[122-123]。顺式联苯菊酯对映体对H295R 细胞肾上腺皮质激素分泌的选择性干扰效应研究表明,S-顺式联苯菊酯和R-顺式联苯菊酯均不同程度地抑制H295R 细胞肾上腺皮质激素的分泌,且S-顺式联苯菊酯抑制效应更强[124]。Hu 等利用体外实验和计算机模拟考察苯基吡唑类杀虫剂氟虫腈、乙虫腈、丁虫腈对映体对牛血清的干扰效应,结果表明S-乙虫腈和S-丁虫腈可诱导甲状腺功能紊乱,而R-氟虫腈、R-乙虫腈和R-丁虫腈可诱导雌激素分泌异常,产生这种毒性差异的原因之一是对映体与受体结合亲和力存在差异[125]。叶菌唑对映体对斑马鱼的甲状腺干扰同样存在选择性效应,(1R,5S)-叶菌唑对斑马鱼的甲状腺破坏能力强于其它对映体,利用计算机模拟证明 (1R,5S)-叶菌唑与甲状腺激素受体之间的结合能力比其他对映体更强[126]。乙草胺对映体对斑马鱼甲状腺激素干扰实验表明S-乙草胺对甲状腺激素受体和促甲状腺激素基因表达表现出显著促进作用,相比于R-乙草胺,S-乙草胺对斑马鱼甲状腺有更强的破坏效应[127]。氯氰菊酯4 个对映体对H295R 细胞的干扰实验表明,1R-cis-αS-氯氰菊酯可抑制糖皮质激素受体、盐皮质激素受体和甲状腺受体活性,1R-trans-αS-氯氰菊酯可抑制雄激素受体和雌激素受体活性,其余2 个对映体也可造成类固醇激素相关基因的表达和激素分泌,表明氯氰菊酯对映体分别可通过不同的通路造成内分泌紊乱[122]。
随着研究的深入,越来越多的证据表明农药对非靶标生物存在多方面的干扰效应,其中对性腺的影响也是近年来的研究热点。Chang 等研究了高效氯氟氰菊酯对映体对丽斑麻蜥Eremias argus性腺的影响,结果表明,(+)-高效氯氟氰菊酯处理使得生精小管直径增加,且性腺的发育基因的相对表达量显著高于(-)-高效氯氟氰菊酯暴露组[128]。丽斑麻蜴Eremias argus 经口暴露腈菌唑对映体28 d,S-腈菌唑降低了蜥蜴体重,且雌二醇(E2)含量降低,并且干扰了性腺发育相关基因的表达,证明S-腈菌唑对蜥蜴性腺系统发育可能具有干扰效应[129]。异丙甲草胺对斑马鱼性腺的干扰研究表明S-异丙甲草胺可干扰斑马鱼性腺发育相关基因:fshβ、cyp17、17βhsd和cyp19a的表达,导致雌性斑马鱼E2 含量水平增加,并且异丙甲草胺和S-异丙甲草胺对斑马鱼内分泌干扰作用的机制不同,具有生殖毒性[130]。
2.4 组学分析在手性农药研究中的作用
组学分析技术迅速发展,为多学科交叉研究提供了更多的可能。目前农药环境毒理学领域有大量研究使用代谢组、转录组、蛋白组等手段深度挖掘农药对环境生物的安全性影响。在手性农药环境毒理学方面,也有研究借助该方法深层次剖析手性农药对非靶标生物的影响以及产生选择性毒性效应的机制。Zhang 等利用代谢组学研究甲霜灵对映体对乳腺癌细胞的影响,发现其对映体可通过不同的通路来干扰细胞稳态,包括能量代谢、氨基酸代谢、脂质代谢和抗氧化防御等[131]。S-甲霜灵为低效体,但S-甲霜灵饲喂大鼠后检测大鼠尿液代谢谱发现,S-甲霜灵可干扰大鼠糖酵解、缬氨酸、亮氨酸和异亮氨酸的代谢水平,且这些紊乱的代谢途径可能导致遗传疾病并影响肝功能[131-133]。Qiu 等利用代谢组学研究了2,4-滴丙酸对映体对拟南芥的影响,发现其R体可干扰拟南芥乳糖代谢、淀粉和蔗糖代谢、三羧酸循环、脂肪酸生物合成途径和磷酸戊糖途径等[134]。在莴苣上分别施用戊唑醇对映体后进行代谢组学分析,R-戊唑醇可导致可溶性糖、氨基酸和有机酸的含量下调,进而影响莴苣的营养品质[135]。
转录组测序技术同样在手性农药环境毒理学方面得到了很好的应用。通过转录组测序表明,S-呋虫胺与赤子爱胜蚓生物大分子的相互作用和对内质网的影响比R-呋虫胺更强,这可能是对映体之间产生选择性毒性的主要原因[106]。当斑马鱼暴露于S-呋虫胺时,苯丙氨酸、酪氨酸和色氨酸的生物合成和视黄醇代谢受到显著干扰,进而对斑马鱼的能量代谢产生影响;而仅当暴露于高浓度的R-呋虫胺时,斑马鱼中与磷脂酰胆碱相关的代谢物才会产生变化,表明S-呋虫胺对非靶标生物斑马鱼的影响会更强[136]。更多的组学研究显示,暴露于S-呋虫胺会对蜜蜂的解毒相关代谢产生更严重的损害[137]。结合呋虫胺对映体毒性的相关研究表明:S-呋虫胺的环境风险要显著强于R-呋虫胺。
乙草胺对映体处理蚯蚓后,发现其转录组水平出现对映体选择性差异,R-乙草胺可导致蚯蚓部分信号通路功能障碍以及细胞凋亡,这可能是造成其毒性强于S-乙草胺的原因[117]。蚯蚓暴露于双炔酰菌胺对映体后,S-双炔酰菌胺诱导了更多的差异表达基因,主要集中于胆汁分泌和甲状腺激素信号通路,并且其对蚯蚓的毒性要比R-双炔酰菌胺更强[138]。氯氟醚菌唑可引起斑马鱼对映体选择性的肝毒性,该效应可能主要与能量代谢、脂质代谢和氨基酸代谢有关[139]。顺式联苯菊酯对斑马鱼的的选择性毒性研究表明,1S顺式联苯菊酯的毒理学效应大于1R-顺式联苯菊酯,其中包括生长抑制、神经毒性、脂肪酸合成以及胚胎发育[140]。Li 等利用转录组学揭示了甲氧咪草烟对映体对浮萍产生对映体选择性毒性的机制,其中R-甲氧咪草烟干扰了浮萍光合作用途径、谷胱甘肽代谢途径、戊糖磷酸途径、玉米素生物合成以及卟啉和叶绿素代谢途径中的基因表达,S-甲氧咪草烟影响苯丙氨酸代谢、苯丙烷生物合成、玉米素生物合成和次级代谢产物生物合成等通路的基因表达[96]。
利用组学测序技术可获取大量关于手性农药对映体对非靶标生物的毒理学信息,该手段可用来深层次解析手性农药对非靶标生物产生选择性效应的原因和机制,进而发现更多的毒理学数据,方便更加精准地评估手性农药对映体的毒理学效应以及健康风险,显示出交叉学科的研究优势,随着多组学技术的发展以及组学分析成本的降低,手性农药环境毒理学评估有望得到进一步研究。
3 小结与展望
目前,手性农药对映体对靶标生物活性差异的研究已经越来越广泛,多数手性农药对映体之间存在选择性生物活性,部分对映体活性差异高达500 倍以上[5,121],这可为手性农药单体的研发提供数据,但由于光学纯单体制备的成本以及技术等原因,有大量手性农药的对映体活性差异未见报道;现阶段关于对映体活性差异机制的研究多采用计算化学辅助的分子对接模型,并且关于手性农药对靶标生物活性差异机制的研究仍然缺乏。
手性农药对非靶标生物的选择性毒性问题目前越来越精细化,可利用手段越来越多,如组学分析、计算机模拟等。现阶段关于手性农药环境毒理学的研究多集中于环境模式生物,如斑马鱼、蚯蚓、大型溞、藻类等。手性农药对映体对人体安全性评估数据仍然不足,由于大鼠、小鼠等人体基因型相似的实验动物成本相对较高,试验周期相对较长,且试验所需要的手性农药单体的制备成本高,用量较大,因而只有少数研究进行了手性农药对映体对大鼠的健康风险评估[113,132,141]。现阶段对手性农药对映体食品安全相关标准的制定仍缺乏对映体水平的毒性数据,完善手性农药对人体的健康风险评估可更加精准的控制手性农药对映体的食品安全风险以及对人体的毒性效应。
谨以此文庆贺中国农业大学农药学学科成立70 周年。
Dedicated to the 70th Anniversary of Pesticide Science in China Agricultural University.
作者简介:

郭浩铭,男,博士研究生,1996年生,河南许昌人。于2021 年毕业于华中农业大学,获得硕士学位,现为中国农业大学理学院应用化学系在读博士研究生。研究方向为农药分析与环境安全。

王鹏,男,博士,教授,博士生导师,2006 年毕业于中国农业大学理学院应用化学系。现为中国农业大学理学院院长,研究方向为农药环境行为、食品污染规律和风险评价,关注农药的手性特征性,多角度深入研究农药的污染行为与规律,考察农药对人类健康的潜在影响并揭示发生机制,探索缓解农药风险效应的策略,保障食品安全与人类健康。博士论文获得全国百篇优秀博士学位论文,入选中组部“万人计划”青年拔尖人才、新世纪优秀人才支持计划、北京市科技新星计划、北京市优秀青年人才等人才计划。
