超高效液相色谱-串联质谱法快速分析氰霜唑及其代谢物CCIM在水果中的残留
2022-10-25符灵梅王玉健纪少凡
符灵梅, 王玉健, 徐 莉, 纪少凡
(海口海关技术中心,海南 海口 570311)
氰霜唑(cyazofamid)是2000年由日本石原产业株式会社合成,并与巴斯夫共同开发的咪唑类保护性杀菌剂。氰霜唑对卵菌纲病原菌如疫霉菌、腐霉菌等具有很高的杀菌活性[1-2]。2013年,我国如东众意化工有限公司成为首家获得氰霜唑原药产品登记的企业。目前我国批准登记的作物和防治对象共9种,分别是番茄晚疫病、马铃薯晚疫病、荔枝树霜疫霉病、黄瓜霜霉病、葡萄霜霉病、观赏菊花霜霉病、蔷薇科观赏花卉霜霉病、西瓜疫病、大白菜根肿病等。氰霜唑使用后会迅速分解,CCIM是氰霜唑在植物体内的主要降解产物,比氰霜唑的毒性高[3]。两者在农副产品中残留可能会通过膳食摄入给人们带来潜在风险。因此,我国的GB 2763—2016《食品安全国家标准 食品中农药最大残留限量》标准中规定了氰霜唑及其代谢物在葡萄、荔枝和西瓜的最大残留限量为1、0.02、0.5 mg/kg;日本对氰霜唑及其代谢物在橙、苹果、油桃和菠萝中规定的最大残留限量为5、1、1、1 mg/kg。
目前,国内外对氰霜唑的残留分析主要有LCMS/MS法、LC-DAD法和电化学法,这些方法或者只是建立了氰霜唑母体的分析方法,或者样品前处理烦琐,有机试剂用量较大。该研究采用超高效液相色谱-串联质谱技术,并结合QuEChERS样品前处理方法,建立了同时定性、定量测定水果中氰霜唑及其代谢物CCIM残留量的分析方法,该方法前处理简单、能快速定性及定量、准确度高、重现性好,可为开展氰霜唑及其代谢物CCIM在水果中残留的监管提供技术依据。
1 材料与方法
1.1 试剂与仪器
氰霜唑(纯度98.7%):Dr.Ehrenstorfer公司产品;CCIM(纯度99.9%):first standard公司产品;乙腈、乙酸、甲酸(均为色谱纯):美国Fisher公司产品;无水硫酸镁(分析纯):广州试剂有限公司产品;氯化钠(分析纯):国药集团化学试剂有限公司产品;十八烷基硅烷键合相(C18)、弗罗里硅土:Agilent公司产品;Milli-Q超纯水:法国Millipore公司产品。
超高效液相色谱仪(UPLC):美国WATERS公司产品;API 4000Q四极杆质谱仪(配有电喷雾离子源):美国AB公司产品;Harvard II针 泵:美国Varian公司产品;MS3Basic旋涡混匀器:德国IKA公司产品;Centrifuge 5810R离心机:Eppendorf公司产品;G-285电子天平:Mettler公司产品。
1.2 样品前处理
水果样品取可食部分切碎、混匀。称取待测样品5.000 g于50 mL具塞离心管中,加入20 mL含体积分数1.0%乙酸的乙腈溶液,涡旋振荡2 min,加入4 g无水硫酸镁和1 g氯化钠,涡旋混合3 min,以9000 r/min离心5 min,取上清液1.0 mL于玻璃离心管中,分别各加入50 mg C18粉末和弗罗里硅土粉末,涡旋混合30 s,以3000 r/min离心3 min,上清液过0.2 μm有机滤膜,待测。
1.3 仪器条件
色谱条件:色谱柱为Capcell PAK C18(150 mm×2.0 mm,5 μm);流动相:A为乙腈,B为体积分数0.1%甲酸水溶液,梯度洗脱;流量:0.75 mL/min;进样量:5 μL。
质谱条件:电喷雾离子源(ESI),温度550℃,电压5500 V;雾化气、气帘气、辅助气和碰撞气均为高纯氮气;正离子多反应监测(MRM)模式。
2 结果与讨论
2.1 提取溶剂的选择
根据文献报道,国内外对氰霜唑和CCIM残留的分析均采用QuEChERS前处理方法,提取溶剂采用乙腈或含体积分数1.0%乙酸的乙腈,均能得到较好的回收率和精密度。为比较乙腈、含乙酸乙腈的提取效果,采用标准添加法,分别用乙腈、含体积分数1.0%乙酸的乙腈对氰霜唑和CCIM标准物质进行提取(加标量为0.1 μg),计算回收率并采用SPSS(Version 19.0)对数据进行配对样本T检验 (P<0.05)分析。结果表明,使用乙腈和含体积分数1.0%乙酸的乙腈作为提取溶剂时,氰霜唑回收率的显著性为0.001(P<0.05),CCIM回收率的显著性为0.004(P<0.05),差异显著,且使用乙腈作为提取溶剂时,氰霜唑回收率为90.1%~127.0%,RSD为11.67%,CCIM回收率为85.2%~147.0%,RSD为18.98%,超出GB/T 27417—2017《合格评定 化学分析方法确认和验证指南》对回收率的要求。使用含体积分数1.0%乙酸的乙腈作为提取溶剂时,氰霜唑回收率为76.4%~105.0%,RSD为7.28%,CCIM回 收 率 为83.8%~108.0%,RSD为7.35%,满足GB/T 27417—2017《合格评定 化学分析方法确认和验证指南》的相应要求。
在pH为4.90~9.56时,酸性越强,氰霜唑在水溶液中就越稳定;随着OH-离子浓度升高,氰霜唑的磺酸(叔)胺基团越不稳定[4]。为考察乙酸体积分数对氰霜唑、CCIM回收率的影响,采用标准添加法,考察体积分数分别为0.1%、0.5%、1.0%、1.5%、2.0%时乙酸乙腈溶液的提取回收率,并采用SPSS(Version 19.0)的Duncan多重比较检验法进行显著性分析(P<0.05),结果见表1。当提取液乙酸体积分数达到1.0%后,氰霜唑和CCIM的平均回收率无显著性差异,因此选择提取液中乙酸体积分数为1.0%。
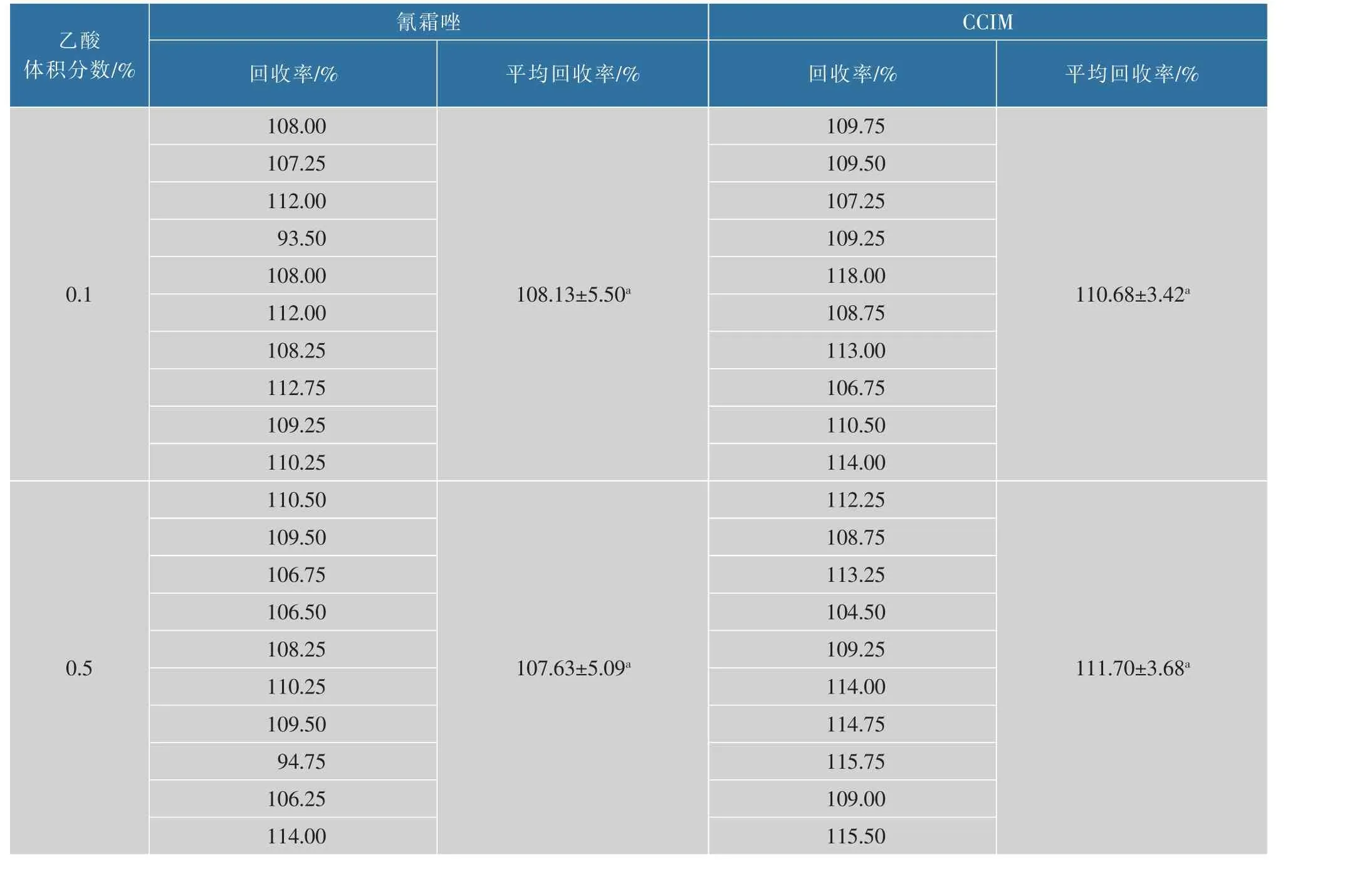
表1 乙酸体积分数对氰霜唑、CCIM回收率的影响及差异显著性分析(n=10)Table 1 Influence of acetic acid volume fraction on the recoveries and significance analysis of cyazofamid and CCIM(n=10)

续表1
2.2 提取溶剂体积的选择
分别使用5、10、15、20、25、30 mL含乙酸体积分数1.0%的乙腈提取1.0 μg氰霜唑和CCIM标准物质,上机进行检测,以提取液体积为横坐标,以平均回收率为纵坐标绘图,结果见图1。提取液体积为20 mL时,可将1.0 μg氰霜唑和CCIM提取完全,因此选择提取液体积为20 mL。

图1 提取液体积与平均回收率关系图Fig.1 Diagram of extraction volume and average recovery rate
2.3 色谱条件的选择
根据文献报道,国内外对氰霜唑和CCIM的残留分析使用的色谱柱主要有:Phenomenex Kinetex C18柱(100 mm×2.1 mm×2.6 μm)[5]、BEH C18柱(100 mm×2.1 mm×1.7 μm)[6]、Agilent Eclipse XDB-C18柱(150 mm×4.6 mm×5 μm)[4]、Poroshell 120 EC-C18柱(100 mm×3.0 mm×2.7 μm)[7]、XBridge-C18柱(150 mm×2.1 mm×3.5 μm)[8]、Agilent Eclipse XDB-C18柱(150 mm×2.1 mm×3.5 μm)[9]、Phenomenex Kinetex PFP 100A柱(75 mm×4.6 mm×2.6 μm)[10]、Eclispe plus C18RRHD柱(50 mm×2.1 mm×1.8 μm)[11]、Trace Excel 120ODSA柱(100 mm×4.6 mm×5 μm)[12]。由以上文献可见,国内外对氰霜唑和CCIM的残留分析使用的色谱柱主要以C18为填料。作者考察了C18填料、C8填料、苯基柱等3类常见反相柱,包括Capcell PAK C18(2.0 mm×100 mm,5 μm)、Capcell PAK C18(2.0 mm×150 mm,5 μm)、Thermo Accjore C18(3.0 mm×150 mm,2.6 μm)、Phenomenex Kinetex XB-C18(3.0 mm×150 mm,2.6 μm)、BEH C8(2.1 mm×50 mm,1.7 μm)、Eclipse XDB-C8(4.6 mm×150 mm,5 μm)、Capcell PAK PFP(2.0 mm×150 mm,5 μm)等。结果发现,在表2中洗脱梯度下,Capcell PAK C18(2.0 mm×150 mm,5 μm)分析柱分离效果优于其他反相柱。同时还分别使用甲醇、乙腈作为流动相A,水、体积分数0.1%甲酸水作为流动相B,结果发现,使用乙腈作为流动相A、体积分数0.1%甲酸水作为流动相B时,较之甲醇-水、甲醇-体积分数0.1%甲酸水和乙腈-水流动相,基线平稳,且峰形好。因此选择Capcell PAK C18柱(2.0 mm×150 mm,5 μm)作为分析柱,乙腈作为流动相A,体积分数0.1%甲酸水作为流动相B,梯度洗脱条件见表2。在上述条件下,0.02 μg/mL氰霜唑及其代谢物CCIM标准溶液的MRM色谱图见图2。

表2 流动相梯度洗脱条件Table 2 Mobile phase gradient elution conditions

图2 氰霜唑及其代谢物CCIM标准溶液的总离子流图Fig.2 Total ion flow diagram of cyazofamid and CCIM standard solution
2.4 质谱条件的优化及选择
将氰霜唑和CCIM标准品溶液采用流动注射直接进样,通过全扫描确定化合物母离子,再对母离子进行二级质谱扫描,得到碎片离子,通过优化条件,得到二级质谱图。通过MRM选择相对丰度较高的离子对,确定为定性、定量离子对,并优化去簇电压、碰撞电压等参数,综合考量离子丰度、背景干扰等因素,确定质谱条件见表3,采用电喷雾离子源(ESI),温度550℃,电压5500 V,雾化气、气帘气、辅助气和碰撞气均为高纯氮气,MRM模式。氰霜唑和CCIM子离子全扫描质谱图见图3、图4。

表3 离子对及相关电压参数Table 3 Ion pairs and related voltage parameters

图3 氰霜唑子离子全扫描质谱图Fig.3 Total scanning of ion mass-spectrogram of cyazofamid

图4 CCIM子离子全扫描质谱图Fig.4 Total scanning of ion mass-spectrogram of CCIM
2.5 净化方法的选择
由于水果基质复杂,直接提取上机分析会使色素、甾醇和维生素等杂质残留于分析柱及仪器中,需采用QuEChERS前处理方法进一步净化[13-14]。分别添加各50 mg的PSA粉末、C18粉末、石墨化炭黑粉末、弗罗里硅土粉末于0.010 mg/kg氰霜唑和CCIM混合标准溶液中,测定其回收率。结果发现PSA粉末、石墨化炭黑粉末对氰霜唑和CCIM有吸附保留,氰霜唑和CCIM的回收率分别为7.9%~29.4%和0~35.8%;使用C18粉末净化时,氰霜唑和CCIM的回收率分别为83.2%~90.6%和87.9%~93.5%;使用弗罗里硅土粉末净化时,氰霜唑和CCIM的回收率分别为82.5%~93.2%和89.1%~101.0%;而使用C18粉末和弗罗里硅土粉末作为净化剂时,氰霜唑和CCIM的回收率分别为88.4%~110.0%、95.2%~108.0%。由此可见,C18粉末和弗罗里硅土粉末混合使用时,净化效果较佳。因此,选择C18粉末和弗罗里硅土粉末作为净化剂。
2.6 基质效应的评价
基质效应(MEs)评价是将在基质匹配校准中获得的斜率与在标准溶液校准中获得的斜率进行比较,并计算氰霜唑和CCIM的基质与溶剂的斜率比,使用以下公式计算:MEs(%)=(基质匹配校准中获得的斜率/标准溶液校准中获得的斜率-1)×100。通过比较乙腈与不同基质匹配标准溶液的基质效应(质量浓度为0.001~0.040 μg/mL)可得,氰霜唑在葡萄、荔枝、西瓜、苹果、油桃、橙、菠萝中的MEs分别为53.85%、32.74%、27.61%、3.70%、4.32%、13.68%、11.84%;CCIM在葡萄、荔枝、西瓜、苹果、油桃、橙、菠萝中的MEs分别为33.73%、40.70%、40.58%、7.75%、5.13%、2.73%、7.09%。由此可见,不同样品基质效应差异显著,因此选择基质标准曲线作为定量的校准曲线。
2.7 基质标准曲线的配制
准确吸取一定量的混合标准使用液,用空白基质提取液逐级稀释成质量浓度为0.001、0.002、0.005、0.010、0.020、0.040 μg/mL的基质混合标准工作溶液,供液相色谱-串联质谱联用仪测定,以定量离子峰面积为纵坐标,基质标准溶液质量浓度为横坐标,绘制标准曲线。线性方程及相关系数见表4。

表4 氰霜唑和CCIM基质标准曲线的线性回归方程及相关系数Table 4 Linear regression equation and correlation coefficient of matrix standard curves of cyazofamid and CCIM
2.8 方法检出限和定量限
根据GB/T 27417—2017《合格评定 化学分析方法确认和验证指南》,采用空白标准偏差评估法确定方法检出限和定量限,加入最低可接受质量浓度的样品作为空白独立测定10次,得出结果的标准偏差(s),以(空白平均值+4.65s)作为检出限,以(空白平均值+10s)作为定量限,结果见表5。该方法对葡萄、荔枝、西瓜、苹果、油桃、橙、菠萝的定量限满足国内外对氰霜唑及其代谢物CCIM的限量要求。

表5 不同基质中氰霜唑和CCIM的检出限和定量限Table 5 LOD and LOQ of cyazofamid and CCIM in different matrices
2.9 方法的精密度、重复性和准确度
在葡萄、荔枝、西瓜、苹果、油桃、橙、菠萝阴性样品中按照表6至表12中的添加水平添加氰霜唑和CCIM标准溶液,每个进行6次平行添加回收实验,结果表明,在0.004~0.080 mg/kg添加水平内,氰霜唑和CCIM平均回收率分别为80.71%~103.27%和76.62%~100.20%;相对标准偏差分别为4.14%~11.15%和3.24%~11.16%,满足GB/T 27417—2017《合格评定 化学分析方法确认和验证指南》标准规定的要求。

表6 葡萄样品添加回收率及RSD(n=6)Table 6 Recovery rate and RSD of grape sample(n=6)

表12 菠萝品添加回收率及RSD(n=6)Table 12 Recovery rate and RSD of pineapple sample(n=6)

表7 荔枝样品添加回收率及RSD(n=6)Table 7 Recovery rate and RSD of lychee sample(n=6)

表8 西瓜样品添加回收率及RSD(n=6)Table 8 Recovery rate and RSD of watermelon sample(n=6)

表9 苹果样品添加回收率及RSD(n=6)Table 9 Recovery rate and RSD of apple sample(n=6)

表10 油桃样品添加回收率及RSD(n=6)Table 10 Recovery rate and RSD of nectarine sample(n=6)

表11 橙样品添加回收率及RSD(n=6)Table 11 Recovery rate and RSD of orange sample(n=6)
3 结语
选用QuEChERS前处理方法,结合超高效液相色谱-串联质谱技术,建立了同时检测葡萄、荔枝、西瓜、苹果、油桃、橙和菠萝基质样品中氰霜唑及其代谢物CCIM残留量的方法。该方法操作简单、快速、准确、灵敏度高、重现性好,可为农业部门、市场监管部门和第三方检测机构提供技术参考。
