用于卡那霉素检测的竞争性比色传感策略研究
2022-10-25赵婷婷卞晓军
赵婷婷, 陈 谦, 卞晓军,2,3, 颜 娟*,2,3
(1.上海海洋大学 食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 201306;3.农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306)
卡那霉素(kanamycin,KAN)是一种氨基糖苷类抗生素[1]。由于它具有阻断蛋白质合成的能力,因此可广泛用于治疗细菌等微生物引起的感染[2]。但是,过度、过量使用抗生素会导致其残留在肉、蛋、奶制品及其他动物源性食品中,并最终通过人体内循环系统累积到体内,造成一系列的危害,如:肾毒性、耳毒性以及过敏反应等[3]。许多国家、地区对KAN在牛奶中允许的最高残留限量做了规定,例如,欧盟将残留限量定为150 μg/kg[4],中国则为200 μg/kg[5]。因此,建立一种灵敏的KAN检测方法对食品、环境及人类健康都是至关重要的。
目前,常用的KAN检测方法有酶联免疫吸附实验[6]、高效液相色谱[7-8]、高效液相色谱-质谱联用[9-10]和毛细管电泳等,但其中有些方法依赖于抗原、抗体结合的稳定性,如酶联免疫吸附实验;有的方法需要依赖大型仪器,需要专业的人员和烦琐的操作,如高效液相色谱和高效液相色谱-质谱联用;有的方法本身响应时间较长,如表面等离子共振法;而毛细管电泳法则存在灵敏度较低的问题。鉴于这些传统的检测方法有各自的不足,因而开发一种简单、快速、灵敏度高的KAN检测方法迫在眉睫。
适配体(aptamer,Apt)是一种从体外核酸分子文库中通过指数富集配体系统进化技术获得的单链寡核苷酸序列[11-12],它能够与靶分子发生高特异性、高亲和力结合[13-14]。与抗体相比,适配体具有热稳定性高、生产成本低、便于生产和修饰等诸多优点[15],因此基于适配体的生物传感器得到了研究人员的广泛重视[16-17]。自从Song等利用亲和层析技术筛选出对KAN具有高特异性的适配体以来[18],用于检测KAN的适配体传感器,如比色[19-20]、荧光[21-22]和电化学[23]传感器等相继涌出。在这些方法中,比色适配体传感器因成本低、简单实用、无需任何精密仪器,肉眼就能够观察其颜色变化而得到广泛应用[24]。
近年来,基于磁性颗粒和碳纳米管等磁性材料特性设计的纳米结构,用来分析抗生素残留已经得到了诸多研究[25-27]。磁性颗粒是一类可负载多种表面官能团的粒子[28],因其具有表面结合小分子稳定性好、测定动力学强、固定小分子定向改善等优点,可以利用磁分离技术实现流体中靶标分子的分离和富集,故在生物传感器方面得到了广泛应用[29-31]。作者制备了磁珠-卡那霉素 (magnetic beadskanamycin,MBs-KAN)复合物,通过该复合物表面的KAN与溶液中待测KAN共同竞争性地识别生物素修饰的适配体(biotin modified aptamer,Biotin-Apt),开发了一种检测KAN的竞争性比色适配体传感器。随着待测KAN含量增加,溶液中的适配体倾向于与其结合,所以磁珠表面的KAN竞争性识别适配体的量减少,进而导致链霉亲和素标记的辣根过氧化物酶 (streptavidin-labeled horseradish peroxidase,SA-HRP)的量减少,从而影响HRP催化3,3’,5,5’-四 甲 基 联 苯 胺 (3,3’,5,5’-tetramethylbenzidine,TMB)的显色反应,使蓝色发色物质的量减少。基于该比色适配体传感器的紫外-可见吸收光谱值与待测KAN的浓度呈负相关关系,从而可以对KAN进行定量检测。该传感器操作简单、灵敏度高、选择性好,可以通过替换相应的磁性复合物和适配体来实现不同种类抗生素的检测,具有良好的应用前景。
1 材料与方法
1.1 材料与试剂
DNA序列(5′-Biotin-TTT TTT TTT TTG GGG GTT GAG GCT AAG CCG AGT CAC-3′),纯度为HPLC级别:由生工生物工程(上海)股份有限公司合成并纯化;磷酸盐缓冲液(phosphate buffer saline,PBS,20×,pH 7.4)、Tris-HCl缓冲液(20 mmol/L,pH 7.0)、Biotin-11-dUTP(1 mmol/L)、KAN、阿布拉霉素(apramycin,APM)、巴龙霉素(paromomycin,PAR)、链霉素(streptomycin,STR)、庆大霉素(gentamicin,GEN)和新霉素(neomycin,NEO):生工生物工程(上海)股份有限公司产品;BioMag®Plus修饰的磁珠、磁分离器:美国Polysciences Inc公司产品;牛血清白蛋白(bovine serum albumin,BSA):美国Amresco公司产品;TMB(含H2O2):美国Neogen公司产品;SA-HRP:赛默飞科技有限公司(上海)产品;1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(1-ethyl-3-(3-dimethylaminopropyl)carbodiimide,EDC)、2-(N-吗 啉 代) 乙 磺 酸 (2-(N-morpholino)ethanesulfonic acid hydrate,MES):阿拉丁试剂有限公司(上海)产品;Millipore净化系统的超纯水:美国密理博公司产品。
1.2 仪器与设备
HCM100-Pro恒温振荡金属浴、D1008手持式离心机:大龙兴创实验仪器(北京)有限公司产品;UV-2540紫外-可见分光光度计:日本岛津公司产品;Hitachi S-3400N扫描电子显微镜:日本株式会社日立制作所产品;移液枪:德国Brand公司产品;Synergy2 SLFPTAD多功能酶标仪:美国伯腾仪器有限公司产品。
1.3 实验方法
1.3.1 MBs的活化磁珠的活化即对氨基磁珠进行醛基化,具体步骤如下:用移液枪移取BioMag®Plus修饰的磁珠3 mL(150 mg)到50 mL离心管,加24 mL吡啶缓冲液(0.01 mol/L),在室温下剧烈振荡混合均匀后,进行磁分离,弃去上清液,该过程重复3次;之后加入12 mL体积分数5%的戊二醛溶液(用0.01 mol/L吡啶缓冲液稀释配制),在非磁性混合设备即恒温摇床振荡器中25℃避光振荡3 h,以保证磁珠和戊二醛溶液充分混合;然后进行磁分离去除未反应完的戊二醛溶液,用24 mL吡啶缓冲液(0.01 mol/L)反复清洗3次,直至溶液澄清后进行磁分离操作,移除上清液;最终,将磁珠加入15 mL的1×PBS中重悬,4℃储存备用。
1.3.2 MBs-KAN的制备MBs-KAN采用碳二亚胺交联法制备[32],详细的制备步骤如下:取2 mL(20 mg)醛基化磁珠于15 mL离心管中,离心丢弃上清液,加入2 mL 20 mmol/L MES偶联液洗涤3次;之后分别加入2 mL 20 mmol/L MES偶联液和20 g/L EDC溶液重悬磁珠,于恒温摇床振荡器25℃下避光活化3 h;磁分离后,用2 mL 20 mmol/L MES偶联液洗涤3次;加入100 g/L的硫酸卡那霉素,在25℃下放于恒温摇床振荡器中避光孵育振荡6 h,之后进行磁分离,弃去上清液;最后将产物用4 mL的清洗缓冲液(1×PBS,1 mmol/L MgCl2,体积分数0.05% Tween-20,PH 7.4)洗涤3次以除去未反应的硫酸卡那霉素,将沉淀重悬于2 mL的1×PBS溶液中,4℃储存备用。
1.3.3 竞争性适配体传感器的构建取5 μL制备好的MBs-KAN复合物,磁分离去除上清液,加入50 μL体积分数为2%的BSA溶液室温下封闭40 min。封闭结束后,磁分离去除上清液,加入500 nmol/L的Biotin-Apt以及20 μL不同浓度的KAN溶液(0、0.05、0.5、5、50、500 nmol/L),将离心管放于旋涡振荡器上振荡混匀,之后放入金属浴于37℃孵育1 h。孵育结束后,磁分离去除上清液,将产物用清洗缓冲液冲洗3次。
1.3.4 比色适配体传感器的构建将上述获得的磁性复合物用50 μL体积分数4%的BSA溶液进行封闭,封闭时间40 min,结束后进行磁分离操作以除去多余的BSA溶液。之后在离心管中加入2 μL稀释1000倍的SA-HRP,避光反应20 min后进行磁分离。将磁分离后的沉淀部分加入50 μL 0.01 mol/L的PBS缓冲液清洗6次,直至溶液澄清,后进行磁分离操作弃去上清液。在上述产物中加入50 μL TMB溶液(含H2O2),在避光状态下反应5 min,磁分离后,上清液被吸取到96孔板中,在酶标仪中波长652 nm处测量吸光度。
1.3.5 牛奶实际样品中检测KAN牛奶样品购自上海罗森超市,具体的处理步骤如下:2 mL牛奶样品用PBS缓冲液稀释10倍。将牛奶样品在4 °C以11000 r/min离心25 min,除去沉淀后,用0.22 μm的滤膜过滤上清液,收集得到的滤液。将一系列不同浓度的KAN标准溶液加到牛奶滤液中,配成终浓度为0.5、1、5 nmol/L的KAN溶液用于检测。另外将一组不加KAN的经过预处理的牛奶样品作为对照组。将加标的样品和对照组都进行上述操作,测定652 nm处的吸光度。
2 结果与讨论
2.1 竞争性比色适配体传感器的检测原理
基于磁珠表面竞争性生物识别的比色适配体传感器用于检测KAN的原理见图1。该竞争性适配体传感器的构建核心在于MBs-KAN与待测样中的KAN共同竞争识别Biotin-Apt。当溶液中不存在游离的KAN时,由于适配体与靶标会发生特异性识别,所以磁珠上共价交联的KAN就会捕获Biotin-Apt,从而使Biotin结合在磁性复合物的表面。当体系中加入SA-HRP后,生物素与链霉亲和素识别连接,辣根过氧化物酶(HRP)被间接连接到磁珠复合物的表 面。加 入TMB时,HRP催化H2O2介 导 的TMB发生还原反应,生成蓝色的氧化型TMB,从而在652 nm处出现强吸收峰。而当溶液中存在过量的待测KAN时,由于游离的KAN相较于磁珠上交联的KAN有着更小的空间位阻,适配体会优先结合待测样中的KAN,这使得磁珠上结合的适配体以及HRP的量大大减少甚至没有,因此催化TMB后溶液的吸光度降低。随着待测样中KAN浓度升高,该传感器在652 nm处的吸光度降低,根据吸光度的差值对KAN进行定量检测。
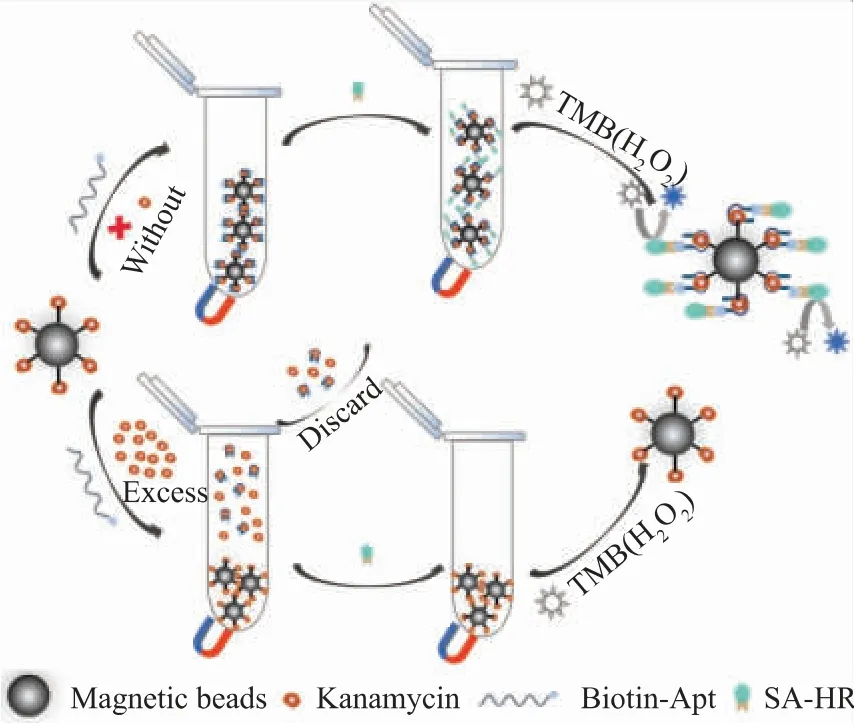
图1 基于磁珠表面竞争性生物识别的比色适配体传感器用于检测KAN的示意图Fig.1 Schematic illustration of a colorimetric aptasensor based on the competitive biological recognition on the surface of magnetic beads for detecting KAN
2.2 MBs-KAN的表征
首先采用扫描电子显微镜对预制备的MBs-KAN磁性复合物进行表征(见图2)。由于超顺磁性结构微域的存在,导致MBs会发生一定的团聚[33],因此图2(a)中出现一些磁珠聚集体;然而当其表面连接KAN之后,由于KAN的介导作用,使得更多磁珠聚集成团,相比图2(a)而言,图2(b)中磁性聚集体的粒径进一步增大(红色箭头)。聚集体尺寸的变化一方面可反映KAN在磁珠表面的成功连接。并且,MBs-KAN复合物的制备也将进一步通过KAN与适配体之间的识别进行验证。另外,据文献报道,磁珠表面具有多孔结构,经过蛋白质(如抗体)修饰及填充,磁珠的多孔表面变得顺滑[34],这也说明具备该结构的磁珠具有更大的比表面积,更有利于如KAN等小分子的组装。

图2 扫描电子显微镜图像Fig.2 Scanning electron microscope image
2.3 MBs-KAN识别Biotin-Apt的验证
该竞争性适配体传感器制备成功与否的关键在于适配体能否识别KAN。基于此,进一步验证了Biotin-Apt与KAN的生物识别。首先,将BSA封闭后的醛基化磁珠与Biotin-Apt孵育后收集上清液,测试孵育前后DNA的吸光度。结果如图3(a)所示,DNA的吸光度无明显变化;而当Biotin-Apt与MBs-KAN相互作用后,结果如图3(b)所示,其上清液中游离的Biotin-Apt即黑线所示的吸光度,较孵育前Biotin-Apt的吸光度明显降低,表明一定量的适配体与KAN识别后结合在MBs-KAN复合物表面。该结果不但进一步表明了MBs-KAN的成功制备也验证了适配体与KAN的特异性识别。
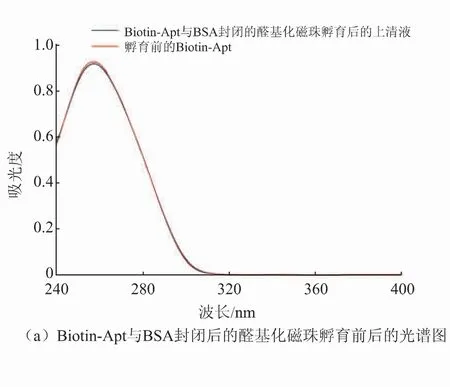
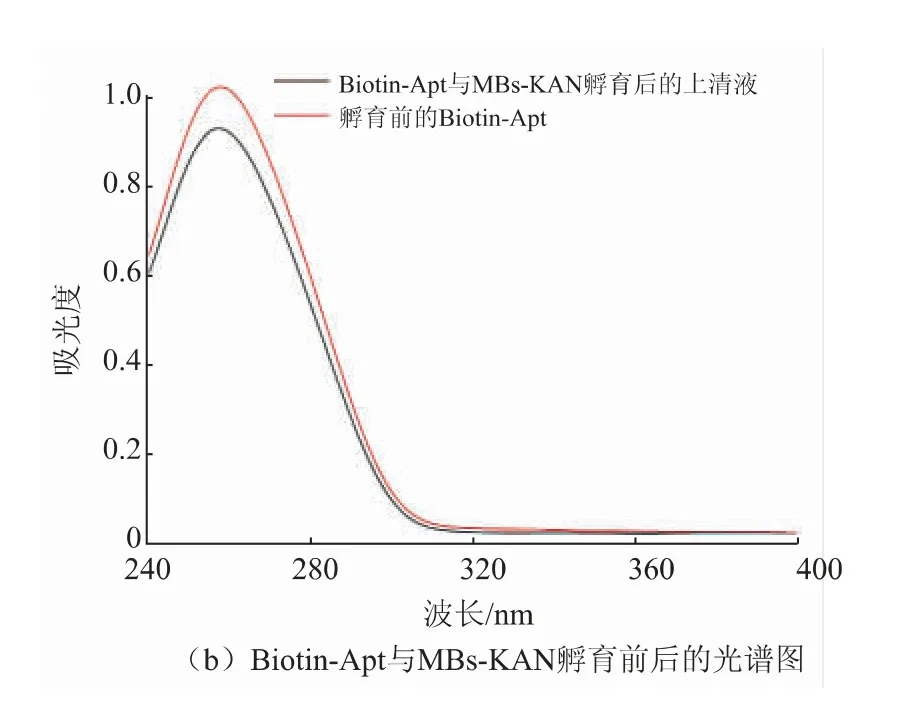
图3 紫外吸收光谱图Fig.3 Ultraviolet absorption spectrum
2.4 适配体传感器用于检测KAN的可行性验证
为了验证该竞争性适配体传感器的竞争效应,设计了两组实验:第一组实验是将MBs-KAN与Biotin-Apt孵育(不加入待测物KAN)作为对照组,另一组则通过预实验发现5 μmol/L及更高浓度KAN加入此竞争体系时,吸光度保持在一个很低的数值并且不会随着浓度升高而有所下降,因此将MBs-KAN与Biotin-Apt孵育后加入过量的KAN(5 μmol/L)作为实验组。两组实验在相同条件下进行。结果如图4所示,实验组(过量的KAN)的吸光度明显低于对照组(无KAN)。这很可能是因为实验组中过量的游离KAN具备更小空间位阻,因而更易与Biotin-Apt结合。MBs-KAN复合物竞争结合的适配体的量较对照组大大减少,进而后续HRP催化TMB的呈色效应大大降低。通过两组吸光度的差值,可以清楚看到磁珠表面KAN与样品中KAN对适配体的竞争识别能力差异明显,因此该竞争性适配体传感策略具有实施的可能性。
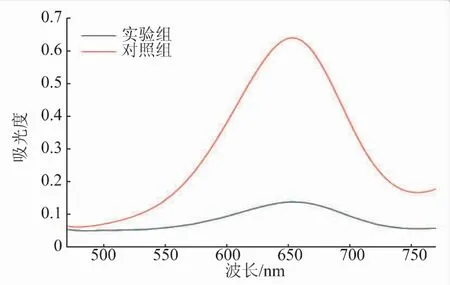
图4 验证可行性的紫外-可见吸收光谱图Fig.4 UV-vis absorption spectrum for the feasibility verification
2.5 性能分析
2.5.1 适配体传感器灵敏度测试为了研究该竞争性比色传感体系的检测灵敏度,将一系列不同浓度的KAN加入该传感器体系中,可以发现:随着KAN浓度的增加(0~500 nmol/L),自然光下可清晰观察到显色程度不同的蓝色发色产物,这表明该适配体传感器可用于裸眼检测KAN(见图5(a))。同时,随着KAN浓度的增加,在652 nm处的吸光度逐渐降低(见图5(b))。此外,ΔA652nm与KAN浓度的对数值在0.05~500 nmol/L之间存在良好的线性关系(ΔA652nm=0.0427 lg cKAN+0.0557,R2=0.9871)(见图5(c))。其中652 nm处的吸光度变化值ΔA652nm的计算公式如下:
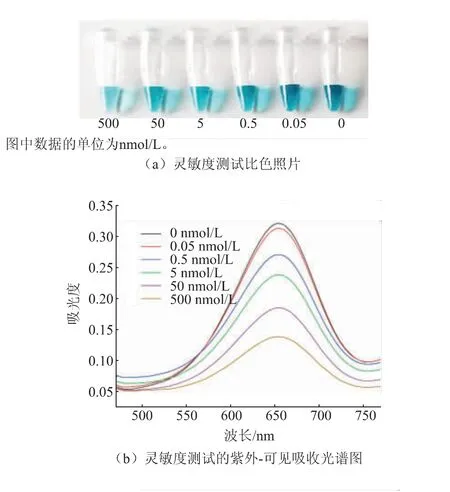
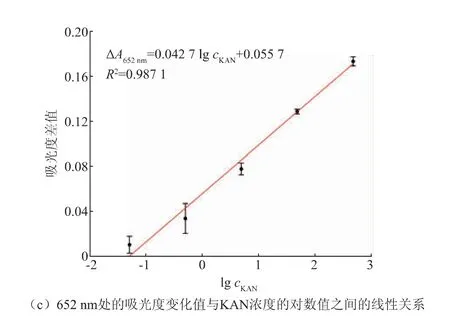
图5 灵敏度检测结果Fig.5 Results of sensitivity detection

式中:Ac为对照组,即在无游离KAN的情况下,该适配体传感器在652 nm处的吸光度;Ae为实验组,即待测样的吸光度。
通过使用LOD=3σ/S公式估算,该传感器的检出限为0.21 nmol/L,其中空白溶液的相对标准偏差为σ,S是校正曲线的斜率。
依据浓度计算公式:
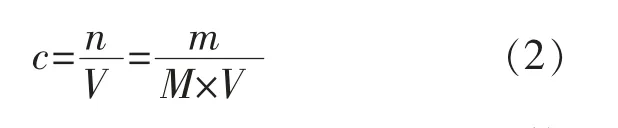
式中:c为浓度,mol/L;n为物质的量,mol;V为体积,L;m为质量,g;M为KAN的摩尔质量,g/mol。
将该传感器的检测限按公式换算可得0.122 μg/kg,远低于中国标准对牛奶中KAN规定的最高残留限量200 μg/kg。
将该竞争性比色适配体传感器与其他检测KAN的方法相比较,如表1所示,该方法不需要大型仪器,具有更宽的检测范围和更低的检测限,优势明显,可以应用于食品安全检测领域KAN的痕量分析。
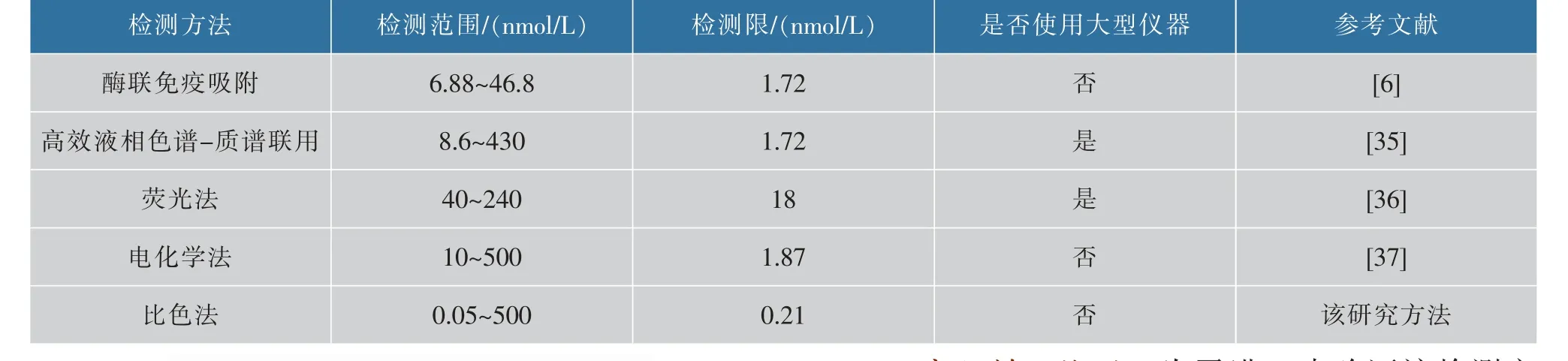
表1 现有检测KAN的传感器检测性能比较Table 1 Detection performance comparison of existing KAN detecting sensors
2.5.2 特异性检测为了探究该适配体传感器对KAN的选择性,选取与KAN结构相似的氨基糖苷类抗生素进行比较验证。KAN浓度为500 nmol/L,其他氨基糖苷类抗生素浓度是5 μmol/L,均为KAN的10倍。对照组(Blank组)为不加KAN组,按照上述1.3.4的步骤应用该适配体传感器检测,结果如图6所示。首先裸眼即可观察到,实验组(KAN组)溶液颜色明显浅于对照组与其余组溶液颜色;而柱形图结果进一步证实,只有实验组具有明显的吸光度变化,而其他氨基糖苷类抗生素的吸光度变化与实验组相比,几乎可忽略。该结果表明,该竞争性生物识别的比色适配体传感器对KAN具有良好的选择性。
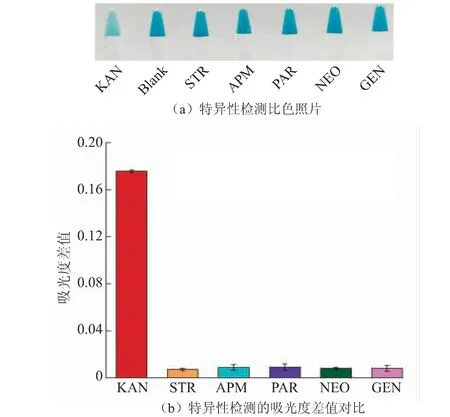
图6 竞争性比色适配体传感器对KAN的选择性Fig.6 Selectivity of competitive colorimetric aptamer sensors for KAN
2.5.3 实际样品检测为了进一步验证该检测方法在实际样品分析中的适用性,将不同浓度的KAN加到牛奶样品中,如表2所示,回收率为93.8%~102.0%,相对标准偏差为3.1%~6.3%,可以看出该策略在牛奶实际样品中有较好的精确性和重现性,说明该比色适配体传感器可用于实际样品的检测。
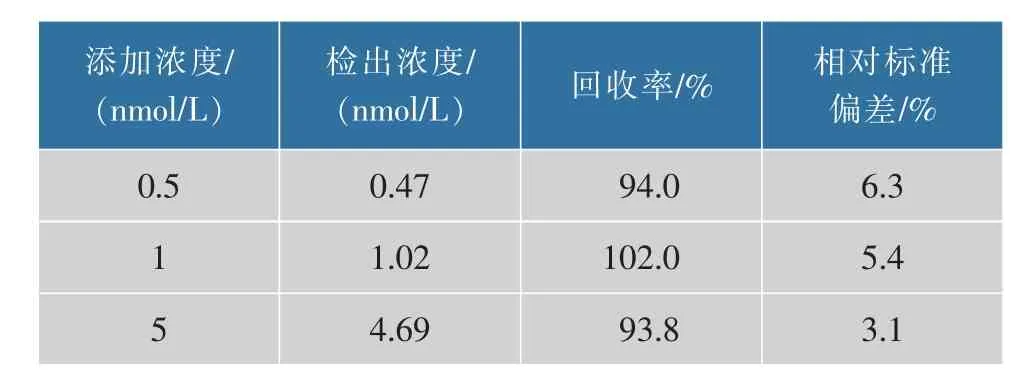
表2 牛奶样品中加标的KAN检测Table 2 Detection of KAN spiked in milk samples
3 结语
作者开发了一种基于磁珠表面竞争性生物识别的比色适配体传感器,通过磁珠表面连接的KAN以及检测样本中的KAN与适配体的竞争性生物识别性能的差异来构建应用于检测KAN的比色传感策略。该生物传感器的设计核心在于利用磁珠、KAN与适配体进行竞争体系的构建。首先磁珠和KAN的共价交联,保证了竞争体系的稳定性;另外由于磁珠的存在,大大简化了实验操作的同时也有利于降低实验背景,提高检测灵敏度;最后KAN与适配体的生物识别也确保了该方法的特异性检测。总之,该方法操作简便、快速,拥有较宽的检测范围和较低的检测限,在抗生素检测方面具备良好的应用前景,同时也为食品安全领域其他污染物的快速检测提供了良好思路。
