铜和磺胺甲唑复合污染下人工湿地对禽畜养殖尾水的处理效果
2022-10-25杨玲丽褚一凡谭启洋周巧红吴振斌
杨玲丽 马 琳 刘 伟 褚一凡 谭启洋 周巧红 吴振斌 贺 锋
(1.中国科学院水生生物研究所 淡水生态与生物技术国家重点实验室, 武汉 430072; 2.中国科学院大学, 北京 100049;3.中国科学院武汉植物园/水生植物与流域生态重点实验室, 武汉 430074)
一些重金属(铜、锌、铁等)和抗生素(四环素类、喹诺酮类、磺胺类等)可以促进养殖动物生长、预防和治疗动物疾病, 常作为饲料添加剂, 在禽畜养殖中应用广泛[1,2]。然而饲料中的重金属和抗生素生物利用率较低, 20%—80%以原型或代谢产物形式随排泄物排出[3]。农村地区受经济和技术的双重限制, 大量的禽畜养殖废水不经处理直接排放或处理后尾水中含量仍超过相应排放标准, 因而重金属和抗生素在水环境中普遍存在。水环境中的重金属和抗生素具有一定稳定性, 复合污染也影响污染物的环境行为和生态毒性, 使污染治理工作面临巨大挑战[4—6]。
N、P、COD与水体富营养化密切相关, 一直是养殖尾水中备受关注的污染物[7]。水体富营养化本质上是水环境物质与能量的动态输入与输出的不平衡, 影响水环境与外部的物质能量交换, 使水体溶解氧含量降低, 不利于水生生物的生长和繁殖,导致水生生物的多样性降低[8]。人工湿地作为一种成本低、效果稳定、景观性高、运行维护简单的废水深度处理技术, 可以通过微生物转化、植物吸收和基质吸附高效去除废水中的N、P和COD, 在禽畜养殖尾水治理中已广泛应用。Li等[9]用人工湿地处理养殖场废水, 发现微生物作用是氮去除的主因, 而微生物的作用受到环境因子的影响。除传统污染物外, 禽畜养殖尾水也是重金属、抗生素等新兴污染物的重要污染来源之一。禽畜养殖废水中的重金属主要是Cu、Zn和Cd等, 抗生素以磺胺类、喹诺酮类和四环素类为主, 因此目前的研究也主要集中在这些污染物的去除上。Almeida等[10]采用芦苇构建人工湿地去除禽畜养殖废水, 发现人工湿地去除重金属的同时高效去除了常规污染物, 但长期运行后去除效果明显下降。黄翔峰等[11]用人工湿地处理禽畜养殖废水中的常规污染物和抗生素, 发现人工湿地对N、TP、COD和磺胺类抗生素都有较好的去除效果, 且适当提高水力停留时间能显著提高N和SMZ的去除效果。大量研究表明人工湿地具有高效去除养殖尾水中常规污染物和新兴污染物的潜力, 但共存的高浓度的重金属和抗生素可能对人工湿地污染物去除能力产生一定影响[12,13]。目前对于人工湿地同步处理养殖尾水中常规污染物和重金属、抗生素的研究较少, 明确重金属和抗生素胁迫对人工湿地净化能力的影响对于人工湿地的应用具有重要指导意义。
因此, 本文综合考虑养殖尾水中重金属和抗生素的检出情况和毒性效应, 以Cu和SMZ为例, 模拟不同水平的重金属-抗生素复合污染, 构建了5组小试垂直流人工湿地, 验证其净化性能, 探讨复合污染对人工湿地污水处理效果的影响, 以期为应用人工湿地同步处理禽畜养殖尾水中的常规污染物、重金属和抗生素提供理论支撑。
1 材料与方法
1.1 实验装置与方法
本研究采用垂直流人工湿地, 用聚氯乙烯材料搭建5组长×宽×高为40 cm×20 cm×100 cm小试装置, 分别记为A、B、C、D和E, 每组设置两个重复,湿地构造见图1。湿地从下至上分别为排水层(砾石, 粒径20—40 mm, 厚度0.2 m)、隔板(长×宽40 cm×20 cm, 厚度5 mm)和填料层(陶粒, 2—4 mm, 厚度0.5 m), 每个装置内种植两棵株高50 cm左右的美人蕉, 底部和距底部45 cm处各设一个出水口。

图1 人工湿地示意图Fig.1 Illustration of constructed wetlands
湿地进水为人工配制的模拟养殖尾水, 使用葡萄糖、KH2PO4、NaNO3、NH4Cl、C10N3O3SH11和CuCl2作为污染物添加源, 进水水质见表1, 水力停留时间为7d, 单次进水量20 L。A组为空白, 仅添加常规污染物, B—E组在A组基础上添加不同浓度的Cu和SMZ。此外, 各组还需添加植物生长必需的Mg和Ca, 添加形式及浓度为MgSO4(6 mg/L)和CaCl2(2 mg/L)。实验自2021年5月22日开始, 湿地驯化约2个月, 正式实验于2021年7月27日开始, 运行12个周期。

表1 人工湿地进水水质Tab.1 Influent water quality of constructed wetlands
1.2 常规水质指标测定
湿地运行期间, 每7天取各组进水和出水测定理化指标和常规水质指标。理化指标包括水体温度(Water temperature, W-temp)、溶解氧(Dissolved Oxygen, DO)、pH、盐度(Salinity, Sal)和氧化还原电位(Oxidation-Reduction Potential, ORP), 使用便携式水质分析仪(哈希HQ30D)现场测定。常规水质指标包括硝态氮(Nitrate Nitrogen,)、NH3-N、亚硝态氮(Nitrite Nitrogen,)、TN、总磷(Total Phosphorus, TP)和COD。水样用100 mL聚氯乙烯瓶盛装, 取样后迅速带回实验室于4℃ 冰箱中冷藏保存, 12h内完成处理和测定。测定采用紫外分光光度法, NH3-N测定采用纳氏试剂分光光度法,测定采用N-1-萘基-乙二胺分光光度法, TN测定采用碱性过硫酸钾-紫外分光光度法, TP测定采用钼酸铵分光光度法, COD测定采用重铬酸钾法。
1.3 水样铜和磺胺甲唑测定
为确定人工湿地同步去除重金属和抗生素的效果, 取第1、第4、第8、第12周进出水测定Cu和SMZ浓度。水样中目标物的前处理及测定方法如下:
铜的处理及测定: 出水Cu的前处理及测定依据中华人民共和国水质监测标准(GB7475-87)。水样用100 mL聚氯乙烯采样瓶收集, 取样后迅速带回实验室, 用稀硝酸(优级纯)调节pH至1—2, 处理好后于4℃下冷藏, 用火焰原子吸收光谱仪(Agilent 280 FS AA)测定。测试过程中每测50个样品后校正一次标线。
磺胺甲唑的处理及测定: 水样用500 mL聚氯乙烯采样瓶采集, 取样后立即带回实验室于4℃下避光冷藏保存, 24h内完成前处理, 用高效液相色谱仪(Agilent 1100 Series, 5 μm, 4.6 mm×250 mm)测定SMZ浓度。样品的前处理步骤为: 水样经0.7 μm玻璃纤维滤膜过滤, 按0.5 g/L标准加入适量Na4EDTA后混匀, 用乙酸调节pH至3±0.02; 过HLB小柱(Waters, 3 mL, 120 mg), HLB小柱依次用 6 mL甲醇、6 mL去离子水活化, 重复两次; 将处理好的水样过柱, 流速控制为10 mL/min; 用5 mL色谱纯甲醇淋洗固相萃取柱, 重复两次; 将洗脱液置于可视化恒温氮吹仪(NK200-1B, 杭州米欧仪器有限公司)中, 在40℃下吹干; 加1 mL色谱纯甲醇于氮吹管中, 涡旋振荡2min, 用0.22 μm有机尼龙滤头过滤后转移至棕色色谱进样瓶中, 于-20℃下冷冻保存, 待测, 方法回收率为82%—97%。色谱检测条件: 柱温25℃,进样量20 μL, 检测波长278 nm, 流动相A为0.01%乙酸, 流动相B为乙腈, A∶B=75∶25, 流速1 mL/min。方法检出限为50 μg/L。
1.4 植物的处理及测定
湿地运行结束后立即收割所有植物, 现场记录植物根长、株高和分蘖数, 将植物分为地上部分和地下部分, 分别测定两部分湿重和干重。
1.5 微生物样品的处理及检测
湿地正式运行第7、第84天取植物根系基质,于-84℃冷冻保存, 湿地运行结束后统一进行高通量测序。采用 E.Z.N.A.®soil DNA kit试剂盒(Omega Bio-tek, Norcross, GA, U.S)进行微生物群落总基因组DNA抽提, 纯化后使用正向引物338F(5′-ACTCC TACGGGAGGGAGCA-3′)和反向引物806R(5′-GGAC TAGHVGGGTWTCTAAT-3′)对细菌16S rDNA基因的V3-V4高突变区进行PCR扩增, 利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, Union City, CA, USA) 进行回收产物纯化, 使用NEXTFLEX Rapid DNA-Seq Kit对纯化后的PCR产物进行建库, 细菌多样性检测委托美吉生物公司完成。
1.6 数据分析
取各平行处理组的平均值, 用单因素方差分析检验五组出水理化指标和差异, 显著性水平为设定为P<0.05。用多重比较检验处理组两两的差异性,数据分析在SPSS 22中进行。实验数据用Excel 2019记录整理, 微生物数据在美吉生物云平台完成分析, 用Origin 2022进行图表绘制。
2 结果
2.1 污染物整体去除效果
从出水的理化指标看(表2), 不同处理组出水SAL和pH较为稳定, 差异不大, 但添加Cu或Cu-SMZ的组别水体中的溶解氧含量处于一个不稳定的状态, 波动变大, 总体上E组DO和ORP都较A组和B组低。

表2 出水理化指标Tab.2 Physical-chemical characteristics of the effluent
由图2可知, 湿地运行期间各组常规污染物的去除效果总体较好。A、B、C、D、E组TP平均去除率依次为90.29%、90.88%、89.94%、88.98%和89.78%, COD平均去除率依次为94.87%、93.89%、94.22%、93.29%和92.58%, NH3-N平均去除率依次为81.75%、87.59%、79.50%、74.45%和65.41%,-N平均去除率依次为98.94%、96.17%、99.04%、99.58%和99.52%, TN去除率依次为81.59%、87.63%、80.82%、74.15%和67.56%。A、B、C组与D组和E组NH3-N和TN平均去除率存在极显著差异(P<0.01)。
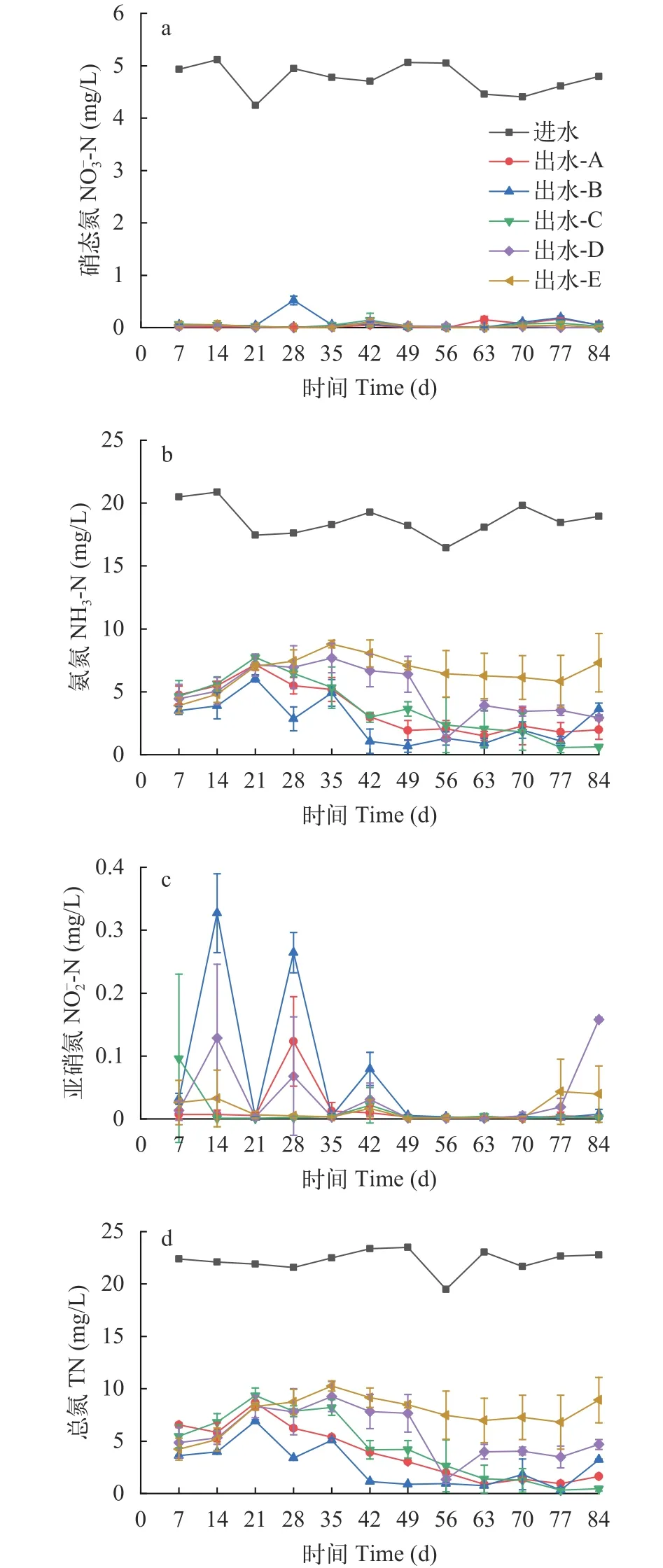
图3 各组进出水氮浓度Fig.3 The influent and effluent concentration of N of different groups
氨氮的去除效果是衡量人工湿地净化能力强弱的重要指标。湿地运行期间各组NH3-N去除效果表现为B>A>C>D>E, 各组系统出水NH3-N浓度在0.28—9.00 mg/L波动, 平均浓度依次为3.55、2.65、3.66、4.96和6.59 mg/L。B组NH3-N出水浓度较A组低, C组NH3-N出水浓度与A组相近但较B组高。当Cu添加浓度增加至20 mg/L时, 两个实验组NH3-N出水浓度均高于A组和B组, B组和C组、D组和E组出水NH3-N出水浓度差别较为明显。前3周各组NH3-N出水浓度呈现一致的上升趋势, 第四周开始A、B、C组NH3-N出水浓度开始下降, 而D组和E组NH3-N出水浓度仍旧上升。
各组出水TP浓度为0.03—0.54 mg/L, 平均出水浓度依次为0.20、0.19、0.21、0.19和0.18 mg/L。图4展示了不同组TP的去除情况, 总体上看, 后期人工湿地的TP净化效果略优于前期。湿地运行前5周A、B、C组的TP效果较D组和E组好, 第6周情况开始转变, 并在后4周转变为D组和E组去除效果优于A组和B组。第4周时TP出水浓度波动较大, B组出水浓度0.54 mg/L明显高于D组0.41 mg/L和E组0.22 mg/L, 除此外TP去除效果基本平稳。

图4 各组进出水总磷浓度Fig.4 The influent and effluent concentration of TP of different groups
实验期间出水COD浓度最高达到40.38 mg/L,各组出水COD平均浓度依次为9.67、11.82、10.76、13.80 和10.38 mg/L, 未出现显著性差异。由图5可知, 前8周COD出水浓度总体平稳, 之后4周出水COD浓度高于前期, 但组间差异仍不显著。

图5 各组进出水COD浓度Fig.5 The influent and effluent concentration of COD of different groups
各组进出水Cu和SMZ浓度见表3, 湿地处理后Cu和SMZ浓度均出现了数量级的下降。就Cu而言,D组和E组出水浓度总体高于B组和C组, 大部分取样时间B组和C组、D组和E组之间出水浓度无显著性差异, 湿地运行期间, 各组出水Cu浓度均处于较低水平。前3次出水基本无法检出SMZ, 第12周时C、D、E组均检出SMZ且检出浓度较前期高, 但总体去除率仍达到99%, 人工湿地对Cu和SMZ具有较好的去除效果。

表3 进出水Cu和SMZ浓度Tab.3 The concentration of Cu and SMZ in influent and effluent in wetlands
2.2 不同复合污染水平下植物生理指标变化
测量了不同处理组植物的根长、株高、分蘖数和含水量等指标(表4), C、D和E组植物株高分别较A组下降了13.31%、32.37%和28.97%, 地上部分干重和地下部分干重分别下降了20.24%、39.22%、34.36%和22.22%、30.58%、30.64%, 复合污染对美人蕉的株高和生物量产生了明显的抑制作用, 根的形态变化极为明显(图6)。

图6 各组美人蕉根部图Fig.6 The roots of canna in different groups

表4 各组植物生理指标Tab.4 Physical characteristics of the plants in different groups
2.3 不同复合污染水平下微生物群落结构特征
取各组不同时期的湿地基质进行高通量测序,基于纲水平分类的结果显示, 第7天时共有10个纲相对丰度超过1%(图7a), 其中γ-变形菌纲(Gammaproteobacteria)、芽孢杆菌纲(Bacilli)、脱硫单胞菌纲(Desulfuromonadia)和α-变形菌纲(Alphaproteobacteria)占优势地位。5个组中Gammaproteobacteria相对丰度依次为30.38%、55.97%、62.02%、42.88%和69.86%; Bacilli相对丰度依次为28.09%、10.37%、4.32%、30.14%和12.49%; Desulfuromonadia相对丰度依次为20.40%、11.16%、7.83%、5.17%和6.71%; Alphaproteobacteria相对丰度依次为4.34%、4.04%、4.69%、9.38%和5.77%。添加2 mg/L Cu后, B组Gammaproteobacteria相对丰度增加了84.23%, 同时添加2 mg/L Cu和5 mg/L SMZ时C组Gammaproteobacteria平均相对丰度较A组增加了104.15%, 较B组增加了10.79%。当Cu浓度变为20 mg/L时, D组Gammaproteobacteria平均相对丰度较B组下降了23.41%, 但仍高于A组, E组相对丰度最高。添加2 mg/L Cu后, Bacilli相对丰度下降了63.28%, C组平均相对丰度较B组下降了58.29%, 较A组下降了102.94%。当Cu浓度增加至20 mg/L时,D组Bacilli平均相对丰度明显高于B组和C组, E组平均相对丰度较C组高189.12%, 较D组低58.56。Desulfuromonadia和Gammaproteobacteria相对丰度也出现了较为明显的变化。第84天共有29个纲相对丰度超过1%。
基于Brary-Curtis多样性距离矩阵对微生物相对丰度前30的属进行聚类分析, 使用非加权组平均法计算构建树状结构, 按照98%的同源性获得群落结构相似度树状图。图7b反映了不同实验组之间微生物群落结构的相似性及相对丰度大小, 复合污染组与单一组和空白组相似性较低, 无Cu或低浓度Cu添加组、高浓度Cu添加组具有较高的相似性。

图7 细菌群落分析Fig.7 Microbial community analysis
3 讨论
3.1 不同复合污染水平下人工湿地净化能力比较分析
在一般情况下, 微生物转化和植物吸收是人工湿地系统中氮和有机物去除的主要途径。在本实验中, 不同复合污染水平下人工湿地对常规污染物仍具有较高的去除率和较为稳定的去除效果。复合污染的影响主要体现在NH3-N和TN的去除上。2 mg/L的Cu对NH3-N和TN的去除表现为促进作用, 加入SMZ后则表现为抑制作用, 且污染物浓度越高抑制作用越强烈。刘爱菊等[14]用不同浓度的Cu(0、100和500 mg/kg)和磺胺甲基嘧啶(0、5、25、50和100 mg/kg)对土壤微生物进行处理,发现与单一SMZ污染相比, Cu的复合污染对土壤的硝化潜势产生了显著的抑制作用, 进而影响了氮的转化与去除, 且这种抑制作用与污染物浓度紧密相关, 与本研究结果一致。赵伟等[15]用水平潜流人工湿地处理养殖废水中的四环素(TC)和Cu也得出了同样的结论, 说明这很可能是这类型污染的共性, 即重金属-抗生素复合污染会抑制人工湿地对TN和NH3-N的去除。在本实验中, 各组出水氮主要以NH3-N形式存在, 所占比例为86.73%—100%, 各组TN去除效果的差异可能主要受NH3-N去除结果的影响。
硝化细菌转化和水生植物的吸收利用是水体中氨氮去除的两个主要途径, 湿地基质虽然对氨氮有一定吸附作用, 但整体贡献率并不高[16,17]。硝化细菌和反硝化细菌的活性在很大程度上受溶解氧、温度和pH的影响[18]。湿地处于好氧状态时, 硝化细菌先通过硝化作用将污水中的氨氮转化为硝酸盐或者亚硝酸盐, 在厌氧且存在有机碳源时, 通过反硝化细菌的反硝化作用, 进一步将硝酸盐还原为N2, 实现氮的彻底去除[19]。王伟等[20]发现DO浓度低于1.6 mg/L时硝化细菌的作用就明显被抑制。张树兰等[21]发现温度为30℃时土壤硝化细菌活性较强, 20℃时硝化作用延缓, 40℃时硝化作用显著被抑制。张志等[22]发现pH 8.0—9.0内好氧微生物对NH3-N去除率都可以达到95%。本实验中温度较为稳定, pH处于相对适宜的区间, 复合污染组不稳定的溶解氧状态是氨氮去除率低的重要原因之一。前3周各系统内均有不同程度的积累,说明氮的转化不彻底, 这也在一定程度上说明NH3-N的硝化过程受到了抑制。
对于Cu和SMZ, 不同污染物体系中SMZ的主要去除方式可能不同, 杜露[23]认为微生物降解是人工湿地中磺胺类抗生素去除的主要途径, 刘琳等[24]的研究则表明基质吸附占比更高。重金属无法被微生物降解, 目前的研究普遍认为基质吸附是人工湿地去除Cu的主要途径[25,26]。在复合体系中, 污染物与污染物之间、污染物与湿地组分之间存在复杂的作用, 使得Cu和SMZ的去除具有很多不确定性, 有待进一步深入研究。
3.2 不同复合污染水平下植物生理指标差异分析
湿地植物可以直接吸收转移污水中的污染物,也可以通过根系向水中分泌氨基酸、糖、内源激素和酶等代谢产物, 加速重金属和抗生素去除的同时为根系微生物提供碳源, 维持其代谢活性。此外,植物也可以通过根系向水体释放氧气, 形成氧化层,构建氧化微环境, 利于湿地中有机物的氧化分解和脱氮反应。根际氧化量的多少直接影响人工湿地氮的去除, 一般植物根系生物量越高输送的氧气越多, 根系氧化层越高, 硝化反应越容易进行[27],SMZ和Cu复合污染可以通过影响湿地植物的生长状态间接影响氨氮去除[28]。在本研究中, 同时添加Cu和SMZ后, C、D和E组植物地下部分干重分别较A组下降了22.22%、30.58%和30.64%, 复合污染对美人蕉的地下部分生物量产生了明显的抑制作用,复合污染对植物的毒害作用也是影响氨氮去除的原因之一。
3.3 不同复合污染组微生物群落结构差异分析
在复合体系中, 微生物群落的变化是重金属和抗生素共同作用的结果[29]。在Cu添加浓度不超过2 mg/L的3组中, A组和B组相似性较高, 说明单独添加低浓度Cu对湿地微生物群落结构影响不明显,但添加SMZ后, 群落微生物群落结构发生了较大变化, 复合污染对微生物的作用较为显著。添加20 mg/L Cu的3组中, 微生物按SMZ添加的浓度聚为了两个小类。总体上来看, 高浓度Cu对微生物的影响较SMZ大。Gammaproteobacteria和Alphaproteobacteria中含有较多的反硝化细菌, 他们的广泛存在利于硝酸盐和亚硝酸盐的去除。在属水平上, 添加高浓度Cu和SMZ的组中脱氮单胞菌属(Denitratisoma)、Actinotalea和红杆菌属(Rhodobacte)具有较大的优势,Denitratisoma是典型的厌氧反硝化菌, 和厌氧氨氧化细菌之间存在一定的协同效应,Actinotalea和Rhodobacter是重要的有机物降解菌, 它们的广泛存在是人工湿地氮去除能力的保障[30,31]。在复合污染组尤其是高浓度复合组中,Propionicicella和Bacillus出现了较为明显的下降,Propionicicella和Bacillus都是N去除的关键细菌, 这可能是复合组NH3-N和TN去除率的下降的另一个原因[32—35]。
4 结论
目前应用人工湿地技术同步处理养殖尾水中常规污染物和重金属、抗生素的研究较少, 本研究以Cu和SMZ为切入点, 设计了5组小试垂直流人工湿地模拟处理不同重金属-抗生素复合水平的养殖尾水, 发现: (1)不同复合污染水平下人工湿地对模拟禽畜养殖尾水中的N、P、COD、Cu和SMZ都具有较高的去除率和较为稳定的去除效果, 各组各污染物平均去除率均达到99%。复合污染的影响主要体现在NH3-N和TN的去除上, 添加不同浓度Cu和SMZ后, 各组NH3-N平均去除率依次为81.75%、87.59%、79.50%、74.45%和65.41%, TN平均去除率依次为81.59%、87.63%、80.82%、74.15%和67.56%, 2 mg/L的Cu对NH3-N和TN的去除表现为促进作用, 加入SMZ后则表现为抑制作用, 且污染物浓度越高抑制作用越强烈。(2)复合污染可能通过影响湿地植物状态间接影响NH3-N和TN的去除。高浓度的Cu-SMZ复合污染对美人蕉的生长产生了负面影响, 主要体现在株高和根的生物量上,C、D和E组植物株高分别较A组下降了13.31%、32.37%和28.97%, 地上部分干重和地下部分干重分别下降了20.24%、39.22%、34.36%和22.22%、30.58%、30.64%, Cu浓度较高时美人蕉的根形态变化尤为明显。(3)复合污染通过影响微生物群落结构直接影响NH3-N和TN的去除。复合污染对微生物具有选择作用, 使对Cu和SMZ敏感的微生物相对丰度降低, 其中包括一些在氮去除过程中具有重要作用的微生物, 比如Propionicicella和Bacillus。
明确重金属和抗生素胁迫对人工湿地的影响对于人工湿地技术的应用和性能优化具有重要指导意义。本文初步阐明了复合污染对人工湿地净化能力的影响, 而Cu和SMZ在人工湿地中的相互作用及主要去除机理尚不明确, 有待进一步研究。
