以RAS固体废弃物为碳源的改进型人工湿地对养殖尾水的脱氮效果
2022-10-25曹涛涛白国梁陈迪松吴振斌
曹涛涛 徐 栋 白国梁 胡 泽 陈迪松 吴振斌
(1.中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072; 2.中国科学院大学, 北京 100049; 3.武汉市生态环境科技中心, 武汉 430015; 4.中国地质大学环境学院, 武汉 430074)
人工湿地是模拟自然湿地系统设计和建造的污水处理系统, 旨在利用湿地中植物、填料及微生物的共同作用去除废水中的氮磷等污染物[1]。因其具有成本低、环境友好等优点已被广泛应用于养殖尾水的处理。在人工湿地中微生物的硝化反硝化作用对脱氮的贡献最大, 且反硝化作用是其实现TN去除的主要微生物机制[2]。但是含有高浓度颗粒物的废水直接进入人工湿地易造成人工湿地堵塞[3], 而且对于低碳高氮的污水, 碳源不足通常会限制其整体脱氮效果[4]。目前, 人工湿地碳源补充方式有: (1)投加甲醇、葡萄糖和乙酸钠等, 可以显著提高人工湿地的脱氮性能, 但也存在着碳源的冲击负荷大易引起二次污染及成本高昂的缺点[5—7];(2)农业固体废弃物如玉米芯、稻壳、稻草和木屑等, 具有来源广泛、成本低廉、缓慢释放的特点,但是也会产生二次污染的问题, 还可能引起湿地堵塞[8]; (3)人工合成的可降解聚合物如聚乳酸等, 具有稳定释放的特点, 但成本也相对较高[9]。
循环水养殖系统(Recirculating Aquaculture System, RAS)为了满足养殖产品的生长需求, 通常保持较高的DO和较强的硝化作用, 长期运行会有硝酸盐的大量积累[10]。养殖期间还会产生大量由残饵、粪便等构成的固体废弃物, 粪便和残饵中通常含有大量未利用有机物和氮磷营养物质[11]。高氮低碳的养殖尾水和高营养的养殖固体废弃物如果不能妥善处理, 将对环境产生不利影响。已有研究尝试将残饵和粪便等固体废弃物经过发酵或水解的产物用作反硝化的补充碳源[12], 但是固体废弃物经过发酵或水解的产物中除了有机碳源外, 还含有大量的氮磷污染物, 提高了处理难度[13]。
本研究构建了一种改进型人工湿地, 通过在湿地下部营造局部厌氧环境, 促使水产养殖固体废弃物释放可利用的溶解性碳源, 在防止垂直潜流湿地堵塞的同时实现反硝化脱氮, 以期为人工湿地处理循环水养殖系统废物的工程实践提供理论指导。并利用高通量测序的方法, 对人工湿地微生物群落结构及脱氮功能微生物进行了分析。
1 材料与方法
1.1 实验材料
养殖固体废弃物收集自某养殖基地的循环水养殖系统。在实验室对高含水率的养殖固体废弃物进行混匀分装, -20℃冷冻保存。并对其组成进行了分析, 其主要成分为TS(23.5±2.2) mg/L、VS(564.3±7.9) mg/g、COD(38.5±16.5) g/L、TN(44.1±4.4) mg/g、TOC(343.0±29.5) mg/g和TP(45.6±1.0) mg/g。此外, 循环水养殖系统水质参数为TN 17.49 mg/L,16.61 mg/L, DO 7.13 mg/L。
1.2 湿地装置
为了在资源化利用养殖固体废弃物的同时实现对低碳氮比的循环水养殖尾水的反硝化脱氮, 本研究对人工湿地结构及流程进行了改进。模拟湿地系统构造如图1所示, 主要分为养殖固体废物厌氧水解区(A区)和湿地填料区(B区)两部分组成。A区位于湿地装置下部, 内径19 cm, 深度50 cm, 该区域填充数层低密度聚氨酯海绵作为微生物附着的基质, 同时防止颗粒物上浮进入湿地系统。B区位于厌氧水解区的上部, 内径20 cm, 自下而上依次填充了砾石、陶粒和石英砂, 并在湿地表面种植了红花美人蕉。本研究共构建5组设置了不同厌氧水解区深度的模拟人工湿地, CW1#(A区深度50 cm,容积14.5 L)、CW2#(A区深度30 cm, 容积9.3 L)、CW3#(A区深度15 cm, 容积4.7 L)、CW4#(A区深度0 cm)和CW5#(A区深度0 cm), 各组湿地装置B 区容积均在9.5 L左右。
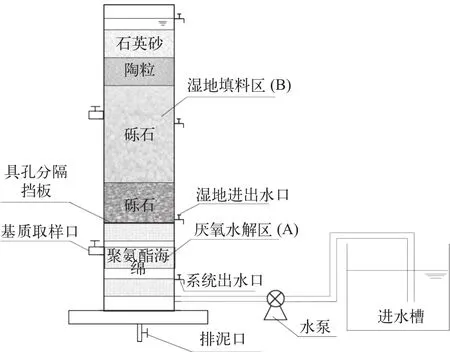
图1 实验装置图Fig.1 Schematic diagram of the experiment
1.3 装置运行
首先, 向系统内投加高营养废水, 并接种城市污水处理厂的厌氧污泥, 驯化运行1个月, 待模拟湿地系统运行稳定后开展实验。实验期间模拟湿地系统间歇运行, 5d一个周期。实验系统进水为模拟尾水, 其水质指标:18.0—20.0 mg/L,2.0 mg/L,0.05 mg/L, COD 2.5 mg/L, TP 1.0 mg/L, 参考所调查的循环水养殖系统的水质配制。通过逐步提升养殖固废弃物投加量, 逐步提高进水中C/N比, 以TCOD/TN计共分为3.09±0.90、5.33±0.39和8.78±0.41三个低、中、高C/N比阶段。
模拟人工湿地系统采取潮汐流的运行方式, 在每个运行周期, 对于设置了厌氧水解区的CW1#、CW2#和CW3#号装置, 首先通过蠕动泵将一定体积的模拟尾水泵入模拟人工湿地系统。然后将养殖固体废物与一定体积的模拟尾水混合后其泵入A区, 保持两次进水体积比为1∶1。在系统运行2d后, 将B区的水从湿地进出水口排入进水槽, 再泵入A区, 更换上下层水, 随后反应器继续运行3d。在一个周期结束后, 将反应器中的水从系统出水口排出。每运行5个周期, 对装置进行完全排空一次。对于未设置厌氧水解区的CW4#和CW5#号装置, 将模拟尾水和养殖固体废弃物混合后直接从湿地进出水口泵入湿地, 且每个周期的进水负荷及其他运行条件与CW1#、CW2#和CW3#号装置保持一致。模拟人工湿地系统自2021年6月19号开始, 在室温下(>20℃)驯化并运行共115d。
1.4 采样分析
在每个周期开始时采集模拟尾水、养殖固体废物与模拟尾水混合液, 结束时采集装置出水。通过测定养殖固体废物与模拟尾水混合液: 模拟尾水为1∶1的混合液得出系统整体的污染物浓度负荷。进出水中的、、、TN、TP和COD采用国家标准方法测定, TSS采用称重法测定[14]。DO、水温和pH用便携式多参数水质分析仪(YSI Professional Plus美国)现场测定。在第90天,湿地运行的后期, 采集A区和B区的填料样品, 用于微生物群落分析。对于装置CW1#、CW2#和CW3#分别设点采集下层厌氧A区和上层湿地填料B区的基质样品, 对于装置CW4#和CW5#设点采集湿地填料区的基质样品, 并置于无菌袋中, 在 4℃下保存运输到实验室, 随后样品放于-80℃冰箱保存待测。模拟人工湿地装置CW1#、CW2#和CW3#下层厌氧A区样品分别记为CW1#-L、CW2#-L和CW3#-L, 上层湿地填料B区样品分别记为CW1#-U、CW2#-U和CW3#-U, 装置CW4#和CW5#湿地填料区的基质样品记为CW4#-U和CW5#-U。
1.5 DNA 提取、高通量测序及数据分析
模拟湿地系统基质样品中的 DNA 使用TGuide S96磁珠法土壤/粪便基因组DNA提取试剂盒完提取[天根生化科技(北京)有限公司, DP812]。使用酶标仪(GeneCompang Limited, synergy HTX)对提取的核酸进行浓度检测, 检测合格后进行扩增, 并对扩增后PCR产物使用浓度1.8%的琼脂糖凝胶电泳检测其完整性(北京博美富鑫科技有限公司)。本研究选择16S rDNA V3+V4 可变区片段进行PCR扩增, 引物序列为341F(5′-CCTACGGGNGGCWG CAG-3′)和805R(5′- GACTACHVGGGTATCTAA TCC-3′)。扩增后PCR产物经纯化、定量和均一化形成测序文库, 建好的文库随后用Qsep-400方法进行质检, 最后由青岛百迈客生物科技股份有限公司基于Illumina NovaSeq6000 (Novaseq6000, Illumina)平台进行高通量测序。在相似性阈值为97%的情况下对过滤后的优化序列进行聚类划分OTUs (可操作分类单元, Operational Taxonomic Units), 确定α-多样性指数, 使用 Origin 2021绘制图形, 利用R语言分析样本间微生物丰度差异。
2 结果
2.1 模拟湿地系统进出中水各形态N浓度及去除效果
图2显示了模拟湿地系统进水和出水N浓度变化, 图3显示了模拟湿地系统对N的去除效果变化。由图2a和图2d可知, 随着养殖固废弃物投加量的增大, 即进水中C/N比的逐步提升, 湿地系统进水中TN和浓度也逐步提升, TN浓度从(20.06±1.58) mg/L上升到(29.78±1.59) mg/L,浓度从(3.21±0.09)上升到(4.71±0.53) mg/L。由图2b和图2c可知, 湿地系统进水中浓度保持在19.0 mg/L左右,浓度在0.047—0.085 mg/L, 表明进水中TN浓度的提升主要由氨氮和有机氮贡献。
图2和图3结果表明, 各组实验装置在中低C/N阶段, 均出现了积累的现象; 在低C/N阶段, 还出现了养殖固体废弃物释放导致出水中浓度升高的现象; 在高C/N阶段, 出水中各形态的N浓度均明显下降,积累现象消失。在高C/N阶段, 但各组装置对TN和去除率分别为(80.72±11.16)%和(97.87±1.49)%; 对的去除率为(49.73±20.66)%, 对和去除效果仍有较大波动。总体而言, 对于5组实验装置, 随着C/N的提升, 出水中TN、和浓度逐渐下降, 系统对TN、和的去除率不断升高。
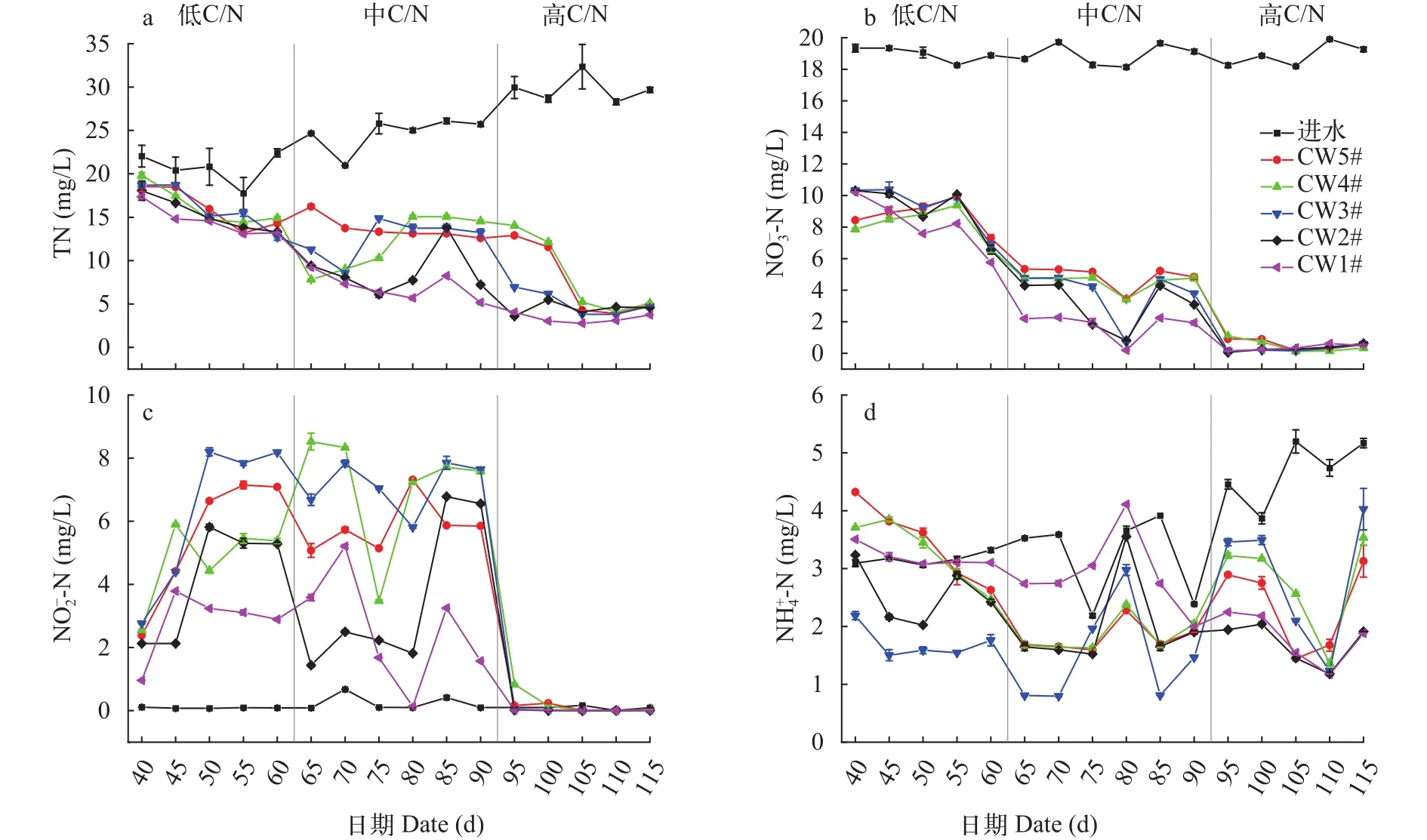
图2 模拟湿地系统进出水中各形态N浓度Fig.2 Concentrations of various forms of N in the influent and effluent of the simulated CWs

图3 模拟湿地系统对各形态N的去除率Fig.3 Removal rate of various forms of N in the effluent of the simulated CWs
由图4可知, 对于5组实验装置, 在以养殖固体废弃物为碳源时的中低C/N阶段, 装置CW1#、CW2#相比于CW3#、CW4#、CW5#, 出水中TN、和浓度均处于相对较低的水平; 进入到高C/N阶段, 装置CW1#、CW2#相比于CW3#、CW4#、CW5#, 出水中浓度也处于相对较低的水平。
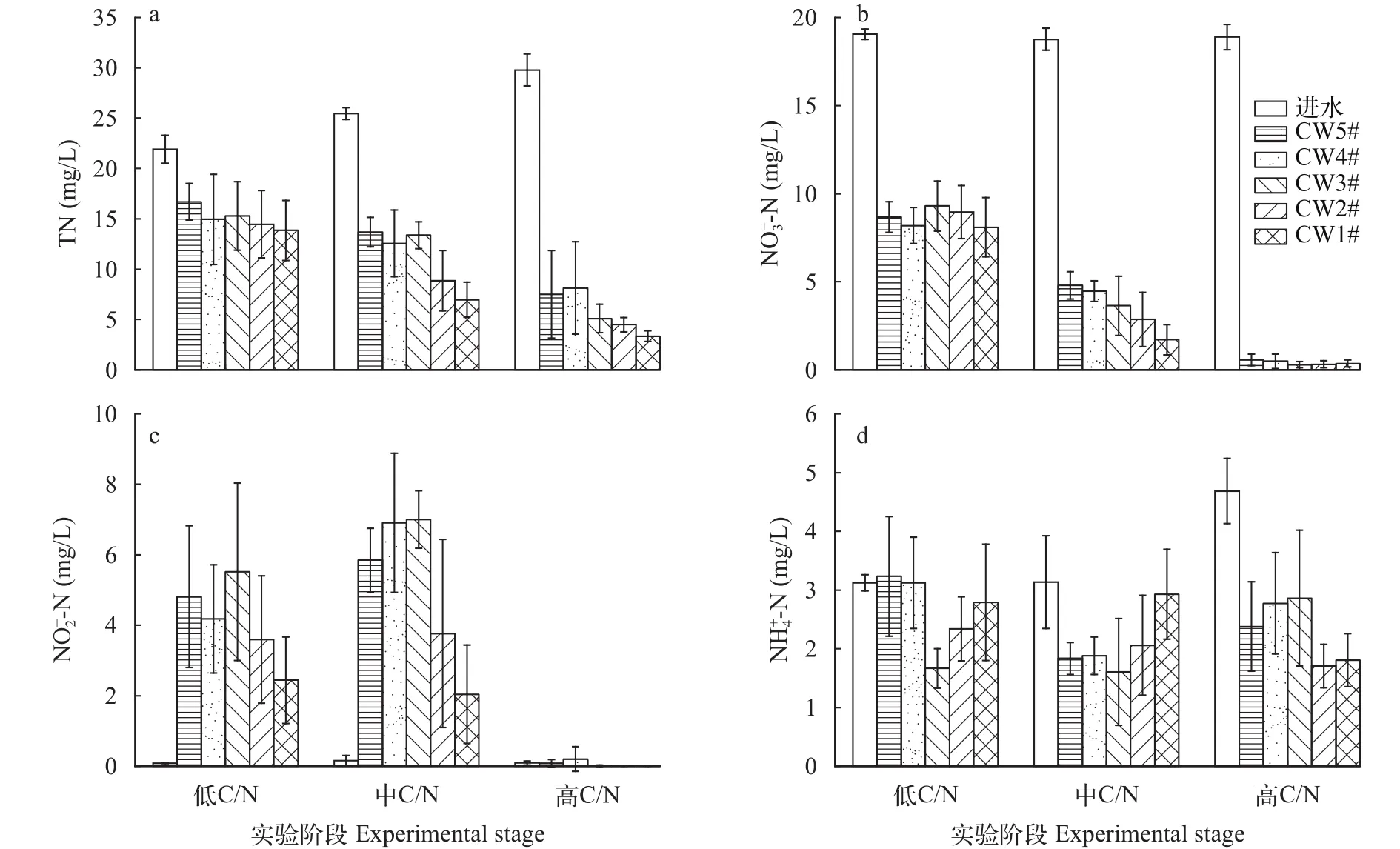
图4 湿地装置构型对进出水N浓度变化影响Fig.4 Influence of simulated CWs configuration on N concentration in influent and effluent
2.2 微生物群落多样性
本次实验8个样品测序共获得954322条高质量序列, 聚类划分后共产生706个OTUs (可操作分类单元, Operational Taxonomic Units)。模拟湿地系统A区和B区基质样品的α-多样性指数(Chao1、Shannon和Simpson多样性指数及Coverage指数)如表1所示。基质样品测序的样本文库覆盖度(Coverage指数)均大于0.999, 表明测序对样品覆盖度较高, 能较好地反映样本的真实情况。对于装置CW1#、CW2#和CW3#, B区的Chao1、Simpson和Shannon多样性指数分别在625.4—655.6、0.951—0.967和6.29—6.41, A区则分别为567.3—607.4、0.933—0.979和5.37—6.61, Chao1指数值越大说明物种数目越多, Shannon指数值越大、Simpson 指数值越小说明群落多样性越高, 可见A区物种数目略低于B区, A区和B区总体的群落多样性差异不明显。

表1 模拟湿地系统细菌群落丰富度和多样性分析Tab.1 Analysis of bacterial community abundance and diversity of simulated CWs
依据不同微生物样品的属水平组成, 对样品进行偏最小二乘判别法(PLS-DA, Partial Least Squares Discriminant Analysis)分析, 结果如图5所示。PLSDA通过寻找物种丰度矩阵和给定的样品分布/分组信息的最大协方差, 从而在新的低维坐标系中对样品重新排序, 坐标图上距离越近的样品, 相似性越大, 且可以减少变量间多重共线性产生的影响。从图5可以看出, A区样品CW1#-L、CW2#-L和CW3#-L更靠近且样品CW1#-L和CW2#-L距离更近;B区样品CW1#-U、CW2#-U和CW3#-U距离更靠近, CW4#-U和CW5#-U距离更靠近, 且设有厌氧水解区的装置和未设有该区的装置相比, 湿地填料区样品离散程度较大, 表明厌氧水解区的设立以及湿地系统整体深度的增加会对其上层湿地填料区微生物组成产生影响。

图5 微生物样品PLS-DA分析Fig.5 PLS-DA analysis of microbial samples
2.3 门属微生物群落组成
从图6可以看出, 在门水平上, 各湿地系统优势菌门为变形菌门(Proteobacteria), 其在各装置A区相对丰度在44.44%—62.87%, B区相对丰度在61.93%—78.64%; 丰度较高的还有绿弯菌门(Chloroflexi, 占比4.49%—23.45%)、拟杆菌门(Bacteroidetes, 占比3.69%—7.38%), 变形菌门(Proteobacteria)在装置CW1#、CW2#、CW3#、CW4#和CW5#中的B区有较高的丰度, 绿弯菌门则在装置CW1#、CW2#和CW3#的A区的丰度较高。髌骨细菌门(Patescibacteria)在装置CW1#和CW2#中有较高的丰度, 且在A区的丰度高于B区; 浮霉菌门(Planctomycetes)在装置CW1#A区有更高的丰度, 在装置CW2#和CW3#A也有相对B区较高的丰度; 厚壁菌门(Firmicutes)在各装置的B区有较高的丰度; 此外芽单胞菌门(Gemmatimonadetes)和酸杆菌门(Acidobacteria)在装置CW2#和CW3#中相对丰度较高, 疣微菌门(Verrucomicrobia)在装置CW4#和CW5#中相对丰度较高。

图6 模拟湿地系统门水平细菌组成Fig.6 Bacterial composition at the phylum levels of simulated CWs
由图7可知, 在属水平上,Silanimonas、Rivibacter、uncultured_f_A4b、uncultured_f_Burkholderiaceae和Rubrivivax等丰度相对较高。本次实验共发现40个氮代谢相关菌属, 其中有37个反硝化菌属,1个硝化菌属和 1 个未培养的厌氧氨氧化菌属, 表2列举了相对丰度相对较高的部分。对于各装置, 反硝化菌属丰度较高的为Silanimonas、Rivibacter、红杆菌属(Rhodobacter)。

表2 脱氮功能微生物菌群分析Tab.2 Analysis of microorganisms with denitrification function
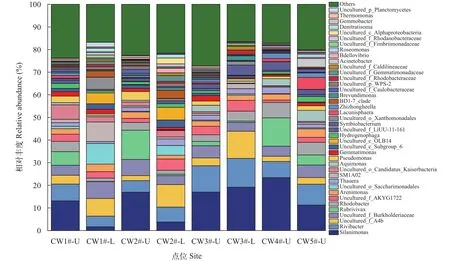
图7 模拟湿地系统属水平细菌组成Fig.7 Bacterial composition at the genus levels of simulated CWs
3 讨论
3.1 养殖固体废弃物投加对脱氮效果的影响
3.2 装置构型对脱氮效果的影响
本研究发现厌氧水解区深度为30和50 cm的改进型人工湿地脱氮效果更好。有研究表明人工湿地具有复杂的微环境, 硝化、反硝化和厌氧氨氧化过程均可能存在, 能实现对各形态氮的去除[18]。厌氧氨氧化是在厌氧条件下, 微生物以作为电子受体将氧化成N2, 实现了对和较好的去除效果[19]。在本研究中, 进水中较高浓度的有机物分解耗氧, 在湿地下部较深的厌氧水解区处形成相对严格厌缺氧环境, 加之湿地长期运行的驯化效果, 有利于A区发生厌氧氨氧化过程,从而强化了改进型人工湿地的脱氮效果。
3.3 模拟湿地系统中的微生物组成差异
从微生物门组成上看, 本研究中变形菌门(Proteobacteria)在B区的相对丰度较高, 有研究认为其是反硝化细菌的主要来源[20]。也有研究表明, 变形菌丰度与环境养分状况相关[21], 其对营养物质尤其是 N 的输入反应较为敏锐[22], 与氮循环、生物固氮作用密切相关[23]。绿弯菌门(Chloroflexi)和髌骨细菌门(Patescibacteria)在装置CW1#和CW2#的A区相对丰度较高, 二者通常参与厌氧发酵过程, 与有机物分解有关[24], 且髌骨细菌门(Patescibacteria)是在厌氧氨氧化反应器中经常观察到异养细菌[25]。厌氧氨氧化细菌则是属于浮霉菌门下浮霉菌门(Planctomycetes)的类群[26], 本研究中其在装置CW1#下层A区有较高的丰度, 在装置CW2#下层A区丰度也相对较高。
从微生物属水平上看, 对于设有厌氧水解区且深度相对较大的装置CW1#和CW2#, 反硝化菌属在湿地系统中分布情况较为类似, 且在两套装置湿地下层A区均发现了丰度相对较高的具有厌氧氨氧化功能的未培养菌属(uncultured_c_Anammox_3)和一种被认为有助于厌氧氨氧化过程的菌株SM1A02[27];装置CW3#、CW4#和CW5#相比于装置CW1#和CW2#, B区Silanimonas、Rivibacter和红杆菌属(Rhodobacter)的丰度更高。反硝化菌属相对总丰度在装置CW1#的B区和A区分别为45.05%和21.58%, 装置CW2#的B区和A区分别为53.18%和24.81%, 装置CW3#的B区和A区分别为46.26%和46.31%, 装置CW4#的B区为60.55%, 装置CW5#的B区为48.61%, 表明较小的厌氧水解区深度对反硝化菌丰度影响较小, 较大的厌氧水解区深度形成的厌氧条件会更严格, 厌氧区反硝化菌属总丰度也会降低。总体而言, 模拟人工湿地中脱氮菌群以具反硝化功能的菌群为主。
4 结论
(1)养殖固体废弃物的投加量增加会提升湿地进水中N负荷, 但随着碳氮比的提升和厌氧区深度的增加, 湿地系统对N的去除效果提升, 当进水TCOD/TN为8.78±0.41时, 且厌氧区深度为30和50 cm时, 模拟湿地系统对TN、和的去除效果较好, 人工湿地具有在资源化利用养殖固体废弃物的同时, 实现对循环水养殖系统氮负荷的削减的可能性。(2)模拟湿地系统中反硝化菌属丰度较高, 主要为Silanimonas属和Rivibacter属, 且湿地填料B区反硝化菌属相对丰度高于下层厌氧A区, A区还发现有未培养的厌氧氨氧化菌属(uncultured_c_Anammox_3)分布。改进型人工湿地在以养殖固体废弃物为碳源时, 主要通过反硝化作用脱氮, 且存在一定的厌氧氨氧化过程。
