深型复合垂直流人工湿地对模拟污水处理厂尾水中PBDEs的去除研究
2022-10-25高科技王亚芬
吴 佩 高科技 刘 涛 王亚芬,
(1.中国地质大学(武汉)环境学院, 武汉 430074; 2.湖北省水环境污染系统控制和治理工程技术研究中心, 武汉 430074)
多溴联苯醚(Polybrominated diphenyl ethers,PBDEs) 是一种结构类似于多氯联苯(Polychlorinated biphenyls, PCBs)的卤代芳香烃化合物, 因其优异的阻燃性能, 被广泛应用于纺织、塑料、聚氨酯泡沫和电子电器等一系列商业产品[1,2]。PBDEs具有致癌及内分泌干扰毒性、生物蓄积性和环境持久性的特点, 自20世纪70年代被引入市场后, 其在环境中的迁移与累积便引起世界各地的广泛关注[3]。国外报道关于PBDEs在沉积物中的污染浓度在0—564 ng/g[4—6], 且大多以BDE-47、99、209为主, 而水体中PBDEs污染浓度较低(9.2—168.8 ng/L)[7—9]。特别地, 在电子垃圾集散地附近受污染地表水体中浓度可高达890 ng/L[10]。污水处理厂作为城市污水和工业废水的重要水处理设施, 其常规处理工艺对PBDEs难以完全去除, 研究发现尾水中仍有52%—80%的PBDEs残留, 21%—45%则沉淀在剩余污泥中, 这就使得污水处理厂尾水与剩余污泥成为PBDEs潜在二次污染源[11]。
水体中PBDEs的去除技术主要有微生物降解[12]、零价铁法[13]、Fenton法[14]和光催化降解[15]等。其中, 非生物处理技术处理效率快, 但能耗高、可能对环境造成二次污染。人工湿地(Constructed Wetlands, CW)是由基质、植物和微生物组成的污水生态工程系统, 具有耗能低, 维护成本低廉, 净化效果好等优点, 在处理生活污水、养殖废水及湖泊河流生态修复等领域得以广泛应用。目前越来越多的研究开始将人工湿地对常规污染物的去除转向对难降解有机污染物去除的研究, 如多环芳烃(PAHs)[16]、抗生素[17]和有机农药[18]等。嵇斌等[19]使用人工湿地-微生物燃料(CW-MFC)耦合系统, 2个月内对有机氟化物(PFAs)的去除率高达96%。Wang等[20]利用红树林湿地模拟系统同步去除污水中复合难降解有机污染物PAHs和PBDEs, 经8个月的处理,PBDEs的总去除率在 51.3%—77.5%, 并受湿地淹水模式影响显著。Ma等[21]研究了污水处理尾水回灌地下水过程中 BDE-99 的迁移与生物转化过程,也发现其修复效果受系统回灌模式影响, 并与氮转化相关功能微生物菌属关系密切。但是, 不同湿地流态, 如复合垂直流人工湿地(IVCW)系统对PBDEs的去除效果还鲜有研究。
在209种PBDEs同系物中, 2’, 2’, 4’, 4’-四溴联苯醚(BDE-47)是各环境介质和人体中检测到的主要同系物之一, 其分布范围广、可来源于高溴代同系物的降解, 且毒性高于其他同系物, 近年来受到广泛研究[22]。因此, 本研究选取BDE-47为目标污染物, 构建了两套深型IVCW小试系统, 通过模拟污水处理厂低碳高硝氮尾水为进水, 在固定水力停留时间和水力负荷条件下, 分析测定系统对BDE-47的分段去除率, 并探讨了PBDEs加入对IVCW系统常规净化效果与基质微生物的影响。
1 实验装置与方法
1.1 IVCWs小试装置
复合垂直流人工湿地(IVCW)系统剖面见图1。该系统由4个柱状单元串联组成(总基质层高=180 cm),分别为CW1、CW2两组下行流和CW3、CW4两组上行流。为了方便采集湿地系统底层基质样品, 下行和上行流池分别被拆分为两个单元, 其中上下单元尺寸分别为0.16 m×0.16 m×0.7 m和0.16 m×0.16 m×0.5 m, 各单元由塑料软管相连接串联形成“U”型结构。距各单元底部5 cm处设置含若干直径为2 mm筛孔的隔板, 其上布置厚度为5 cm、直径1 cm的砾石层, 砾石层上再填充直径为2—4 mm的石英砂作为湿地主要基质, 上单元基质填充高度为50 cm, 下单元则设为40 cm。每个单元底部并联一个内含相同石英砂基质的小型外接装置(0.06 m×0.06 m×0.18 m), 用于在线富集基质生物膜。整套装置未种植植物, 仅以石英砂做基质以限制系统中有机碳来源。图中箭头为水流方向, 各个单元每隔20 cm设有直径为1.2 cm的取样口便于采集水样。
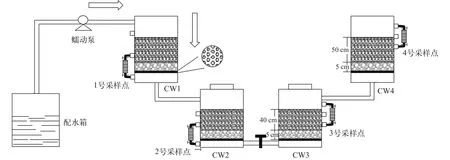
图1 IVCWs装置示意图Fig.1 Schematic diagram of IVCW systems
1.2 实验方法及参数
试验周期为2019年9月至2020年6月, 前期(2019年9—11月)为系统驯化阶段, 后期(2019年12月至2020年6月)为正式运行阶段, 整个实验均在中国地质大学(武汉)环境学院一楼实验室简易温棚内进行。开始进水时在所模拟低碳高硝氮污水中加入BDE-47, 对照组则不加, IVCWs装置运行时各水质指标参数见表1。
系统进水为人工配水, 所含BDE-47理论入流浓度为25 μg/L, 参考Ma等[23]关注污水处理厂尾水回灌过程中PBDEs的迁移与生物降解研究, 其余指标模拟市政污水处理厂尾水水质(C/N=2,-N/-N=6/1), 采用葡萄糖(COD)、磷酸二氢钾(TP)、硝酸钾(-N)、氯化铵(-N)配制, 具体参数如表1所示。为模拟自然潮汐流湿地, 采取脉冲式引入污水, 即由蠕动泵间歇式注入湿地, 进水3h后停留3h, 如此有利于营造湿地系统内干湿交替的多样微生境, 刺激好氧与厌氧代谢活性, 从而提高湿地净化效率[24]。进水由CW1单元进水口流入, CW4单元出水口流出, 其中出水口较进水口低5 cm。各单元中均为饱和流, 当采集湿地底层单元基质样品时, 打开顶部密封盖, 即可观察到两单元基质均低于水面, 基质处于饱水状态。本套IVCW柱状模拟系统的理论体积为36 L, 基质密度为1.8 g/cm3, 基质孔隙率为0.5, 设系统的水力停留时间(HRT)为3d, 计算得每日进水负荷(HLR)为0.3 m/d。系统正式运行持续时间6个月, 共计至少运行10个批次。每批次于上午8:30—10:00进行采样。
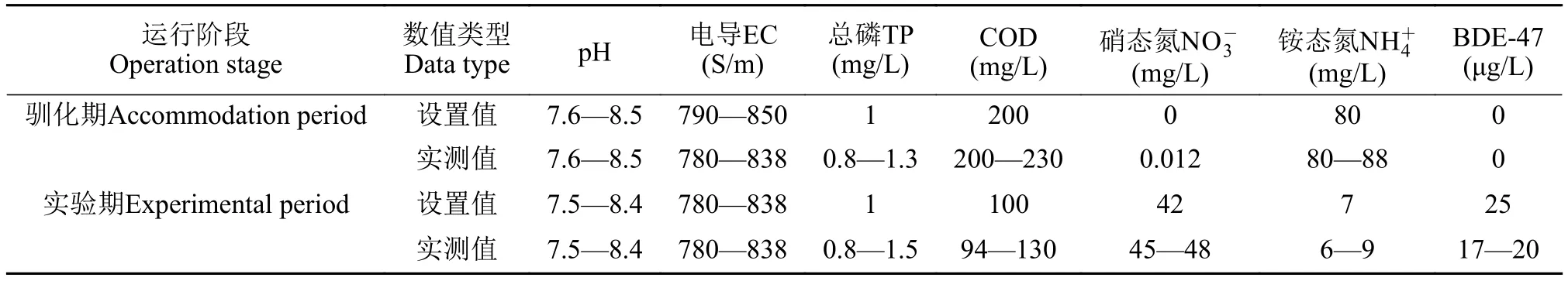
表1 实验进水水质指标Tab.1 Experimental influent water quality indices
1.3 样品采集
每批次于各单元出水口依次采集300 mL水样,其中50 mL保存至聚乙烯瓶用于常规水质指标的检测, 另外250 mL保存至棕色玻璃瓶, 用于检测水样中BDE-47含量。
在实验装置运行结束后, 采用基质采样器(不锈钢材质, 直径为2 cm, 管槽长10 cm, 每个管槽之间相隔10 cm)对不同处理单元基质样品进行采集,用于分析装置中BDE-47残留特征及微生物生长情况。每次于各单元中心1/2处取30 g石英砂基质, 5 g用于BDE-47的含量测定、5 g用于微生物脱氢酶含量的测定、5 g用于微生物脂肪酸组成分析, 剩余样品于-20℃冷藏贮存备用。此外, 由于下行流上单元距离入流较近, 且出水BDE-47含量较低, 为了更好了解BDE-47在装置中的残留特征, 故在此单元表层5 cm处多设置一个采样点, 并将此采样点命名为CW1#上。
1.4 分析方法
水样分析方法水样测定指标主要包括CODCr、硝态氮(-N)、氨氮(-N)及BDE-47, 分别采用重铬酸钾法[25]、紫外分光光度计法[26]、纳氏试剂分光光度法[27]和与电子捕获检测器相连的气相色谱仪(Agilent-7890C, GC-μECD)测定。采用规格6 mL/g的Florisil固相萃取柱(SPE)对水样中的BDE-47进行富集, 后用正己烷和二氯甲烷洗脱氮吹定容至2 mL GC瓶内上机分析。色谱柱: HP-5MS(30 m×0.25 mm×0.25 μm); 进样口温度300℃,模式为不分流进样, 载气流速1.5 mL/min; 升温程序: 初始温度从85℃开始, 保持5min, 后以18℃/min的速度上升到280℃, 保持10min, 最后以250℃保持25min。采用内标法(以PCB-141为内标)定量计算样品中BDE-47的浓度。
基质分析方法基质样品分析包括BDE-47含量、脱氢酶活性与微生物脂肪酸组成。基质BDE-47的前处理步骤为准确称取5.00 g石英砂于玻璃离心管, 加入5 mL正己烷溶液, 超声辅助提取(25℃, 15min), 重复萃取两次后, 离心(4000 r/min,5min)提取上清液, 氮吹定容至2 mL GC瓶内待上机分析。基质脱氢酶活性的测定准确称取新鲜石英砂基质5 g于15 mL带塞离心管中, 采用氯化三苯基四氮唑(TTC)比色法进行测定。基质微生物群落脂肪酸甲酯分析准确称取5.00 g石英砂基质样品于50 mL PECO塑料离心管中, 采用温和碱性甲酯化方法[28]对样品进行处理, 用配备火焰离子化检测器的气相色谱仪(Agilent 7890 GC-FID)进行脂肪酸分析, 以获得微生物群落的磷脂脂肪酸甲酯图谱。色谱柱:HP-5MS(0.25 mm×30 m×0.25 mm); 进样口温度为280℃, 模式为不分流进样, 载气流速0.8 mL/min; 升温程序: 初始温度80℃保持2min, 后以50℃/min升温速度升至150℃, 保持2min, 再以2.5℃/min的速度升至195℃, 保持4min, 最后用2.5℃/min的升温速度升至240℃, 保持5min, 整个过程持续38min。GCFID分析中使用26种细菌脂肪酸甲酯的混合标准溶液(Bacterial Acid Methyl Esters Mix, BAMEs, Supelco USA)作为标样进行定性和半定量分析。脂肪酸命名规则按照A:BωC[29]。
采用常见的指示主要微生物生理类群的特征脂肪酸标志物[30—32]对脂肪酸甲酯数据进行分析, 统计各组特征标志物相对含量的总和指示不同类群微生物相对丰度。同时利用3种常见特征脂肪酸比值指示特定微生物类群的相对丰度和生理状态: 反式/顺式(Trans/Cis)的比值常用来指示微生物在环境中受不利条件影响的状态[33]; 单不饱和脂肪酸/支链饱和脂肪酸(MUFA/Branched)的比值用于反映系统基质中好氧细菌与厌氧细菌的相对含量; (i15∶0+a15∶0)/16∶0在一定程度上可反映基质中细菌所占比例。
1.5 数据分析
利用Canoco 5.0统计软件对不同深度石英砂基质样品中微生物群落结构进行主成分分析, Pearson相关分析评价各参数的相关性。采用方差分析(ANOVA)进行显著性检验, 设置a=0.05为显著性水平,a=0.01为极显著性水平。
2 结果与讨论
2.1 IVCWs对BDE-47处理效果
经6个月处理, IVCW系统对人工污水中BDE-47的总去除率为99.9%, 且在下行流上单元(CW1)达到最高去除率(98.5%), 经上行流CW3单元后(基质进程约为120 cm), 去除率趋于稳定(图2A)。在实验结束后, 分析基质中BDE-47残留浓度, 发现随着基质深度的增加, BDE-47含量逐渐减少, 在距离入流最近的CW1单元表层(1#上)基质中BDE-47的含量(0.01 μg/g)是其下层(1#下0.003 μg/g)的3.3倍,是出水口CW4单元基质中含量(0.0002 μg/g)的50倍, 指示入流中大部分BDE-47首先被表层石英砂吸附截留(图2B)。
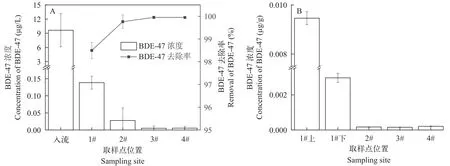
图2 IVCWs对BDE-47去除效果Fig.2 BDE-47 removal effect of IVCWs
已有研究表明吸附是污水处理过程中PBDEs去除的主要机制[34], 而Yan等[35]在土柱模拟实验中发现系统对回灌的污水处理厂尾水中BDE-99的去除效率高达96.8%, 但其中吸附仅占30.0%, 生物降解占66.8%。为初步评估湿地基质对BDE-47吸附去除的贡献, 我们通过吸附实验比较了石英砂基质与挂膜基质对BDE-47的吸附特征, 发现在1—10h内纯石英砂基质对BDE-47进行了快速吸附, 随后吸附速率趋于平缓, 大约在24h时达到动态平衡。随着BDE-47初始浓度增加, 石英砂基质对BDE-47的吸附量也在逐步增加, 当初始浓度达到20 μg/L时吸附达到平衡, 此时最大吸附量达到2.5 μg/g。采用挂生物膜的石英砂基质做吸附实验时发现其吸附规律与纯石英砂基质相似, 吸附量随着BDE-47初始浓度的增加而变大, 当初始浓度达到30 μg/L时, 挂膜石英砂基质对BDE-47最大吸附量为6.3 μg/g,明显高于纯石英砂基质, 表明基质生物膜的形成能够提高石英砂基质对BDE-47的吸附去除效果, 但由于基质中BDE-47含量分布存在较大空间异质性,无法进行精确的污染物物料平衡计算, 另本研究并未检测BDE-47的降解产物, 故基质微生物对BDE-47的生物降解去除贡献还需进一步探索。
2.2 IVCWs对常规水质指标处理效果
IVCWs对硝态氮、氨氮及COD的去除效果如图3所示。硝态氮()浓度沿程变化差异显著,随水流方向逐级降低, 其去除作用主要发生在下行流上层单元(CW1), 随着污水的进入, 碳源充足, 行至CW2时氧含量逐步降低, 此时反硝化作用减弱。而加入BDE-47的实验组中的总去除率为28.1%,显著低于对照组(53.0%), 说明BDE-47会影响微生物的脱氮过程(图3A)。BDE-47与同为异化微生物代谢中重要的末端电子受体, 当脱卤呼吸微生物利用BDE-47作为电子受体, 会同其他厌氧呼吸微生物竞争电子, 从而影响其他厌氧呼吸代谢过程如反硝化[36,37]。随着系统后端BDE-47浓度减小, 对的影响相应减弱。
不同于硝态氮, 无论装置内是否添加BDE-47,实验组与对照组的氨氮浓度沿程变化几乎无显著差异(图3B), 且随水流方向出现先下降后上升的现象, 主要的去除作用发生在湿地系统进水前端, 系统最终对氨氮的去除率达到82.9%(实验组)、72.3%(对照组)。实验组和对照组的2#、3#处理单元对氨氮的去除效果整体均低于1#、4#单元。原因可能是在装置上层单元所含溶解氧含量较高, 微生物含量丰富, 而后深层厌氧条件下微生物发生硝酸盐异化还原[38], 导致2#、3#单元出水氨氮含量小幅增加。随着基质层加深, 微生物不断消耗氧气致使溶解氧含量降低形成厌氧环境, 硝化反应减弱、氨氮去除能力变差, 但最后在出水单元中, 随着大气复氧, 氨氮去除率出现回升。
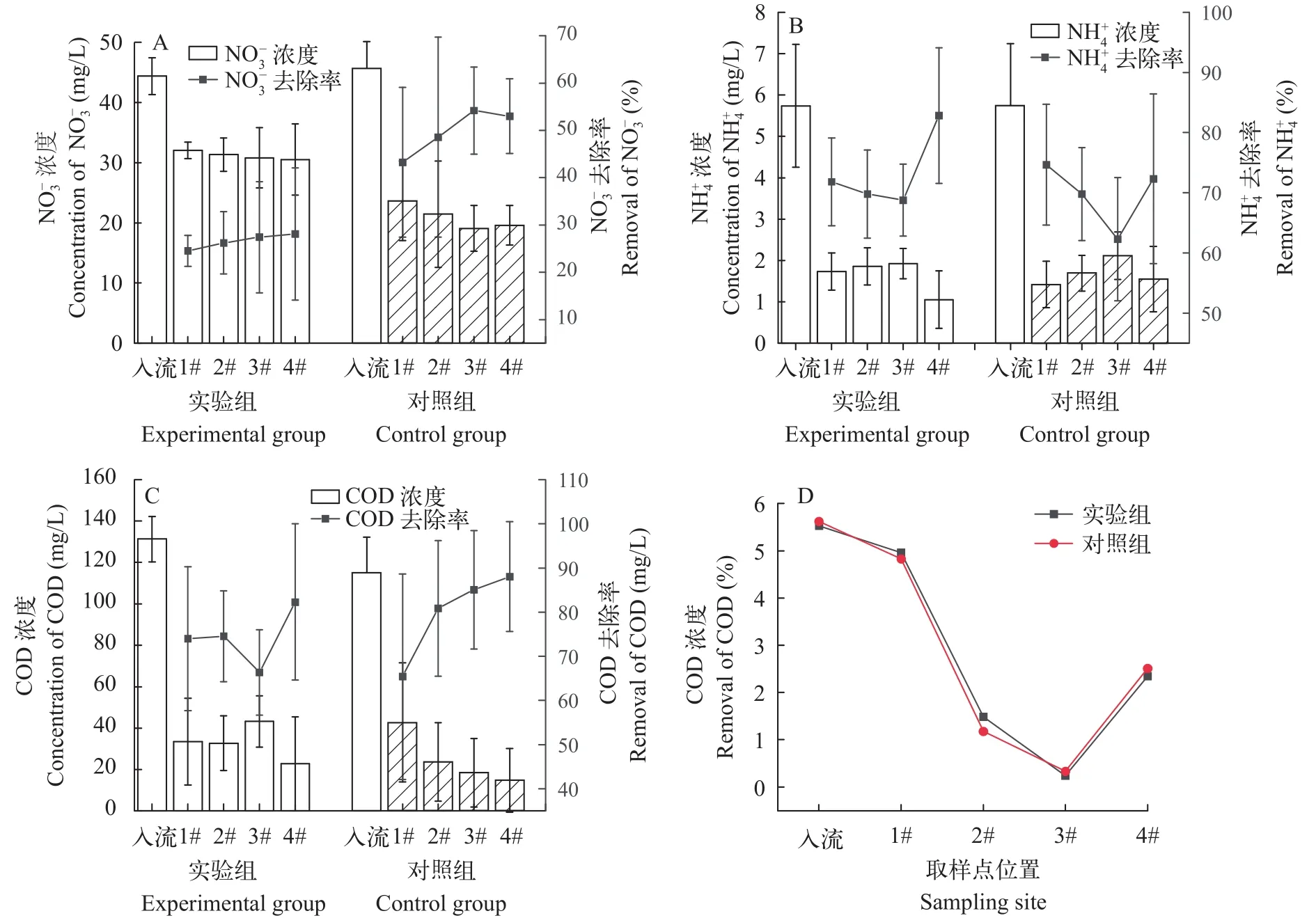
图3 IVCWs常规水质污染指标(n=5)与溶解氧含量的变化Fig.3 Variation of conventional water pollution indexes (n=5) and dissolved oxygen in IVCWs
2.3 IVCWs中微生物群落的变化
微生物活性脱氢酶作为湿地中常见的一种胞内酶, 常用于反映基质中微生物生物量大小[39]。为进一步探究IVCWs对BDE-47的净化机理, 将实验组与对照组装置中基质脱氢酶活性做对比。如图4所示, 整体而言加入BDE-47对脱氢酶活性有一定影响(P=0.086)。对照组基质中脱氢酶含量呈先增加后递减的变化规律, 在下行流下单元达最大值,而实验组中前端基质脱氢酶含量显著低于对照组,后段装置中脱氢酶活性水平却与对照组相当(图4A)。可能是因为前半部分湿地中有机质和氧含量较为充足, 适宜微生物生长, 随着后续营养物质及溶解氧的消耗, 微生物活性逐渐减弱。加入BDE-47后对湿地中微生物生长产生抑制作用, 导致酶活性显著降低, 随着系统后端BDE-47浓度的降低, 对微生物影响较小, 脱氢酶活性变化与对照组相当。外接装置中实验组与对照组基质脱氢酶活性均远低于原位基质取样结果, 且实验组与对照组间无明显差异, 无法代表其原位微生物状态(图4B)。
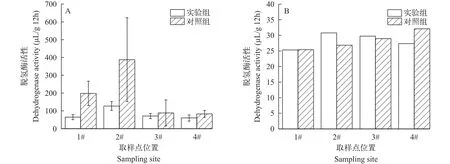
图4 基质脱氢酶活性特征Fig.4 Characteristics of dehydrogenase activity in substrate
特征脂肪酸分析从基质样品中共检测到26种微生物脂肪酸, 主要包括直链饱和脂肪酸(SSFA)、支链饱和脂肪酸(BSFA)、环丙烷脂肪酸(CFA)、多键不饱和脂肪酸(PUFA)、单键不饱和脂肪酸(MUFA)等(羟基脂肪酸(OHFA)响应斜率差未纳入组成图谱分析)。如图5A所示, 脂肪酸甲酯(FAMEs)组成图谱不论在实验组还是对照组, 在原位基质还是外接装置中微生物FAMEs组成均表现出一定的差异, 尤其在下行流下单元(2#)差异最大,但各类型脂肪酸变化规律较为相似。具体的, 实验组下行流处理单元(1#和2#)环丙烷脂肪酸平均相对丰度为8.3%, 略低于上行流处理单元(3#和4#; 平均相对丰度11.6%), 且远低于对照组外接装置3#和4#处理单元(平均相对丰度39.3%)。同样, 实验组下行流处理单元(1#和2#)支链脂肪酸含量(平均相对丰度4.5%)略低于上行流处理单元(3#和4#; 平均相对丰度6.3%)。
对两套装置中不同深度石英砂基质微生物群落结构进行主成分分析(图5B), 第一和第二主成分(PC1和PC2)分别解释了28.6%和24.7%的总变异特征, 累计贡献率达到53.3%。整体上, 加入BDE-47的实验组的脂肪酸标志物种类较少, 实验组处理单元主要以i15∶0和a15∶0等脂肪酸为主, 表明其中耐受型较强微生物如革兰氏阳性厌氧菌[37]占主要优势; 而对照组处理单元中16∶1ω9, 18∶1ω9t等单不饱和脂肪酸含量丰富, 说明在此环境条件下有利于各种好氧革兰氏阴性菌[39]。
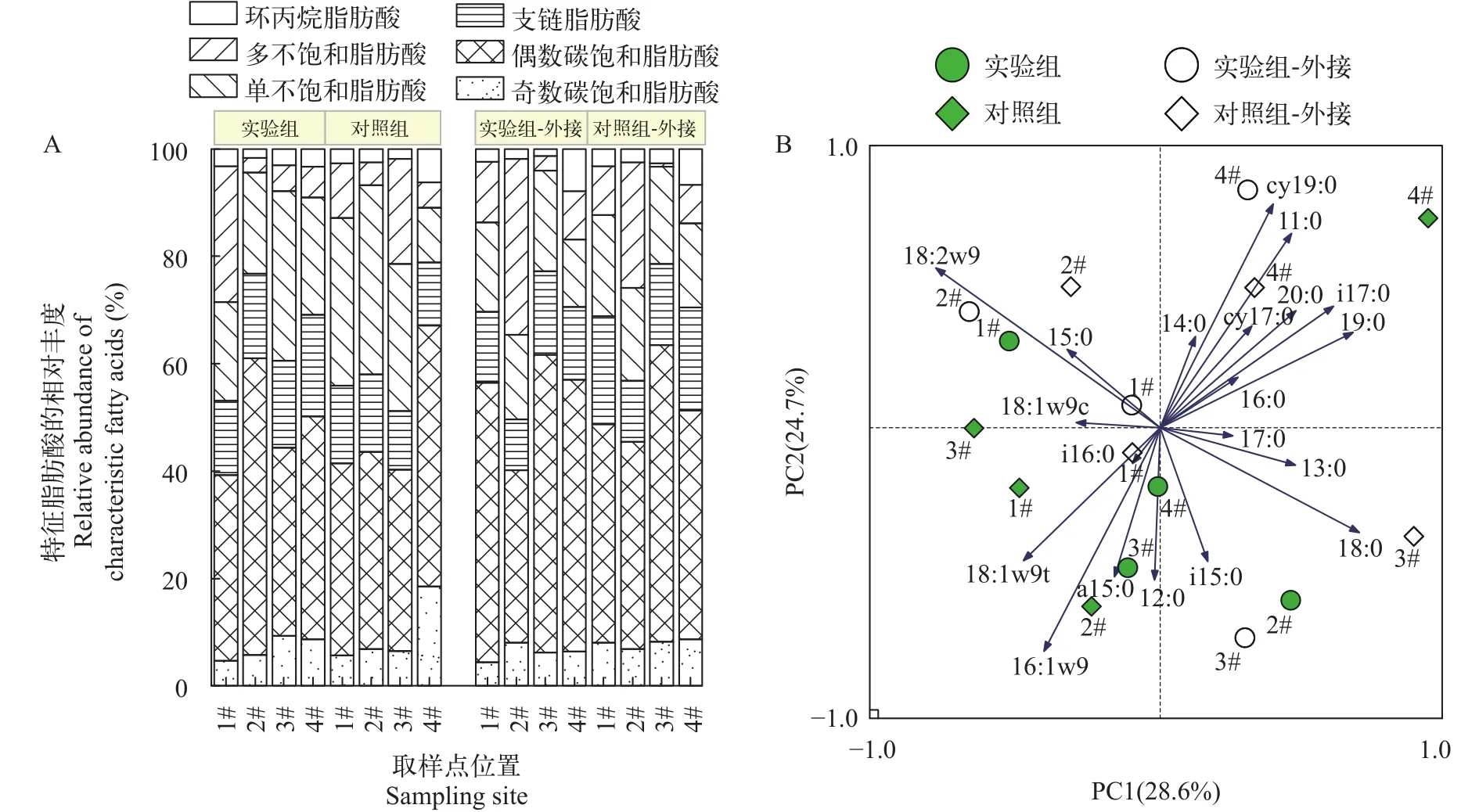
图5 微生物脂肪酸甲酯(FAMEs)组成及分布特征Fig.5 Composition and distribution characteristics of microbial fatty acid methyl esters (FAMEs)
图6为各处理组系统中特征脂肪酸比值分布状况, 以期探讨BDE-47的加入对IVCWs系统中微生物群落结构的影响。系统中MUFA/Branched的比值在1.1—2.0波动, 且对照内部含量高于实验组和外接基质内含量, 表明革兰氏阴性细菌在对照组中占优势, BDE-47的加入可能抑制系统内部革兰氏阴性菌形成优势。除个别差异值外, IVCWs原位基质微生物Trans/Cis的比值均高于外接装置基质, 且实验组高于对照组, 指示BDE-47可能对湿地微生物产生胁迫作用。由图6C, 实验组基质中i15+a15/16比值远高于对照组和外接装置, 且实验组下行流处理单元(0.52—0.59)略高于上行流处理单元(0.48—0.55), 指示加入BDE-47的实验组中细菌类群在总微生物群落中的相对优势更显著。一般认为, 相较于真核微生物, 细菌对环境胁迫具有更高的耐受性和适应能力, 故该结果指示BDE-47会对微生物, 尤其是真核微生物产生胁迫影响; 而原核细菌可通过调整自身细胞膜组分比例来适应其胁迫。

图6 IVCW系统基质中不同种类特征脂肪酸比值分布特征Fig.6 Ratios of different microbial fatty acid biomarkers in substrates of IVCW system
综上所述, 本套湿地系统处于运行初期微生物对环境适应能力不成熟, BDE-47的去除主要以石英砂吸附为主, 且对常规水质指标具有一定的处理效果。但BDE-47的加入使系统对NO3-去除效果减弱, 可能影响系统中脱氮微生物的代谢活性。而Yan等[35]研究显示尾水中升高的硝酸盐浓度(5 mg/L)可改变微生物群落组成, 促进BDE-99在回灌土柱中的生物降解, 尤其在柱系统的中层(45 cm)和下层(75 cm)。另有研究报道高含量硝酸盐可作为微生物的营养物质和电子受体, 提高芳香烃、多环芳烃等有机污染物的降解效率[34,40]。因此, 在湿地底层厌氧环境中, 微生物驱动的硝酸盐还原脱氮与PBDEs脱溴的相互影响与作用机制值得待进一步探讨。
3 结论
(1) 本套IVCWs装置对模拟污水中BDE-47具有很好的去除效果, 去除率高达99.9%, 其中下行池上层基质吸附起主导作用。(2) 与对照组相比, 实验组BDE-47的加入对微生物活性会有一定负面影响, 对硝态氮(-N)及化学需氧量(COD)去除率显著降低, 分别由53.0%降至28.1%、88.1%降至82.3%, 但对氨氮(-N)的去除率由72.3%提高至82.9%。(3) BDE-47的加入影响了基质微生物群落组成, 其中实验组与对照组下行流单元微生物群落组成差异尤为明显, 分别以具耐受型较强微生物(如革兰氏阳性厌氧菌)和快速生长的好氧型革兰氏阴性菌为主。
