抗H5N1禽流感病毒M1蛋白全人源胞内抗体的制备及纯化
2022-10-25蔄弘扬孙赫田园吴广谋张国利邱月王瑜张文慧岳玉环
蔄弘扬,孙赫,田园,吴广谋,张国利,邱月,王瑜,张文慧,岳玉环
1.吉林农业大学生命科学学院,吉林 长春 130117;2.中国农业科学院长春兽医研究所生物技术应用研究室,吉林 长春 130117
禽流感病毒(avian influenza virus,AIV)是一种常见的A型流感病毒,正黏病毒科流感病毒属,世界动物卫生组织(World Organization for Animal Health,OIE)将禽流感列为A类疫病。AIV通常在禽类、鸟类间传播,尤其是伴随候鸟迁徙的情况下会进一步增加其传播范围,造成跨地区、跨国家的大范围流行[1]。1996年,在中国广东的鹅中首次分离出H5N1高致病性AIV,于1997年发生首例人感染H5N1高致病性AIV事件[2-3]。目前面对禽流感疫情最重要的手段是采取综合性的防控措施,如加强疾病监测,及时封锁疫区,此外,易感人群提前接种疫苗也是预防人感染AIV的有效手段之一[4-5]。而针对禽流感的药物治疗,通常以抗甲型流感的通用药物为主,如针对M2蛋白的金刚烷胺和金刚乙胺,针对神经氨酸酶的扎那米韦和磷酸奥司他韦,但上述药物存在明显的耐药性[6-9]。基因工程抗体药物是目前研究的热点,以甲型流感病毒血凝素(hemagglutinin,HA)为靶点的单克隆抗体已进行了大量研究[10]。其中以MHAA-4549A和HV6-1衍生类抗体MEDI8852为代表的抗体药物均已进入临床Ⅱ期研究阶段[11-12]。但已有的关于MHAA4549AⅡ期临床数据显示,其在随机双盲安慰剂对照试验中未表现出良好的临床效果[13]。
M1蛋白作为流感病毒的基质蛋白,与流感病毒复制有关,参与病毒粒子的装配及释放[14],在甲型流感病毒中高度保守且基因序列稳定,是制备针对甲型流感病毒特异性抗体的良好作用靶点。本实验以H5N1高致病性AIV的M1蛋白作为抗原,制备其全人源胞内抗体TAT-ScFv M1-mFc,为进一步开发可在细胞内外全面抑制H5N1流感病毒的抗体药物奠定基础。
1 材料与方法
1.1 菌株及蛋白 大肠埃希菌BL21(DE3)和DH5α由中国农业科学院长春兽医研究所生物技术应用研究室保存,禽流感病毒H5N1的M1蛋白、重组菌BL21-pET32(a)-HisTag-Sumo-mFc和抗H5N1 M1蛋白的人源胞内抗体株3F(BL21)-pET28(a)-TAT-ScFv M1由该室构建并保存。
1.2 主要试剂CheLating SepharoSe Fast Flow、rProtein-A Bestarose 4 Fast Flow和AKTATMprime层析纯化仪购自美国GE公司;KOD-pLuS-neo高保真酶购自上海Toyobo公司;DNA marker DL2000购自大连TaKaRa公司;质粒小提试剂盒购自天根生化科技(北京)有限公司;琼脂糖凝胶DNA回收试剂盒购自康为世纪生物科技有限公司;BamHⅠ和HindⅢ限制性内切酶、T4 DNA连接酶购自北京Thermo公司;Recombinant protein A和HRP conjugate购自北京SinoBiological公司;TMB显色液购自北京索莱宝科技有限公司;IPTG、DTT和PMSF购自生工生物工程(上海)股份有限公司。
1.3 引物设计及合成 根据目的基因TAT-ScFv M1序列设计引物,上游引物序列:5'-GGCGGATCCTATGGTCGTAAAAAACGTCGT-3'(下划线部分为BamHⅠ酶切位点),下游引物序列:5'-GCAAGCTTCCGTTTGATTTCCACCTTGG-3'(下划线部分为HindⅢ酶切位点)。引物由长春库美生物科技有限公司合成。
1.4 目的基因的扩增 用LB培养基培养3F(BL21)-pET28(a)-TAT-ScFv M1菌株,质粒小提试剂盒提取重组质粒pET28(a)-TAT-ScFv M1,以其为模板PCR扩增目的基因TAT-ScFv M1片段(909 bp)。PCR扩增体系:模板1 μL,上下游引物各1 μL,2×Easy Taq Super Mix 25 μL,ddH2O 20 μL。反应条件:94℃预变性2 min;92℃变性40 s,54℃40 s,72℃60 s,共35个循环;72℃退火10 min。用琼脂糖凝胶DNA回收试剂盒回收目的基因片段。
1.5 重组表达质粒的构建 提取重组菌BL21-pET32(a)-HisTag-Sumo-mFc表达载体pET32(a)-HisTag-Sumo-mFc,用BamHⅠ和HindⅢ分别双酶切目的基因片段TAT-ScFv M1及表达载体,以T4 DNA连接酶连接,构建重组表达质粒pET32(a)-HisTag-Sumo-TAT-ScFv M1-mFc,转化CaCl2法制备的感受态大肠埃希菌DH5α,涂布于氨苄抗性(终浓度1%)的固体LB培养基上。挑取单菌落,转入5 mL氨苄抗性(终浓度1%)的液体LB培养基中,37℃过夜培养,离心菌体,提取质粒,进行双酶切鉴定,选取阳性克隆菌株委托吉林省库美生物科技有限公司测序。
1.6 重组蛋白的诱导表达 将测序正确的重组表达质粒pET32(a)-HisTag-Sumo-TAT-ScFv转化至大肠埃希菌BL21(DE3)中,从长满菌落的LB固体培养基上随机挑选优异的单个菌落转接于氨苄抗性(终浓度1%)的LB液体培养基中,于摇床内37℃,180 r/min培养至菌液A600达0.6,加入1 mmol/L IPTG,37℃诱导5 h。10 000×g离心2 min,将获得的菌体超声破碎,分别取全菌、上清、沉淀,以空大肠埃希菌BL21(DE3)为阴性对照,进行12.5% SDS-PAGE分析。
1.7 重组蛋白TAT-ScFv M1-mFc的纯化
1.7.1 菌体裂解与洗涤 用1 L氨苄抗性(终浓度1%)液体LB培养基扩大培养表达菌,1 mmol/L IPTG 37℃诱导5 h,离心收集菌体。取5 g诱导菌放入100 mL烧杯内,加入buffer(50 mmol/L Tris-HCl 50 mL,1%溶菌酶5 mL,0.5 mol/L EDTA 200 μL,1 mol/L DTT 100 μL,TritonX-100 500 μL,pH 9.5)悬起,用匀质机850 Pa压榨4 min,10 000×g离心15 min收集沉淀。用1 mol/L Urea(1 mol/L Urea,50 mmol/L Tris-HCl,0.1 mol/L NaCl,pH 9.5)重悬,10 000×g离心15 min,收集沉淀。用8 mol/L Urea、50 mmol/L Tris-HCl、0.5 mol/L NaCl,pH 9.5混合液50 mL溶解,再稀释为6 mol/L Urea、50 mmol/L Tris-HCl、0.5 mol/L NaCl。
1.7.2 金属螯和层析纯化 使用(Cu2+)-Chelating Sepharose Fast Flow层析柱,以线速度1.5 cm/min进行纯化。平衡液A为6 mol/L Urea、0.5 mol/L NaCl、50 mmol/L Tris-HCl、5 mmol/L咪唑,调pH为9.2;洗脱液B为平衡液A加入咪唑至终浓度50 mmol/L;洗脱液C为平衡液A加入咪唑至终浓度150 mmol/L。分别收集50、150 mmol/L咪唑洗脱液,12.5% SDSPAGE分析纯化效果。
1.7.3 初纯蛋白的复性 对初纯目的蛋白采用尿素浓度递减方法进行透析复性,透析液(pH 9.5)与蛋白的比例为50∶1。每24 h更换1次透析液,其中尿素浓度分别为4、2、1、0 mol/L,其余成分为50 mmol/L Tris-HCl、0.5%蔗糖、0.1 mmol/L GSSH、0.9 mmol/L GSH、0.005% NaN3、0.1 mmol/L DTT、0.01 mmol/L PMSF、0.1%吐温80、5%甘油。复性后的蛋白采用150 mmol/L NaCl、50 mmol/L Tris-HCl继续透析,同时按30∶1的比例加入Sumo酶,4℃酶切过夜,切掉重组蛋白中的Sumo蛋白,剩下的即为TAT-ScFv M1-mFc胞内抗体蛋白,相对分子质量约为56 000。
1.7.4 亲和层析纯化 酶切后的蛋白使用rProtein A Bestarose 4 Fast Flow层析柱进行纯化。平衡液为50 mmol/L Tris-HCl,pH 9.5;洗脱液为0.1 mol/L Gly,pH 2.6。
1.8 抗体活性检测 采用间接ELISA法。用H5N1M1蛋白作为抗原,以2 μg/mL浓度包被酶标板,100 μL/孔,37℃包被1 h;PBST洗涤5次,400 μL/孔,每次1 min,加入5%脱脂奶粉,200 μL/孔,37℃封闭1 h;洗涤,将浓度0.27 mg/mL的纯化抗体用PBS倍比稀释(1∶2~1∶64),加入酶标板,100 μL/孔,37℃孵育1 h,以PBS为阴性对照;洗涤,加入ProteinA-HRP(1∶2 000稀释),100 μL/孔,37℃孵育1 h;洗涤,加入TMB显色液,100 μL/孔,避光显色15 min;加入2%稀硫酸终止液,50 μL/孔,经酶标仪检测波长450 nm处吸光度。共做两组平行检测。
2 结果
2.1 目的基因PCR扩增产物的鉴定PCR扩增的目的基因片段TAT-ScFv M1经2%琼脂糖凝胶电泳分析,可见约900 bp的特异片段,大小预期相符,见图1。

图1 提取的质粒和PCR扩增基因的凝胶电泳图Fig.1 Electrophoretic profile of extracted plasmid and PCR products
2.2 重组表达质粒的鉴定 重组表达质粒pET32(a)-HisTag-Sumo-TAT-ScFv M1-mFc经BamHⅠ和HindⅢ双酶切,可见约900 bp的目的基因条带,大小与预期相符,见图2,表明重组表达质粒构建正确。测序结果显示,获得的基因序列与目的基因序列完全一致。
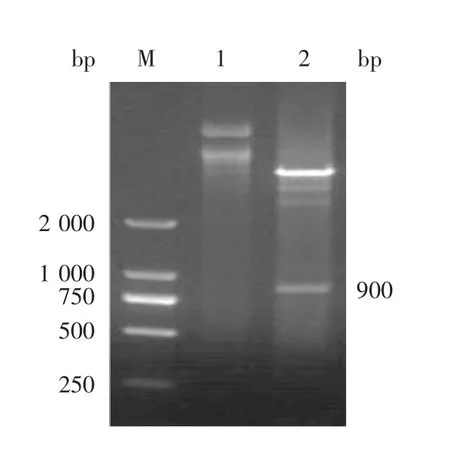
图2 重组表达质粒pET32(a)-HisTag-Sumo-TAT-ScFv M1-mFc的双酶切(BamHⅠ/HindⅢ)鉴定Fig.2 Restriction map of recombinant plasmid pET32(a)-HisTag-Sumo-TAT-ScFv M1-mFc(BamHⅠ/HindⅢ)
2.3 表达产物的鉴定12.5%SDS-PAGE分析显示,重组蛋白Sumo-TAT-ScFv M1-mFc主要以包涵体形式表达,相对分子质量约80 000,见图3。

图3 表达产物的SDS-PAGE分析Fig.3 SDS-PAGE profile of expressed product
2.4 纯化产物的鉴定
2.4.1 菌体裂解及洗涤 通过对菌体裂解液反复洗涤,去除了杂蛋白,完成了对目的蛋白的初步纯化,见图4。

图4 表达菌的裂解及初步纯化产物的SDS-PAGE分析Fig.4 SDS-PAGE profile of lytic recombinant E.coli and preliminarily purified protein
2.4.2 金属螯合层析SDS-PAGE分析显示,目的蛋白在50和150 mmol/L咪唑洗脱峰中,见图5。
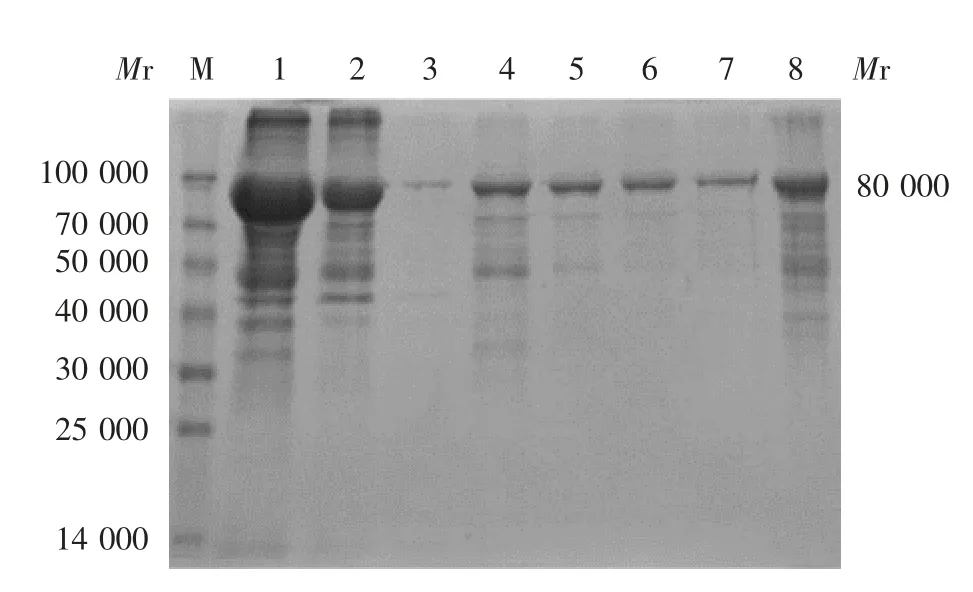
图5 金属螯合层析结果Fig.5 Results of metal chelation chromatography
2.4.3 酶切后目的蛋白的纯化 共获得4个洗脱峰,目的蛋白主要在洗脱峰1和3中,见图6。收集的目的蛋白超滤浓缩后,电泳可见条带位置正确,获得的重组蛋白TAT-ScFv M1-mFc纯品浓度超过90%,见图7。
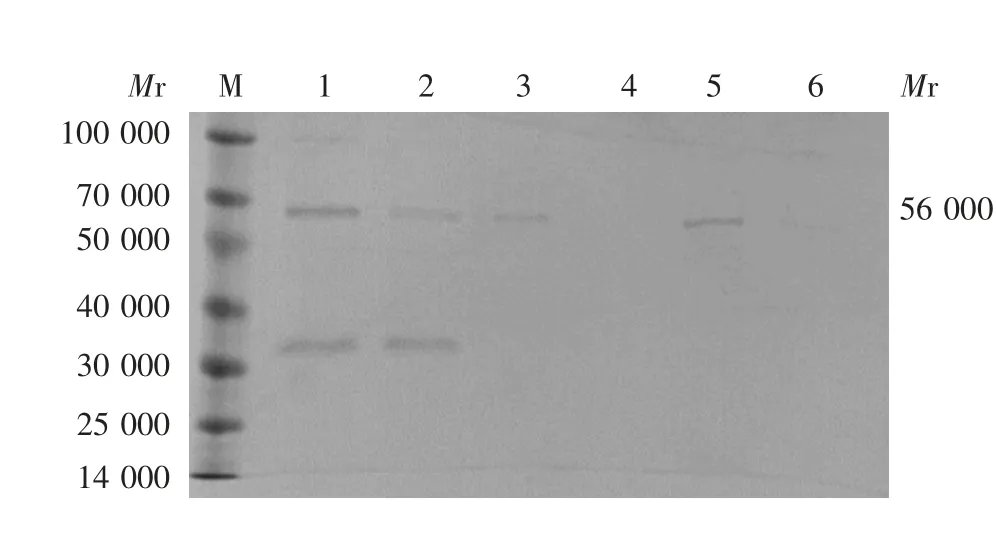
图6 ProA亲和层析结果Fig.6 Results of ProA affinity chromatography
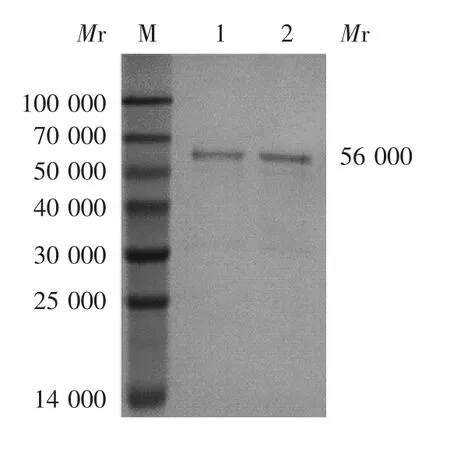
图7 目的蛋白的浓缩Fig.7 Concentration of target protein
2.5 抗体的结合活性 间接ELISA检测结果显示,64倍稀释后,抗体A450值仍超过阴性对照的2.1倍,见表1,表明制备的胞内抗体具有明显的结合M1蛋白的活性。
3 讨论
本研究成功制备了抗H5N1 AIV M1蛋白全人源胞内抗体,经ELISA检测验证,其在体外对M1蛋白具有明显的结合活性,下一步将继续探讨该抗体在动物体内对H5N1 AIV的抑制作用。本研究结果为进一步开发针对AIV H5N1的抗体药物奠定了基础。由于M1蛋白在甲型流感病毒中高度保守,本研究也为探索针对甲型流感病毒不同亚型的广谱抗体药物提供了可能。在菌体裂解及洗涤过程中,本研究通过多次不同溶液的反复洗涤处理大量大肠埃希菌BL21(DE3)中表达的非目的蛋白,以便更高效地进行后续精纯,该方法不仅对本实验的蛋白纯化过程有显著帮助,对在大肠埃希菌BL21(DE3)中其他蛋白的初纯也有较高的参考价值。本研究使用HisTag-Sumo结构诱导表达发现,该表达体系虽然无法使全人源抗体在原核体系中可溶性表达,但可通过能否成功酶切区分未复性的蛋白与复性的蛋白。
本研究构建的重组胞内抗体TAT-ScFv M1 mFc在抗M1蛋白的单链抗体基因前添加了具有穿膜功能的TAT转导肽基因,在单链抗体基因后添加了人源mFC基因片段,融合表达TAT-SCFV-mFc蛋白。由于TAT蛋白具有穿梭细胞膜功能[15],可携带SCFV进入细胞内,使其可在细胞内中和H5N1的M1蛋白,阻止H5N1病毒的复制和组装。人源mFC是我们自己构建的变异Fc片段,突变了半胱氨酸位点,使其不会形成二聚体,并可延长抗体的半衰期,增加亲和力。另外,本研究通过在质粒构建过程中添加HisTag-Sumo结构,利用His标签提高蛋白的纯化效率,利用Sumo酶识别蛋白质三级结构而非氨基酸序列的特点[16],筛除未复性成功的融合蛋白,确保制备出的抗体具有生物活性。
综上所述,本研究成功制备了抗H5N1病毒M1蛋白的全人源胞内抗体TAT-ScFv M1-mFc,为进一步开发针对AIV H5N1的抗体药物奠定了基础。
