新一代测序技术对22q11.2微缺失所致的胎儿心脏发育畸形的产前筛查价值
2022-10-25邹玥刘颖郭雪华
邹玥,刘颖,郭雪华
作者单位:吉林省妇幼保健院中心实验室,吉林 长春 130000
胎儿心脏发育畸形是临床常见的先天畸形类型,据报道[1],心脏发育畸形在胎儿期的发生率约为0.3%~1.4%,因心脏发育畸形导致的妊娠终止率可高达75%,其存活率仅有10%~38%,存活患儿经治疗后也有部分预后不良,影响身体健康。胎儿心脏发育畸形受遗传、环境等多因素影响,近年来研究发现[2],染色体22q11.2微缺失与胎儿心脏发育畸形关系密切,染色体22q11.2微缺失病例中有60%~80%病例合并心脏发育畸形。临床对22q11.2微缺失所致的胎儿心脏发育畸形尚无有效治疗方法,因此进行产前早期筛查诊断对降低死胎率和活产儿心脏畸形率非常重要。目前微阵列比较基因组杂交技术(array comparative genomic hybridization,arrayCGH)是替代传统分析细胞核型的有效工具,无需细胞培养即可高分辨准确检测出染色体微缺失,但价格高、难度大,而近几年临床应用较多的多重连接探针扩增技术(multiplex ligation probe amplification,MLPA)虽花费较少,操作简单,但该方法与arrayCGH均需行羊水穿刺采集样本,会增加早产、宫内感染、宫内死亡的风险,孕妇及家属接受度不高,不适用于产前筛查[3-4]。近年来新一代测序技术打破了传统产前诊断的局限性,该技术包括大规模平行测序、焦磷酸测序、Illumina测序等多种方法,具有低成本、高通量、无创伤的特点,在胎儿遗传病基因检测和生殖筛查中优势显著[5],但目前该技术在22q11.2微缺失所致的胎儿心脏发育畸形中的应用及诊断效能尚未有研究报道。鉴于此,笔者选取78例可疑胎儿心脏发育畸形者的孕妇采用新一代测序技术进行产前检测,分析其筛查价值。
1 资料与方法
1.1 一般资料按下述入排标准选取吉林省妇幼保健院2018年7月至2020年3月可疑胎儿心脏发育畸形的孕妇78例作为受试对象,年龄范围为23~41岁,年龄(28.43±4.27)岁;孕龄范围为12~24周,孕龄(18.94±2.86)周;其中自然受孕者65例;既往有唇裂、无脑儿、心脏缺陷、智力缺陷、死胎等异常生育史者18例;有家族遗传史者2例。本研究已经吉林省妇幼保健院伦理委员会批准(201806-002)。
纳入标准:(1)经超声检查疑似胎儿心脏发育畸形者;(2)均为单胎妊娠;(3)均接受跟踪随访;(4)均对本研究知情并签署同意书。排除标准:(1)妊娠期有糖尿病、高血压等合并症者;(2)既往有高血压、糖尿病者;(3)接受过输血、细胞治疗、移植手术者;(4)过度肥胖者;(5)心、肝、肾等功能异常者。
1.2 方法
1.2.1 样本采集及处理(1)羊水穿刺及DNA提取:告知孕妇及家属羊水穿刺风险,孕妇需签署同意书。进行穿刺前需行血常规、凝血常规、传染病检查、超声检查,在无感染、无发热、凝血功能正常、羊水量充足的情况下进行羊水穿刺。穿刺后取羊水样本,离心后弃去上清液,采用游离DNA提取试剂盒(上海希言科学仪器有限公司)按照操作流程提取胎儿脱落细胞中的DNA。(2)外周血DNA提取:采集孕妇及其配偶的外周血于抗凝管中保存,在4℃、10 000 r/min(离心半径12 cm)条件下离心10 min,后取上层血浆,采用游离DNA提取试剂盒(上海希言科学仪器有限公司)按照操作流程提取游离DNA。
1.2.2 新一代测序技术检测用Nanodrop2000核酸定量仪(美国Nanodrop)测定提取的孕妇外周血游离DNA的纯度和浓度,检测合格后于-20℃冰箱保存。游离DNA经文库制备后在Illumina Next-Sep500测序平台完成100 kb、测序深度1×的高通量测序,将测序结果经信息分析通过Z值进行染色体22q11.2缺失基因判定。
1.2.3 MLPA技术检测采用微缺失检测试剂盒(荷兰MBC-Holland)按照操作流程进行检测,共含22q11.2区域的29个探针,稀释提取的羊水DNA浓度后进行变性、杂交、连接反应,取连接产物进行PCR反应,过程:95℃、60℃下各30 s,72℃下1 min,35个循环后在72℃下延伸10 min。然后取反应产物在ABI3130基因分析仪中进行电泳,采用Coffalyser软件进行分析得出基因相对拷贝数比值:比值<0.7表示检测区基因有缺失;比值为0.7~1.3,表示检测区基因无缺失;比值>1.3表示检测区基因有重复片段。采集检测结果有22q11.2缺失的孕妇及配偶外周血,提取外周血DNA采用MLPA技术检测胎儿父母有无22q11.2微缺失,以进行父母溯源。
1.2.4 arrayCGH技术检测采用Oligo Human CGH Microarray芯片(美国Agilent公司),经过洗涤、离心甩干后对采集提取的孕妇羊水DNA进行全基因组扫描分析22q11.2精确缺失位置和大小。
1.2.5 跟踪随访跟踪随访至孕妇妊娠结束,引产或死产者进行尸检观察胎儿心脏发育畸形情况,活产者进行心脏检查观察发育情况,统计胎儿心脏发育畸形结果。将arrayCGH验证结果记作诊断22q11.2微缺失所致的胎儿心脏发育畸形的“金标准”。
1.3 观察指标(1)随访结果;(2)新一代测序技术检测胎儿22q11.2微缺失情况;(3)MLPA技术检测胎儿及其父母22q11.2微缺失情况;(4)arrayCGH技术验证情况。
1.4统计学方法采用SPSS 25.0软件作为统计学工具。采用配对χ2检验方法比较各诊断方法与金标准方法的诊断价值,采用Kappa一致性检验分析不同方法与“金标准”结果的一致性,P<0.05为检测水平差异有统计学意义。
2 结果
2.1 随访情况共35例胎儿心脏发育畸形,发生率为其中永存动脉干、右心室双出口2例,共同动脉干、双上腔静脉、共同房室瓣反流3例,大动脉转位、单心室、三尖瓣闭锁3例,肺动脉闭锁、室间隔缺损3例,单心房、单心室、完全性心内膜垫缺损2例,肺动脉狭窄、室间隔缺损、主动脉骑跨5例,室间隔缺损、肺动脉狭窄、右位主动脉弓5例,室间隔缺损、动脉导管缺如、右位主动脉弓4例,室间隔缺损、动脉导管缺如4例,室间隔缺损、右位主动脉弓2例,法洛四联症、肺动脉闭锁2例。
2.2 新一代测序技术结果35例胎儿心脏发育畸形中有12例经新一代测序技术发现22q11.2微缺失,检出率为34.29%(12/35);43例胎儿心脏发育正常中有1例经新一代测序技术发现22q11.2微缺失,检出率为2.33%(1/43)。(即新一代测序技术发现了13例阳性样本-22q11.2微缺失)。
2.3 MLPA检测结果35例胎儿心脏发育畸形中有14例经MLPA发现22q11.2微缺失,检出率为40.00%(14/35);43例胎儿心脏发育正常中有1例经MLPA发现22q11.2微缺失,检出率为2.33%(1/43)。(即MLPA方法发现了15例阳性样本22q11.2微缺失)。
此外,15例发现22q11.2微缺失的胎儿父母基因溯源发现有2例父源22q11.2微缺失,占比为13.33%(2/15);余13例父母检测结果均正常。
2.4 arrayCGH技术验证结果
2.4.1 14例胎儿心脏发育畸形22q11.2微缺失的检测结果35例胎儿心脏发育畸形中有14例经arrayCGH检测发现22q11.2微缺失,检出率为40.00%(14/35),具体信息见表1。
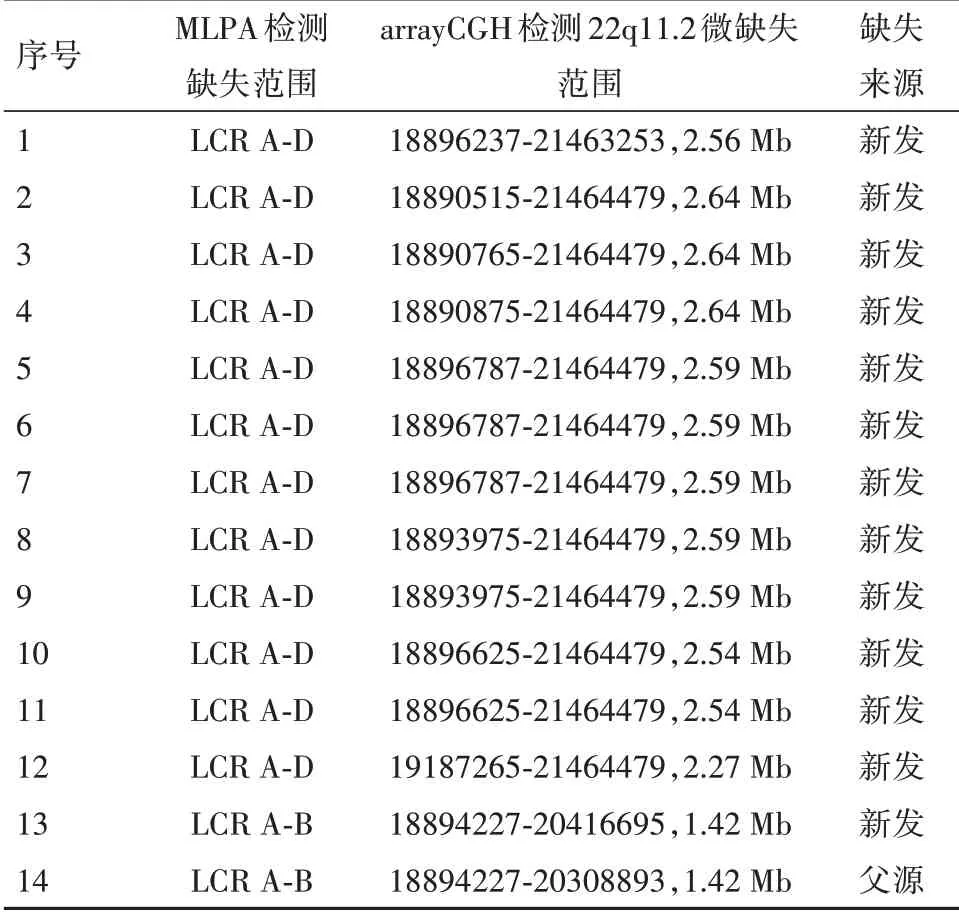
表1 14例胎儿心脏发育畸形22q11.2微缺失的检测结果
2.4.2 1例胎儿心脏发育正常22q11.2微缺失的检测结果43例胎儿心脏发育正常中有1例经arrayCGH检测发现父源22q11.2微缺失,MLPA检测缺失范围为LCR A-D,arrayCGH检测22q11.2微缺失范围为19187939-21464479,2.27Mb,检出率为2.33%(1/43)。
2.4.3 新一代测序技术诊断22q11.2微缺失情况的诊断分析结果(1)胎儿心脏发育畸形者经新一代测序技术检测22q11.2微缺失检出率,均高于胎儿心脏发育正常者。诊断价值分析(配对χ2检验)发现:新一代测序技术检测与金标准arrayCGH验证法的关联性χ2=59.43,P=0.000(提示两法关联),差异性χ2=0.50,P=0.480(提示两法相近),灵敏度0.87,特异度1.00。其符合率(准确度)为97.4%(76/78)、Kappa=0.910(提示一致性好),见表2。
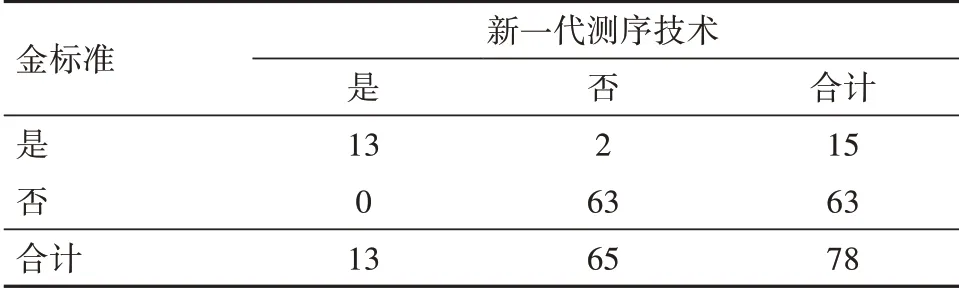
表2 新一代测序技术诊断22q11.2微缺失情况/例
(2)胎儿心脏发育畸形者经MLPA检测22q11.2微缺失检出率,均高于胎儿心脏发育正常者。诊断价值分析(配对χ2检验)发现:MLPA检测22q11.2微缺失情况与金标准arrayCGH验证法的关联性χ2=71.70,P=0.000(提示两法关联),差异性χ2=0.00,P=1.000(提示两法相同)。其符合率(准确度)为100.0%(76/78)、Kappa=1.000(提示两法完全一致),见表3。
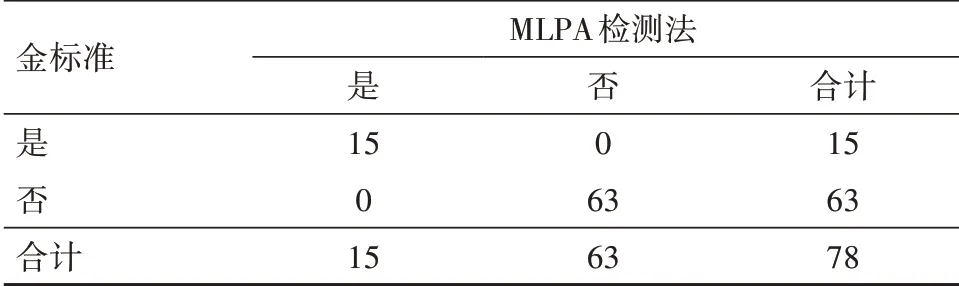
表3 MLPA诊断22q11.2微缺失情况/例
3 讨论
染色体22q11.2微缺失是最常见的引起胎儿心脏发育畸形的遗传因素之一,因其为显性遗传,携带者下一代发生22q11.2微缺失的概率较大[6],因此产前筛查22q11.2微缺失意义重大。近年来随着基因组学的技术进步,临床上采用MLPA、arrayCGH等技术进行22q11.2微缺失的检测,但检测过程均具有创性,对宫内胎儿发育有潜在危险,不适用于产前筛查。因此,亟须寻求一种安全、有效、简便的方法来进行22q11.2微缺失产前筛查,预防新生儿出生缺陷。
本研究发现,在78例可疑胎儿心脏发育畸形的孕妇中有35例确诊胎儿心脏发育畸形,胎儿心脏发育畸形易造成孕期流产、死胎、新生儿早期死亡等,因此需高度重视胎儿心脏发育畸形产前筛查。本研究35例胎儿心脏发育畸形者经新一代测序技术检测发现有12例22q11.2微缺失,检出率为34.29%,43例胎儿心脏发育正常者经新一代测序技术发现有1例22q11.2微缺失,检出率为2.33%,说明新一代测序技术对22q11.2微缺失有一定的筛查作用。研究发现[7-8],妊娠5周后就可在母体外周血中检测出胎儿DNA,并且其浓度随孕期增加而升高,且妊娠后血浆胎源性DNA分子长度显著短于母体,因此从母体外周血血浆中提取胎儿DNA比较简便。
本研究采用Illumina新一代测序技术对母体外周血提取的胎儿DNA进行大规模深度测序,在DNA复制时加入标记核苷酸进行追踪捕获目的基因组,利用Illumina平台边合成边测序,覆盖基因范围广泛,具有较高的敏感度和准确性,且操作方法简单,对宫内胎儿发育无影响[9]。Gatticchi等[10]在对由2ALMS1基因变异引起的Alström综合征病人进行基因筛查诊断研究中,发现新一代测序技术能够快速、准确进行筛查诊断,进一步证实了新一代测序技术在基因筛查诊断中的价值。既往研究报道[11-12],MLPA技术在基因变异导致的各种疾病中有较高的检测价值。本研究中35例胎儿心脏发育畸形中有14例经MLPA发现22q11.2微缺失,检出率为40.00%,43例胎儿心脏发育正常中有1例经MLPA发现22q11.2微缺失,检出率为2.33%;其中15例22q11.2微缺失的胎儿父母基因溯源发现有2例父源22q11.2微缺失,占比为13.33%,余13例父母检测结果均正常,说明了MLPA技术对22q11.2微缺失具有检测诊断价值。MLPA技术将DNA探针技术与PCR技术结合,能够高通量快速检测基因组拷贝数变异,准确识别缺失区域,且能对父母溯源,有助于遗传咨询,评估再次孕育风险,常用于检测临床基因遗传疾病[13]。另外本研究结果显示,经arrayCGH技术检测验证,35例胎儿心脏发育畸形中有14例发现22q11.2微缺失,检出率为40.00%,43例胎儿心脏发育正常中有1例发现22q11.2微缺失,检出率为2.33%。arrayCGH技术能够进行基因组拷贝数变异分析,对检测微小缺失具有独特优势,检测结果准确、可靠,临床常采该技术验证其他基因测序技术检测结果[14]。
本研究结果显示胎儿心脏发育畸形者经一代测序技术、MLPA技术检测22q11.2微缺失检出率均高于心脏发育正常者,提示22q11.2微缺失与胎儿心脏发育畸形有密切关系。大量研究发现,染色体22q11.2区域有较多低拷贝重复序列,易发生非等位基因同源重组,影响胚胎早期心脏形态发生及心血管的发育,主要导致圆锥动脉畸形,如法洛四联症、主动脉离断、房/室间隔缺损、永存动脉干、右室双出口和大动脉转位等[15-17],故进行产前筛查胎儿22q11.2微缺失情况对降低新生儿心脏畸形率意义重大。本研究采用新一代测序技术检测胎儿22q11.2微缺失情况结果与金标准arrayCGH验证法具有高度一致性,采用MLPA检测结果与金标准arrayCGH验证法完全一致,且以上两种检测方法与金标准arrayCGH验证法有显著关联性,无明显差异性,检测符合率高,说明新一代测序技术和MLPA技术对22q11.2微缺失的检测准确度高,证实了新一代测序技术及MLPA技术的筛查价值。新一代测序技术相比传统Sanger测序技术所需样本量少、通量高、分辨率高,能检测出低至0.1 Mb的缺失或重复[18];与arrayCGH技术相比无需对全基因组测序,可利用序列捕获技术针对性检测目的基因组,节省成本,检测速度快;与MLPA技术相比样本要求简单,可降低样本污染风险,且无创伤性。因此,临床可应用新一代测序技术作为22q11.2微缺失所致的胎儿心脏发育畸形的产前筛查方法。
综上,22q11.2微缺失是胎儿心脏发育畸形的常见原因,新一代测序技术和MLPA对其筛查价值相当,可在临床产前筛查中推广应用。
