国产伏立康唑调配方法优化及其稳定性研究
2022-10-25许红李国春尹加珍刘龙梅李欣欣
许红,李国春,尹加珍,刘龙梅,李欣欣
作者单位:西南医科大学附属中医医院静脉用药调配中心,四川 泸州 646000
伏立康唑(Voriconazole)属于第二代广谱的三唑类抗真菌药物,该药物主要通过与真菌细胞色素P450结合,有效抑制真菌羊毛甾醇14α-甾醇去甲基化酶的活性,干扰细胞膜脂质的合成,从而破坏细胞膜的功能和结构,使细胞的通透性发生改变,最终导致真菌细胞死亡,以发挥对病原体感染的免疫作用。对念珠菌、曲霉菌、隐球菌及一些不常见的霉菌都有较好的抗菌活性,具有抗菌效力强、抗菌谱广的特点[1-3]。也有文献报道,两性霉素B脂质体联合伏立康唑治疗急性髓系白血病合并曲霉菌感染病人的临床治疗效果明显优于单独使用伏立康唑,但应注意控制剂量,并监测肾功能[4]。
由于伏立康唑水溶性差,在生产制备时,提高其溶解度成为首要解决问题。目前临床上常用的国产注射用伏立康唑有两种,分别是以羟丙基-β-环糊精为增溶剂,和以乙醇和丙二醇的混合液为专用溶剂[5]。我院使用的注射用伏立康唑配有专用溶媒5 mL,其成分为乙醇、丙二醇各2.5 mL的混合液。其说明书要求将5 mL专用溶媒加入伏立康唑粉针剂瓶,强力振荡药瓶30 s,静置30 min,再强力振荡30 s,确认药物粉末完全溶解,溶液澄清,无任何细小结晶。用5%葡萄糖注射液稀释(如果病人不能耐受葡萄糖,也可以选用0.9%氯化钠注射液)。但在静脉用药调配中心实际操作过程中,若调配方法操作不当,和配伍0.9%氯化钠注射液时,仍然会产生配伍液浑浊,析出药物结晶的情况;且按说明书调配方法耗时较长,不利于工作效率的提高。为此,本实验自2020年6―9月对注射用伏立康唑的溶媒配伍和调配方法进行考察。
1 材料
1.1 仪器日本岛津高效液相色谱仪(LC-20AT泵、ELSD检测器、CTO-10AS进样器、LcSolution色谱工作站);AUW120D十万分之一电子天平(日本岛津);JP全数字超声波发生器(武汉嘉鹏电子有限公司);GWF-8JD型智能微粒检测仪(天津天河分析仪器有限公司);KJ-202型振荡器(江苏康健医疗用品有限公司)。
1.2 试药伏立康唑对照品(上海源叶生物科技有限公司,批号137234-62-9,纯度98.0%)注射用伏立康唑(四川美大康华康药业有限公司,规格为0.1克/支,批号18120419),药品自带专用溶媒[四川美大康华康药业有限公司,规格为5毫升/支(乙醇、丙二醇各2.5 mL),专用溶媒批号18120816];0.9%氯化钠注射液(四川科伦,规格为100毫升/瓶,批号W219050509,溶媒);5%葡萄糖注射液(四川科伦,规格为100毫升/瓶,批号N19060306A,溶媒);甲醇、乙腈为色谱纯。
2 方法
2.1 色谱条件色谱柱:ODS-SP C18柱(150 mm×4.6 mm,5 μm);流动相:0.02 mol/L醋酸铵缓冲液(醋酸调pH至4.0±0.3)-甲醇-乙腈(55∶15∶30);流速:1.00 mL/min;柱温:35℃;检测波长256 nm;进样量:10 μL。
2.2 对照品贮备液的制备精密称取伏立康唑对照品0.050 34 g,置25 mL容量瓶,流动相溶解并定容至刻度,超声混匀,制得浓度2.013 6 g/L的伏立康唑对照品溶液。
2.3 供试品溶液的制备
2.3.1 调配方法考察调配方法A:按注射用伏立康唑说明书调配方法:取注射用伏立康唑2支,分别将5 mL专用溶媒加入伏立康唑粉针剂瓶,强力振荡30 s,静置30 min,再强力振荡30 s,确认药物粉末完全溶解,溶液澄清,无任何细小结晶(用时约33分25秒)。取溶解液分别缓慢加入45 mL 0.9%氯化钠注射液、5%葡萄糖注射液中,轻摇混匀,分别得配伍液1、配伍液2。
调配方法B:取注射用伏立康唑1支,将5 mL专用溶媒加入伏立康唑粉针剂瓶,反复冲洗(约6~7次)至溶液澄清透明,无任何细小结晶(用时约2分48秒)。取溶解液缓慢加入45 mL5%葡萄糖注射液中,轻摇混匀,得配伍液3。
调配方法C:取注射用伏立康唑1支,将5 mL专用溶媒加入伏立康唑粉针剂瓶,强力振荡至溶液澄清透明,无任何细小结晶(用时约1分42秒)。取溶解液缓慢加入45 mL5%葡萄糖注射液中,轻摇混匀,得配伍液4。
分别从配伍液1~4中吸取1.0 mL置20 mL容量瓶,用相对应溶媒定容,轻摇混匀,得供试品1-~4。
2.3.2 振荡作用对配伍液的考察取注射用伏立康唑2支,分别将5 mL专用溶媒加入伏立康唑粉针剂瓶,用方法C进行调配。为考察成品运送过程中可能受到的外力振荡作用,故将调配好的配伍液放置于振荡器上,进行轻度、强度两个挡位的振荡,分别得配伍液5、配伍液6。
分别从配伍液5和6中吸取1.0 mL置20 mL容量瓶,用5%葡萄糖注射液定容,轻摇混匀,得供试品5和6。
2.4 标准曲线的制备精密吸取“2.2”项下贮备液适量,配置成浓度为0.010 0、0.030 2、0.060 4、0.080 5、0.100 6、0.140 9、0.161 1 g/L的对照品溶液,按“2.1”项下色谱条件测其峰面积。以峰面积为纵坐标,浓度为横坐标,绘制标准曲线S=235 594C+40 096(r2=0.999 6)伏立康唑在0.010 0~0.161 1 g/L浓度范围内线性关系良好。
2.5 方法学考察
2.5.1 精密度试验精密吸取伏立康唑对照品溶液适量,按“2.1”项下色谱条件,连续进样6次,测其峰面积。结果RSD=0.06%,表明仪器精密度良好。
2.5.2 重复性试验取注射用伏立康唑6支,分别用专用溶媒5 mL溶解后,用5%葡萄糖注射液定容至50 mL,精密吸取1.0 mL至20 mL容量瓶中,用5%葡萄糖注射液定容,制成6份供试品溶液。按2.1项下色谱条件测其峰面积。结果RSD=0.20%,表明该方法重复性良好。
2.5.3 回收率试验精密称取注射用伏立康唑0.050 33 g,用专用溶媒2.5 mL溶解后,用5%葡萄糖注射液定容至25 mL,得样品溶液。精密吸取样品溶液0.7 mL至25 mL容量瓶中,分别加入高、中、低3种浓度的伏立康唑对照品溶液,并用5%葡萄糖注射液稀释至刻度。每种浓度测定3份,按“2.1”项下色谱条件测其峰面积,代入标准曲线计算含量。结果平均回收率为98.28%,RSD=1.63%。见表1。
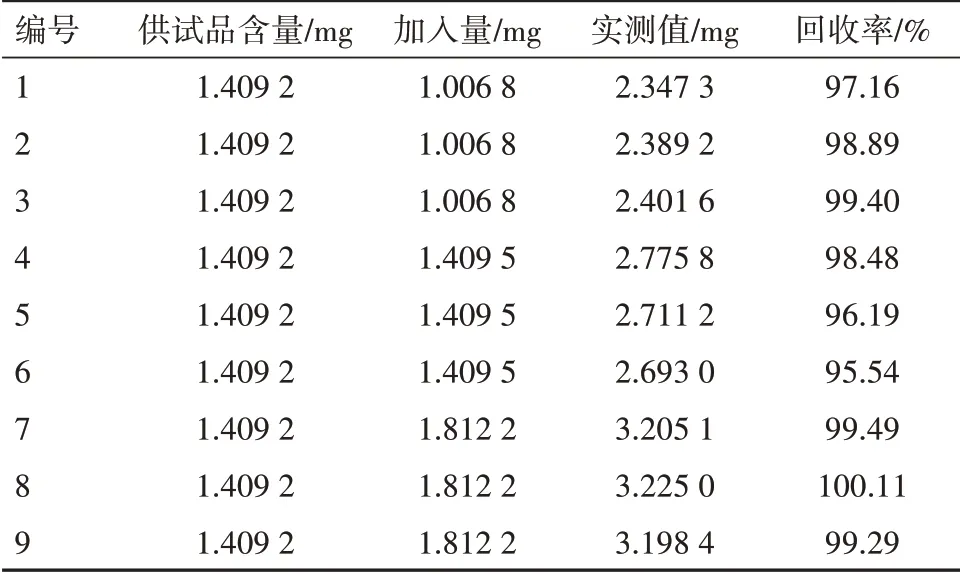
表1 注射用伏立康唑加样回收试验结果(n=3)
3 结果
3.1 外观性状取“2.3”项下配制的伏立康唑各配伍液,置纳氏比色管中,分别于0、0.5、1、1.5、2、3、4、6、8 h观察性状变化,结果见表2。根据2020版《中国药典》对静脉输液的规范,出现浑浊即不符合静脉输液要求,故调配液1、5、6为不合格。

表2 配伍液的性状变化
3.2 pH取“2.3”项下配制的伏立康唑各配伍液,于0、0.5、1、1.5、2、3、4、6、8 h测定pH,每份样本连续测定2次,取平均值,结果见表3。普通静脉输液要求pH为4~9,配伍液1~6在8 h内均符合规范。

表3 配伍液的pH变化
3.3 不溶性微粒取“2.3”项下配制的伏立康唑各配伍液,于0、0.5、1、1.5、2、3、4、6、8 h按《中国药典》(2020年版)微粒检测法中的光阻法检测微粒。根据《中国药典》(2020年版)通则0903规定[6],每1 mL中含10 μm及10 μm以上的微粒数不得过25粒,含25 μm及25 μm以上的微粒数不得过3粒。结果见表4。配伍液1、5、6已不符合规范要求。

表4 配伍液不溶性微粒变化(≥10 μm,≥25 μm)/(粒/毫升)
3.4含量测定取“2.3”项下配制的伏立康唑各配伍液,按2.1项下色谱条件,分别于0、0.5、1、1.5、2、3、4、6、8 h测其峰面积并计算含量,以0 h含量为100%计算相对百分含量。结果见表5。配伍液1、5、6分别在2 h、3 h、1.5 h含量已下降超过10%,根据《药品注射剂使用指南(2005年版)》有关规定,在静脉注射液中>10%的有效成分被分解,则认为该药品与此溶剂不宜配伍。

表5 6种配伍液中注射用伏立康唑的相对百分含量变化/%
3.5 不同调配方式对伏立康唑残留量的考察按“2.3.1”项下的调配方法A、B、C进行调配,每种调配方法检测10个平行样。对每个空西林瓶,用10 mL相应溶媒反复冲洗3次,转至50 mL容量瓶并用相应溶媒定容。分别取1.0 mL置20 mL容量瓶,用相应溶媒定容,过滤,进样10 μL,计算残留量。
目前,国家尚无针对静脉用药调配后安瓿和西林瓶中残留药量的限度标准,根据2020版《中国药典》(四部)中对于注射剂的罐装规定,参照静脉用药调配中心药品调配的残留量限度标准[7]:注射用无菌粉末标示量0.05 g及其以下,残留量限度不超过标示量的15%;注射用无菌粉末标示量0.05~0.15 g,残留量限度不超过标示量的10%;注射用无菌粉末标示量0.15~0.50 g,残留量限度不超过标示量的7%;注射用无菌粉末标示量0.50 g以上,残留量限度不超过标示量的5%。本实验中所用注射用伏立康唑标示量为0.1 g,即残留量应不超过0.01 g。药液残留量合格率=合格数/检查数量×100%。
采用SPSS 22.0统计软件对数据进行分析处理,计量资料以±s表示,用t检验;计数资料以率表示,用χ2检验。P<0.05为差异有统计学意义。不同调配方法下的残留量合格率均为100%,组间比较,差异无统计学意义(P>0.05)。调配时间:方法A、B、C组间比较,差异有统计学意义(P<0.05)。见表6。
表6 不同调配方法下注射用伏立康唑残留量/(±s,n=10)
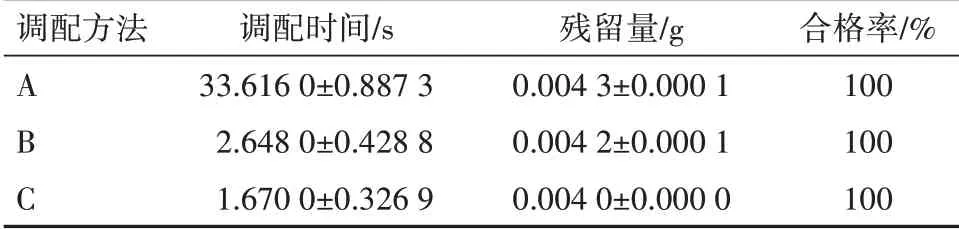
表6 不同调配方法下注射用伏立康唑残留量/(±s,n=10)
调配方法A B C调配时间/s 33.616 0±0.887 3 2.648 0±0.428 8 1.670 0±0.326 9残留量/g 0.004 3±0.000 1 0.004 2±0.000 1 0.004 0±0.000 0合格率/%100 100 100
4 讨论
4.1 溶媒的确认本实验首先按药品说明书的方法进行调配,选用配伍液有5%葡萄糖注射液和0.9%氯化钠注射液。结果表明:伏立康唑与0.9%氯化钠注射液的配伍液在0.5 h出现浑浊,且随时间的延长,由于盐析作用和pH的影响[8],浑浊程度越明显。不溶性微粒在1.5 h已超过《中国药典》(2020年版)微粒检测法中的规定。主药百分含量在2 h下降至86.16%。而伏立康唑与5%葡萄糖的配伍液均符合规范,百分含量在8 h下降至99.77%。根据《药品注射剂使用指南(2005年版)》有关规定,在静脉注射液中大于10%的有效成分被分解,则认为该药品与此溶剂不宜配伍[9-12]。故选用5%葡萄糖注射液作为注射用伏立康唑的首选溶媒。
4.2 调配方法的确定本实验所用伏立康唑配有专用溶剂(乙醇、丙二醇各2.5 mL的混合液),伏立康唑水溶性差,但易溶于有机溶剂。按说明书方法进行调配,调配时间为(33.62±0.87)min,在确定5%葡萄糖注射液为其首选溶媒后,考察“缩短与专用溶剂溶解的时间”对配伍液的影响。结合静脉用药调配中心实际工作情况,本实验另采用了“2.3.1”项下调配方法B和调配方法C,不同调配方法下的残留量合格率均为100%,组间比较,差异无统计学意义(P>0.05)。调配时间组间比较,差异有统计学意义(P<0.05)。调配方法B和C比说明书推荐方法A缩短了近30 min,对提高静脉用药调配中心工作效率有较大意义。但方法B在反复冲洗的过程中,容易往西林瓶注入过多的气体而造成瓶内气压过大,导致药液从橡皮塞的针孔漏出的情况,所以在实际操作过程中,建议选择调配方法C进行调配。且调配方法C下配伍液的外观、pH、不溶性微粒和主药百分含量均符合规范。虽然乙醇、丙二醇能与水混溶,但由于伏立康唑的水溶性差,用专用溶剂溶解伏立康唑至溶液澄清透明后,应缓慢注入5%葡萄糖注射液的可立袋中,使伏立康唑缓慢充分溶解。
4.3 成品输液运送过程振荡作用对伏立康唑稳定性的影响在静脉用药调配中心实际工作中发现,将合格的伏立康唑成品输液送至病区后,仍接到病区反映伏立康唑成品输液出现浑浊。分析原因可能与溶媒瓶PVC材质对药物的吸附有影响,加上伏立康唑的水溶性差也有关,以及在使用运送推车送往病区过程中,难免有外力对输液成品的振荡,从而可能加速了药物析出。故本实验还考察了振荡作用对配伍液的影响,即使用振荡器考察轻度、强度两个挡位的振荡对伏立康唑稳定性的影响。实验发现轻度、强度振摇下的配伍液分别在1.5 h和1 h开始出现浑浊,药物析出结晶,轻度振摇下其百分含量在3 h下降至89.41%,强度振摇下其百分含量在1.5 h下降至88.84%,均已不符合规范。所以在实际工作中,调配好的伏立康唑成品输液应避免振荡,尽快使用,以保证药物的有效性。
