丛枝菌根真菌对茅苍术实生苗生长及根腐病发生的影响
2022-10-25胡开治刘燕琴杨小玉韩蓉蓉
曹 敏,胡开治,刘燕琴,杨小玉,韩蓉蓉,余 米
(1. 重庆市药物种植研究所,重庆 408435;2. 特色生物资源研究与利用川渝共建重点实验室,重庆 408435)
茅苍术(Atractylodes lancea(Thunb.) DC.)为菊科苍术属多年生草本植物,以干燥根茎入药,是商品苍术之上品,其道地产区为江苏茅山[1]。由于野生资源严重匮乏,江苏、重庆、浙江、湖北、四川等地对茅山苍术进行了大量的引种栽培[2]。近年来,太极集团为保证藿香正气液原料用药安全、稳定及产业扶贫需要,先后在重庆市南川区、酉阳县、秀山县等地建设了茅苍术栽培基地。随着栽培年限增加,病害问题日益突出,连作障碍明显。其中,根腐病是目前重庆地区茅苍术栽培危害最严重的病害之一,主要病原菌有尖孢镰刀菌Fusarium oxysporum和茄病镰刀菌F.solani[3]。茅苍术根腐病一旦发生会造成大面积减产,甚至绝收,严重影响药材产量和种植户的积极性[4]。因此,亟须找到行之有效的防治方法解决药农困境,而微生物防治因其具有高效低耗、对环境友好等诸多优点而受到学者们的广泛关注。
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是一类广泛分布于各类型土壤的特殊微生物,能与地球上90%以上的维管植物根系形成“丛枝菌根”(arbuscular mycorrhizae, AM),参与植物的生理代谢,促进植物生长[5-7]。研究表明AMF 在提高植物抗病性方面也表现出了积极作用,已发现的能有效控制植物土传病害的AMF 超过30 种[8]。目前,AMF 在中药材栽培上的应用研究还处于探索阶段,且大多集中在对其产量和质量的影响方面。郭兰萍等[9]研究发现摩西球囊霉(Glomus mosseae)促进苍术营养生长;梁雪飞等[10]还报道幼套球囊霉(G.etunicatum)和扭形球囊霉(G.tortuosum)能提高茅苍术组培苗的成活率,促进其生长和主要挥发油成分的积累。目前,关于AMF 与茅苍术栽培中病害的关系还鲜见报道。本试验以摩西球囊霉G.mosseae、根内球囊霉G.intraradices和幼套球囊霉G.etunicatum为接种菌剂,研究不同的AMF 对茅苍术苗生长发育影响的同时,探索AMF 对茅苍术根腐病发生和抗病相关酶活性的影响,为中药材茅苍术栽培生产中合理利用AMF 防治根腐病以及深入研究AMF 的生防机制奠定理论基础。
1 材料与方法
1.1 材料
供试茅苍术为购自湖北英山茅苍术种植户的当年采集的茅苍术种子。
供试菌剂分别为摩西球囊霉(G.mosseae)、根内球囊霉(G.intraradices)和幼套球囊霉(G.etunicatum)的全培养物,均购自北京市农林科学院植物营养与资源研究所“丛枝菌根真菌种质资源库”,菌种信息见表1。

表1 3 种供试的AMF 菌株Table 1 Three AMF strains used in the investigation
供试病原菌为分离自茅苍术根腐病病株的主要病原菌之一的茄病镰刀菌(Fusarium solani),GenBank 登录号为MW227308。
培养基质为灭菌后的土沙混合物,土沙比为1∶2。沙为过2 mm 筛的粗沙,土为田园土(全氮0.574 g·kg-1,全磷0.172 g·kg-1,全钾16.1 g·kg-1,有机质7.75 g·kg-1,pH 为6.15),土经晒干锤细过2 mm 筛,与沙混匀后灭菌,备用。
1.2 方法
1.2.1 茅苍术种子无菌实生苗培育 2019 年4 月,在重庆市南川区三泉镇沙子坝选择半阴半阳荒坡砂壤土地进行播种。提前将土壤基质用1%甲醛溶液喷洒均匀,覆膜熏蒸10 d,于晴天揭开薄膜,土壤基质晾晒至无甲醛味为止。播种前均匀撒施适量磷肥作为底肥,将土壤翻匀,欠细,顺坡开厢,厢面80 cm。茅苍术种子播种前用0.1%的升汞浸泡10 min,再用无菌水清洗5 次,将灭过菌的种子撒播于彼此隔离的灭菌土壤基质中,出苗后适时除草,常规管理,备用。
1.2.2 试验设计 2020 年4 月在重庆市药物种植研究所温室进行盆栽试验,选取长势良好且一致的1年生茅苍术苗进行,茅苍术苗剪去多余的根系,仅保留2 cm 长,并用多菌灵800 倍液浸泡30 min,栽植到长方形花盆(长60 cm×宽34 cm×高18.5 cm)中,基质和其他材料器具提前经灭菌处理,备用。共设4 个组:以不接种任何AMF 的处理组作为对照记为CK;处理组分别接种3 种AMF(包括G.mosseae、G.intraradices和G.etunicatum),分别记为Gm、Gi和Ge,每个组5 个重复,每个重复20 株茅苍术苗。移栽时先在花盆中装略低于2/3 高度的土沙基质,均匀将50 g 菌剂撒于表面,再将茅苍术苗栽在菌剂表面,继续加入适量的土沙基质,覆盖住茅苍术苗的根系,浇足定根水。各处理组管理一致,每盆每个月浇1 次微量水溶肥(含N、P、K 和微量元素)1 000 倍液500 mL,天气较干热时需随时观察基质表面,若太干要注意及时浇水,避免茅苍术苗缺水死亡。
8 个月后各组选取生长良好的茅苍术苗进行病原菌接种,接种前记为P-,接种后记为P+,每个处理组3 个重复,每个重复15 株茅苍术苗。病原菌F.solani提前进行液体培养备用,接种时稀释为约1×107个·mL-1备用。接种时剪掉多余的根系,仅留5 cm 长,然后置于液体菌剂中静置15 min,再回栽到圆形花盆(底径13.5 cm×高18.5 cm×口径20 cm)中,浇50 mL液体菌剂在根周围,最后覆土沙基质,浇适量定根水。
1.2.3 测定项目与方法 接种病原菌前随机取样进行各项基本生长指标检测,包括菌根侵染率、株高、叶片数、叶面积、根茎鲜重和干重等,分析AMF 对茅苍术生长的影响。叶面积使用CID Bio-Science 叶面积仪(CI-203)进行扫描,菌根侵染率采用墨水醋染色法测定[11],菌根依赖性计算参照Menge 等[12]的方法。
菌根侵染率=(0×根段数+10×根段数+20×根段数+30×根段数+…+100×根段数)/观察总根段数×100%
菌根依赖性(MD)=菌根苗营养生长量/对照茅苍术苗生长量×100%
各处理组于接种病原菌前和接种7 d 后,分别取根样检测几丁质酶(chitinase)、苯丙氨酸解氨酶(PAL)和β-1, 3-葡聚糖酶(β-1, 3-glucanase)活性,3 种酶活性均使用酶检测试剂盒(上海泛柯实业有限公司)进行测定。1 个月后统计病死率、发病率和病情指数。

1.2.4 数据统计分析 采用Excel、Graphad Prism 7等软件进行数据统计分析和作图。
2 结果与分析
2.1 不同AMF 对茅苍术苗根系的侵染能力
茅苍术苗接种病原菌前,接种Gm、Gi 和Ge的菌根侵染率分别为60.44%、52.33%和55.89%,对照组未检测到AMF 侵染(表2)。3 种AMF 对茅苍术根系的侵染能力不同,说明AMF 与茅苍术之间有一定的偏好性,具体侵染情况见图1。

图1 茅苍术根系AMF 侵染情况Figure 1 The infection of AMF in roots of A. lancea (Thunb.) DC.
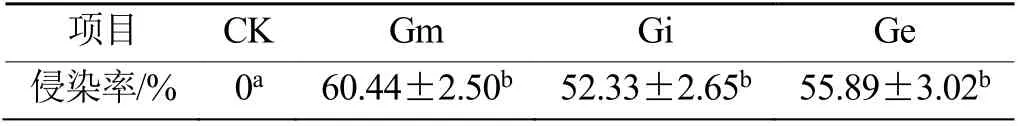
表2 丛枝菌根真菌对茅苍术菌根侵染率Table 2 The colonization of AMF on A. lancea (Thunb.) DC.
2.2 不同AMF 对茅苍术苗营养生长的影响
由表3 可知,接种Gm 菌株的处理组株高、茎基粗、芽点个数、叶片数和最大根系长均显著高于对照组(P<0.05),其叶面积略高于对照组,但差异不显著(P<0.05)。接种Gi 菌株的处理组各项营养生长形态指标均显著高于对照组(P<0.05);而Ge组的株高、茎基粗、芽点个数、叶面积、叶片数和最大根系长与对照组相比,分别增加了37.85%、37.60%、114.29%、58.35%、73.79%和85.80%。说明接种3 种AMF 总体上提高了茅苍术苗的生长形态指标,以Ge 促进效果最为显著,其次为Gi 和Gm。
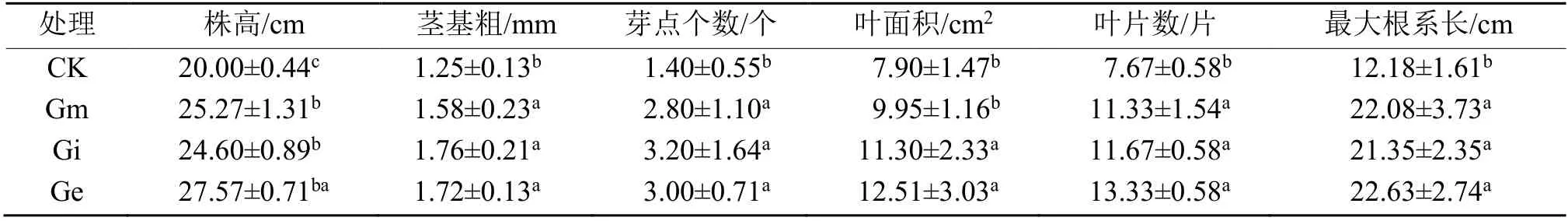
表3 接种病原菌前AMF 对茅苍术苗生长的影响Table 3 Effects of AMF on the growth of A. lancea (Thunb.) DC. seedlings before infection with F. solani
如表4 所示,与对照相比,3 种AMF 处理组茅苍术苗的地下部分鲜重和干重均显著高于对照组,表明接种3 种AMF 均能提高茅苍术苗地下部分质量,其中Gm 效果最佳,其次为Ge 和Gi。茅苍术苗地下部分鲜重和干重对Gm 的菌根依赖性分别达260.34%和285.45%,这与菌根侵染率的规律一致,表明AMF 很可能是通过菌根结构促进了茅苍术的生长。结果表明Gm 对茅苍术苗地下部分物质积累促进作用更大。

表4 3 种AMF 对茅苍术苗生长质量指标的影响Table 4 Effects of three AMF on growth indexes of A. lancea (Thunb.) DC. seedlings
2.3 AMF 对茅苍术苗根腐病发生情况的影响
由表5可知,接种F.solani1个月后未接种AMF的CK 组根腐病发病率最高,达66.67%;而接种Gm、Gi 和Ge 的处理组均在一定程度上降低了茅苍术根腐病的发病率和病情指数。其中Gm 和Ge 组根腐病的发病率降低了35.01%,且与CK 间差异显著(P<0.05);Gi 组发病率降低了15.00%,但未达显著性差异(P<0.05)。表5 还显示了CK 组的病情指数最高,为52.96;接种Gm、Gi 和Ge 均降低了茅苍术根腐病的病情指数,且均达到显著性差异(P<0.05),病情指数由低到高依次为Ge<Gm<Gi。3 种AMF 对茅苍术苗根腐病均有一定的防治效果,其中G.mosseae和G.etunicatum防治效果较好,防效均大于50%,其次为G.intraradices。

表5 接种病原菌后茅苍术根腐病的发病情况及AMF 防治效果Table 5 Incidence of root rot of A. lancea (Thunb.) DC. after inoculation with pathogens and the control effect of AMF
2.4 AMF 对茅苍术根系抗病相关酶活性的影响
各试验组茅苍术接种病原菌前后根系抗病相关酶活性的变化见图2、图3 和图4。由图2 可知,接种病原菌前Gm 和Ge 组的茅苍术根系PAL 酶活性略高于对照组,Gi 组的茅苍术根系PAL 酶活性略低于对照组,但各处理组间PAL 酶活性差异不显著(P<0.05)。接种病原菌7 d 后对照组PAL 酶活性降低,而Gm、Gi 和Ge 处理组接种病原菌后PAL酶活性均升高,PAL 酶活性Gm>Ge>Gi>CK,其中Gm 组PAL 酶活性显著高于对照组(P<0.05)。说明接种AMF能提高茅苍术苗根系的PAL酶活性。
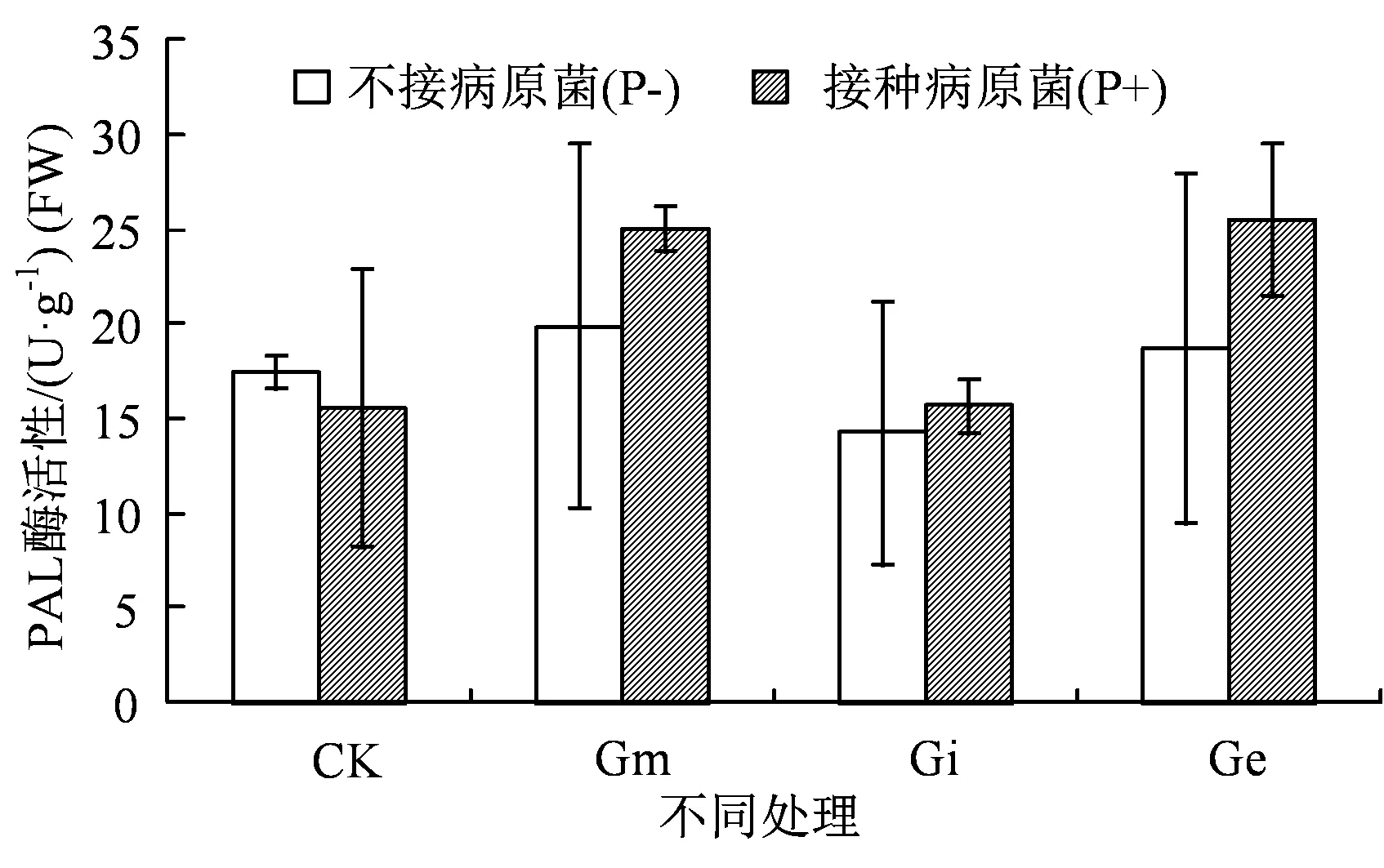
图2 接种AMF 和病原菌对茅苍术根系PAL 酶活性的影响Figure 2 Effects of AMF and pathogenic on PAL enzyme activity in roots of A. lancea (Thunb.) DC.

图3 接种AMF 和病原菌对茅苍术根系β-1,3-葡聚糖酶活性的影响Figure 3 Effects of AMF and pathogenic on β-1,3-glucanase enzyme activity in roots of A. lancea (Thunb.) DC.

图4 接种AMF 和病原菌对茅苍术根系几丁质酶活性的影响Figure 4 Effects of AMF and pathogenic on chitinase enzyme activity in roots of A. lancea (Thunb.) DC.
图3 表明,接种病原菌前Gm、Gi 和Ge 组的茅苍术根系β-1,3-葡聚糖酶活性均略高于对照组,但各处理组间β-1,3-葡聚糖酶活性差异不显著(P<0.05)。接种病原菌7 d 后对照组β-1,3-葡聚糖酶活性低于接种前,而Gm、Gi 和Ge 处理组接种病原菌后PAL 酶活性均高于接种病原菌前,且显著高于对照组(P<0.05)。说明接种AMF 能提高茅苍术苗根系的β-1,3-葡聚糖酶活性。
由图4 可知,接种病原菌前Gm、Gi 和Ge 组的茅苍术根系几丁质酶活性均略高于对照组,但各处理组间几丁质酶活性差异不显著。接种病原菌7 d后对照组几丁质酶活性降低,而Gm、Gi 和Ge 处理组接种病原菌后PAL 酶活性均较接病原菌前升高,且显著高于对照组。说明接种AMF 能提高茅苍术苗根系的几丁质酶活性。
3 讨论
3.1 AMF 与茅苍术根系共生良好且具有一定的偏好性
前期研究发现茅苍术根际土壤中AMF 资源丰富,其中Glomus为优势属[13]。本研究从Glomus属中选择在其他植物上已表现出良好共生效应的3 种AMF,研究其与茅苍术间的共生情况。结果表明G.mosseae、G.intraradices和G.etunicatum对茅苍术均表现出了较高的侵染水平。杨光等报道不同的AMF 对同一药用植物间侵染差异较大[14],与之研究结论一致,本试验结果也表明不同的AMF 与茅苍术根系间的共生存在差异,3 种AMF 对茅苍术根系的侵染率为G.mosseae>G.etunicatum>G.intraradices。因此,如若仅考虑共生亲和性,G.mosseae更适合作为茅苍术栽培的接种菌剂,这与郭兰萍[9]、梁雪飞[10]等的研究结论一致,说明G.mosseae与茅苍术根系共生的偏好性是普遍存在的。但在实际生产中,不同的环境下AMF 与茅苍术的共生效应是否一致,有待进一步研究。
3.2 AMF 对茅苍术营养生长的促进作用
大量研究已证实AMF 能促进其宿主植物的营养生长[9-10,15-16],前人初步研究[10]已发现茅苍术对AMF 有很高的菌根依赖性,接种摩西球囊霉(G.mosseae)可以促进苍术根系对土壤养分的吸收,提高苍术根际土壤微生物的多样性及代谢活性,促进苍术的营养生长和苍术苗挥发油的积累。本研究通过给1 年生茅苍术种子苗分别接种G.mosseae、G.intraradices和G.etunicatum3 种AMF,研究其对茅苍术苗生长的影响,发现3 种AMF 均能很好地侵染其根系,形成菌根。3 种AMF 均能显著提高茅苍术苗的株高、茎基粗、芽点个数、叶面积、叶片数和最大根系长,促进其营养生长,增加地下部分的鲜重和干重。究其原因,可能是由于AMF 能以其庞大的菌丝网络系统将植物与土壤有机地联合起来,促进植物对矿质营养和水分的吸收,增强植物体内的代谢活动,这与前人研究结论一致。本试验结果表明,AMF 对茅苍术苗有较好的促生效应,其中G.mosseae和G.etunicatum的对茅苍术的促生效果优于G.intraradices。
3.3 AMF 对茅苍术根腐病发生及抗病相关酶活性的影响
AMF 是陆地生态系统中的关键微生物之一,已有研究表明AMF 在抗植物土传病害方面具有很大的潜力,前提是病原物入侵之前AMF 与植物间已形成菌根并发育良好[17]。郭开发等[18]报道摩西球囊霉可有效地防治番茄根腐病,具有较好的应用前景。本试验以分别接种G.mosseae、G.intraradices、G.etunicatum的菌根苗和不接种AMF 的茅苍术为材料,研究AMF 对茅苍术苗根腐病的抗病潜力,结果发现3 种AMF 对茅苍术苗根腐病均有一定的防治效果。与对照组相比,G.mosseae和G.etunicatum均能显著降低茅苍术苗根腐病的发病率、病死率和病情指数,防效分别为53.15%和62.91%;而接种G.intraradices防治效果一般,防效为34.97%。
前人的研究[17]表明AMF 能激活植物的防御反应来抵抗病原物的进攻,包括苯丙氨酸解氨酶(PAL)、β-1,3-葡聚糖酶和几丁质酶等。这3 种酶均是植物抗病相关的防御酶,其中苯丙氨酸解氨酶(PAL)是植物次生代谢,特别是本丙烷途径的关键酶和限速酶;而几丁质酶和β-1,3-葡聚糖酶能通过水解真菌细胞壁,抑制病原物的生长。杨立研究发现,双接种AMF 和病原菌能显著提高丹参PAL、几丁质酶和β-1,3-葡聚糖酶活性[19]。王倡宪等[20]也发现G.versiforme和G.intraradices能诱导几丁质酶、β-1,3-葡聚糖酶和几丁质酶活性,从而减轻黄瓜苗期由Fusarium oxysporum引起的枯萎病。与之结论一致,本试验结果表明,当受到病原菌侵染时,接种G.mosseae、G.intraradices和G.etunicatum的茅苍术菌根苗PAL、β-1,3-葡聚糖酶和几丁质酶活性显著提高。接种病原菌7 d 时,茅苍术菌根苗的3种酶活性均高于接种前,而对照组的非菌根苗的酶活性低于接种病原菌前。这可能是由于非菌根苗受到F.solani侵入后不断生长,逐步侵染到维管柱中,破坏了茅苍术根系的防御体系,而导致的防御酶活性下降;而菌根苗受到F.solani入侵时,AMF 激发其根系的防御反应,如几丁质酶和β-1,3-葡聚糖酶活性的增强,将病原菌菌丝逐步瓦解在表皮和皮层组织,从而减轻根腐病的发生和发病程度[17]。
4 结论
G.mosseae、G.intraradices和G.etunicatum对茅苍术苗根腐病均有一定的防效。苗期接种AMF可显著促进茅苍术苗的营养生长和地下部分的物质积累,与非菌根化苗相比,接种F.solani7 d 后,菌根化苗根系PAL、几丁质酶和β-1,3-葡聚糖酶活性显著高于对照,说明AMF 在一定程度上提高了茅苍术幼苗的抗病性,即AMF 对茅苍术根腐病有一定的抗病潜力。但不同的AMF 防治效果不同,以G.etunicatum和G.mosseae对茅苍术苗根腐病的抗病效果较好,而G.intraradices防治效果不显著。因此,今后可将G.etunicatum和G.mosseae可作为茅苍术根腐病防治的备选生物菌剂,进行更深入的研究与应用。
