42例PD-1抑制剂药品不良反应分析及文献回顾*
2022-10-25徐翠香王建华
周 楠,屈 杰,徐翠香,刘 屹,王建华△
(1.陕西省人民医院,陕西 西安 710068;2.延安大学医学院,陕西 延安 716099)
近年来,免疫检查点抑制剂(ICI)在抗肿瘤治疗中取得了突破性进展。与传统化学药物治疗(简称化疗)药物直接杀伤肿瘤细胞不同,ICI通过特异性结合细胞毒性T淋巴细胞抗原4(CTLA-4)、程序性细胞死亡受体1(PD-1)及其配体(PD-L1)阻断免疫检查点通路,重新激活T淋巴细胞介导的抗肿瘤免疫,打破免疫耐受,逆转免疫逃逸,从而促进肿瘤细胞凋亡[1]。其中,PD-1抑制剂的代表药物有纳武利尤单抗、帕博利珠单抗、特瑞普利单抗等,并已被证实对黑色素瘤、非小细胞肺癌、淋巴瘤、尿路上皮癌、头颈部肿瘤、结直肠癌及肝癌等的疗效良好。随着PD-1抑制剂在各类恶性肿瘤治疗中的广泛应用,其药品不良反应(ADR)尤其是免疫相关不良事件(irAE)逐渐引起关注和重视。本研究中就PD-1抑制剂引起的42例ADR报告以及检索出的ADR案例进行回顾性分析。现报道如下。
1 资料与方法
1.1 资料来源
收集某院2016年至2020年上报至国家药品不良反应监测中心的PD-1抑制剂ADR报告42例。
1.2 方法
参考药品说明书,对42例PD-1抑制剂ADR报告按患者的性别、年龄、超适应证用药及ADR发生情况、给药途径、临床转归进行汇总分析。以“ICI”“ADR”“irAE”“卡瑞利珠单抗”“帕博利珠单抗”“特瑞普利单抗”“替雷利珠单抗”“信迪利单抗”“药品不良反应”等为关键词,分别检索PubMed、ScienceDirect、Web of Science数据库(自建库起至2021年8月1日),收集国内外文献报道的ADR案例,总结其的发生因素、常见症状、治疗策略并提出使用建议。
2 结果
2.1 报告基本情况
患者性别与年龄:42例ADR报告涉及42例患者,其中男27例,女15例,以40岁及以上人群为主。详见表1。
超药品说明书使用情况:42例ADR涉及5种PD-1抑制剂,其中27例存在超药品说明书使用情况。详见表2。
ADR发生情况:42例ADR累及多个器官/系统,其严重程度根据常见不良事件评价标准(CTCAE)5.0版分级[2]。具体分布见表3。

表1 患者性别与年龄分布(n=42)Tab.1 Distribution of the patients′gender and age(n=42)

表2 超适应证用药情况(n=27)Tab.2 Off-label indication drug use(n=27)

表3 ADR累及器官/系统及分级(n=42)Tab.3 Organs/systems involved in ADR and their gradation(n=42)
临床表现:卡瑞利珠单抗引发皮肤毛细血管增生ADR比例较大,其次为皮疹、尿路感染;信迪利单抗ADR一般表现为发热、甲状腺功能减退(简称甲减)、肌痛、胃肠道反应以及骨髓抑制等;帕博利珠单抗引起皮疹及甲减占比稍多,特瑞普利单抗及替雷利珠单抗诱发皮肤类ADR各2例。详见表4。

表4 ADR临床表现(n=42)Tab.4 Clinical manifestation of ADR(n=42)
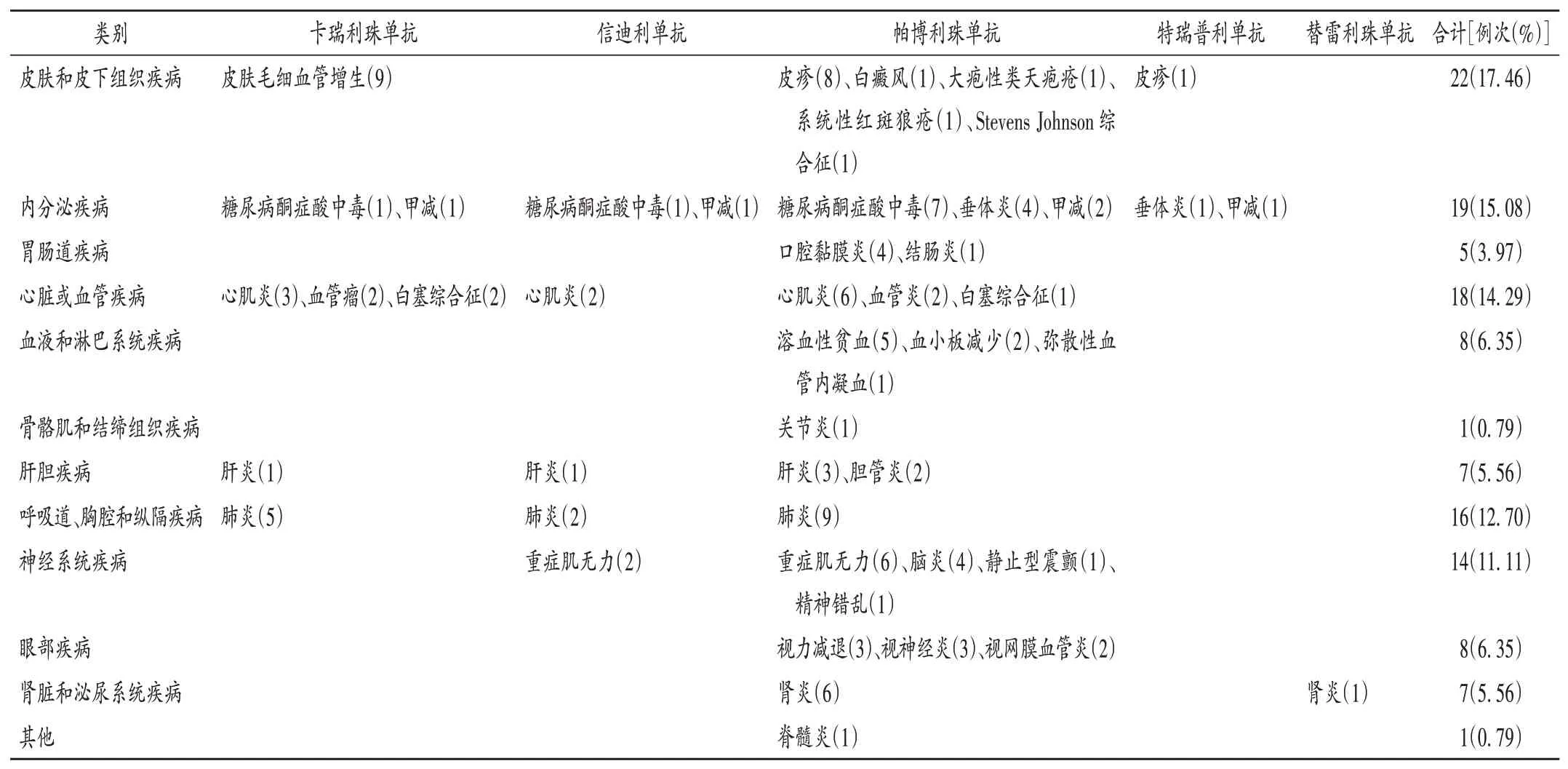
表5 文献报道ADR汇总(n=126)Tab.5 Summary of ADR reports in the literature(n=126)
给药途径及转归:42例ADR报告均经静脉给药。好转27例,痊愈1例,未好转10例,不详4例。
2.2 文献回顾
共检索得相关ADR 126例次。针对卡瑞利珠单抗及帕博利珠单抗的ADR案例报道较常见,其中卡瑞利珠单抗引发免疫性皮肤毛细血管增生比例较高;帕博利珠单抗报道的案例最多见,包含的ADR种类也较繁杂,免疫相关性皮肤和皮下组织疾病、内分泌疾病及肺炎报道较多。而针对特瑞普利单抗、替雷利珠单抗及信迪利单抗的ADR案例报道较为少见,可能与其应用较少有关。详见表5。
3 讨论
3.1 ADR相关因素
患者年龄与性别:本研究中,男性ADR发生率明显高于女性。有研究指出,女性及在免疫治疗前使用类固醇激素为发生ADR的保护因素[2-3]。年龄方面,40岁以上中老年人ADR发生率高,这与文献报道结论类似,年龄≥40岁为PD-1抑制剂治疗后发生ADR的独立危险因素[4],这与该年龄段人群肿瘤罹患基数大、机体功能下降、自身基础疾病及多重用药有关[5]。
超药品说明书用药:本研究中,超适应证用药占比达64.29%。超药品说明书用药在临床上普遍存在,而导致超药品说明书用药现象的根本原因是药品说明书的更新滞后于临床实践的发展。超药品说明书用药具有一定程度上的前瞻性,但风险较高,以及存在法律等方面的风险。在ICI的使用上,相关研究并未完善,超药品说明书用药可能会升高ADR发生率。
其他:PD-1抑制剂治疗后ADR的发生与患者多种身体参数相关,包括体质量指数(BMI)、血细胞计数、激素变化、抗体水平以及其他生物学指标[6-9]。另外,自身存在免疫性疾病史、3级及以上(英国肾脏协会)肾功能受损等病史是发生irAE的危险因素[10]。
3.2 常见或特殊ADR及其处理
本研究中,5种PD-1抑制剂抗肿瘤药物的ADR案例中,皮肤和皮下组织疾病、内分泌疾病发生率均较高。皮肤毒性是PD-1 ICI最常见的irAEs,皮肤毒性一般在最初2个治疗周期内发生,发生率为17%~40%,与药品说明书中一致[11]。常见的卡瑞利珠单抗皮肤ADR是反应性毛细血管增生症,帕博利珠单抗、信迪利单抗、特瑞普利单抗及替雷利珠单抗常引起皮疹及瘙痒等,但仍需注意,文献报道了4例关于帕博利珠单抗诱发白癜风、大疱性类天疱疮、系统性红斑狼疮及Stevens-Johnson综合征等较严重的皮肤反应[12-15]。PD-1抑制剂内分泌毒性最常见于甲状腺功能障碍,而1型糖尿病则相当罕见[11]。本研究中收集到的ADR病例均为甲减,但案例报道中除甲减外,糖尿病酮症酸中毒及垂体炎发生亦不罕见。其中帕博利珠单抗诱发糖尿病酮症酸中毒的病例数量较突出,7例患者均无糖尿病史,但在使用帕博利珠单抗后诱发了1型糖尿病[16-22]。其次,收集到的ADR报告以发热/胃肠道反应多见,这与药品说明书及其他针对PD-1抑制剂ADR的综合荟萃分析的结论一致。但文献案例报道中,免疫相关性肺炎/心肌炎/神经炎/肝炎较多[23-31]。PD-1抑制剂单药治疗引起的任何级别的肺炎发生率均<5%,而高级别的肺炎发生率约为1%,免疫相关的肝毒性通常较轻,其发生率低于胃肠道毒性及皮肤毒性,而神经毒性、血液毒性、心脏毒性等发生率较低(<1%)[11]。这考虑案例文献报道多以新的或严重ADR为主,而日常收集的ADR报告仍以发生率较高为主。提示在使用PD-1抑制剂时,皮肤/发热/胃肠道/内分泌系统的ADR发生率较高,但随着PD-1抑制剂的广泛使用,其他irAE并不罕见,如信迪利单抗及帕博利珠单抗诱发重症肌无力的案例报道较多,卡瑞利珠单抗、信迪利单抗及帕博利珠单抗有关免疫相关性肺炎、心肌炎或血管炎的报道较多,应注意用药监护及时应对。此外,药品说明书中标注的常见ADR症状——疲乏,本研究中未涉及,这可能是由于疲劳程度多处于1~2级,无须暂停使用PD-1抑制剂,因其干扰因素多,危害小,无须使用药物干预,故不是案例报道或ADR上报的重点内容。
皮肤和皮下组织疾病:皮肤不良反应是ICI日常使用中最常见的irAE,主要表现为皮疹、瘙痒、白癜风等。本研究中,5种抗肿瘤药物均引发皮疹,皮疹ADR数量占比较大,大多数皮肤ADR程度轻微,可局部使用皮质类固醇或抗组胺药治疗;对于2级以上皮肤ADR,中国临床肿瘤学会(CSCO)免疫检查点抑制剂相关的毒性管理指南建议可考虑暂停ICI用药,并使用强的松0.5~1 mg/(kg·d)。多数皮肤毒性较短暂,5~6周即可痊愈[32],基本不影响ICI的继续使用。值得注意的是,卡瑞利珠单抗作为唯一获批肝癌适应证的国产PD-1抑制剂,患者免疫性皮肤毛细血管增生症的发生率高达66.8%,联合抗血管生成药可降低其发生率[33]。
胃肠道疾病:研究显示,PD-1抑制剂相关腹泻发生率为16.0%[34],其他常见消化道ADR包括恶心呕吐、腹痛、血便、结肠炎等。本研究中收集到的ADR中,消化道类ADR数量较少,可能与收集的总例数较少有关,信迪利单抗引起恶心呕吐2例,特瑞普利单抗引起食欲不振1例。消化道ADR的处理原则是尽早识别、及时足量治疗、快速升级、改善预后。中重度消化道ADR的主要治疗方式为应用糖皮质激素,必要时使用英夫利西单抗(IFX)或维多株单抗[35]。对于激素、IFX、维多株单抗均无效的难治性消化道ADR,有病例报道显示肠道菌群移植治疗有效[36]。
内分泌疾病:本研究中信迪利单抗和帕博利珠单抗均可导致甲减,与其他ADR相比,内分泌系统ADR通常是不可逆的,会造成腺体永久性损害。常见的ADR有甲状腺功能不全、垂体炎、甲状旁腺功能减退以及1型糖尿病等,其发生时间通常在用药后的第5~36周,中位发生时间为第9周[37]。治疗策略主要是基于缺乏激素的替代治疗,不推荐使用其他形式的免疫调节治疗。
一般病情和用药部位的表现(发热):5种PD-1抑制剂在给药方式中都要求不可采用静脉推注或快速静脉注射给药,一般要求输注时间为30~60 min。42例ADR中,有5例输注时或之后发生发热,考虑为输液反应,在给予物理降温、地塞米松、赖氨匹林对症治疗后均好转。理论上应用ICI发生输注反应概率约为10%[38],输液反应发生时临床症状是相似的,常表现为皮肤潮红、发热、发痒、心悸、皮疹、呼吸困难,严重者可出现休克甚至死亡。一旦发生输液反应,应立即停止输液,维持静脉通路并评估患者的气道、呼吸、循环以及意识水平,给予氧气吸入,必要时应用糖皮质激素等药物。待病情稳定后,继续监测患者生命体征并做好记录[39]。
其他irAEs:本研究中,卡瑞利珠单抗引起心肌炎1例,ICI相关性心肌炎发生率为0.09%~2.40%,病死率为27%~60%,是最危险的irAE[40]。免疫相关性ADR报道较多,其中,82.4%好转,17.6%发生死亡或未好转。因此,一旦确诊心脏损伤后应立即停用ICI,并迅速给予大剂量类固醇激素[41]。注意心脏ADR恢复后,ICI的使用需慎重。
接受PD-1抑制剂治疗患者肝脏irAE的发生率为0.7%~2.1%[42],其临床症状为发热、乏力、恶心及黄疸等,部分患者也可能并无临床症状。出现免疫相关性肝损伤,推荐使用大剂量类固醇激素,无效者可改用吗替麦考酚酯[43]。本研究中仅1例信迪利单抗引起的肝功能减退,给予泼尼松后好转。
此外,2.7%~3.5%接受ICI治疗的患者会出现免疫相关性肺炎,主要临床症状为干咳、呼吸困难、缺氧、胸部不适、发热等;影像学表现为磨玻璃样阴影或间质性肺炎[44]。其治疗策略为立即停药并使用全身类固醇和免疫抑制药物。本研究中未收录免疫相关性肺炎ADR,可能与收集病例数较少有关。
3.3 ICI合理用药建议
在选择ICI时,应严格遵守指南,选择已获批且符合适应证的相应药物。在治疗开始之前,建议完善基线检查[45]。基线的影像学检查结果有助于判断甲状腺、垂体和肺等器官的毒性。有报道显示,影像学检查可及时发现74%的irAE[46]。另外,在整个免疫治疗期间,都应密切监测,因为irAE可能在任何时候发生,包括在治疗开始时,在治疗期间,甚至在治疗结束后。建议在停止免疫治疗后继续监测1年,做到早发现,早治疗。一旦发现出现irAE,可根据患者具体情况参考美国国立综合癌症网络(NCCN)指南、CSCO指南等及时采取治疗措施。
肿瘤免疫治疗的出现为癌症患者带来了新的希望,同时ICI疗法也暴露出很多不足,包括总体治疗应答率低下、获得性耐药、发生ADR等。目前,联合用药是提高ICI治疗应答率的主要方向,但治疗药物的增加势必引发更多ADR。需关注ICI治疗中常见ADR,如累及皮肤/胃肠道/内分泌系统的ADR,更要警惕新的或严重ADR,特别是irAE,提前做好应对措施,减少药源性损害。同时,一些严重的irAE发生,导致不得不停止用药,甚至对患者造成了更严重的伤害,需医务人员做好早预防、早识别和规范治疗ADR,以提高ICI临床疗效,减少ADR的发生。
