苯妥英固体分散体3种制备方法比较
2022-10-25饶秋红刘莺燕李庆国罗丹冬丘振文
饶秋红,刘莺燕,李庆国,罗丹冬,丘振文△
(1.广州中医药大学第一附属医院药学部,广东 广州 510405;2.湖北省当阳市第一人民医院,湖北 当阳 444100;3.广州中医药大学中药学院,广东 广州 510006)
固体分散体(SD)是将难溶性药物分散于一种或多种高分子聚合物中形成的分散体系[1]。该技术已广泛用于提高难溶性药物的溶出性能,通过转变药物的形态、减小药物的粒径、增大药物的比表面积及减小药物的边界层厚度等方式改善药物的溶出性能[2]。苯妥英为临床常用抗心律失常药,其属生物药剂学分类系统(BCS)Ⅱ类药,典型的高熔点难溶性药物(熔点296℃,水中溶解度为0.027 1 g/L),极低的溶解度和溶出度限制了其临床应用[3]。本研究中以聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(Soluplus)为辅料,分别采用喷雾干燥技术、热熔挤出技术、共喷共挤技术制备苯妥英SD(含量为20%),并通过X射线粉末衍射(XRPD)法和差示扫描量热分析(DSC)法分析其物相状态,以热台显微镜观察其热熔状态,溶出度和表观溶解度试验考察其溶出性能,以及稳定性试验考察其稳定性。对比3种制备方法的优劣及制得样品的理化性质,探索提升高熔点难溶性药物的溶出性能和稳定性的方法,为制备相应药物的SD提供参考。现报道如下。
1 仪器与试药
仪器:BUCHI B290型喷雾干燥仪(瑞士Buchi公司);HAAKE MINICTW型热熔挤出机(美国Thermo Scientific公司);D8Advance型X射线衍射仪(德国Bruker公司);DSC-60型差示扫描量热仪(日本Shimadzu公司);ZRS-8G型智能溶出度试验仪(天津天大天发科技有限公司);恒温振荡水槽(上海精宏实验设备有限公司);EL204型电子天平(瑞士Mettler Toledo公司,精度为十万分之一);Thermo ACCELA型超高效液相色谱仪(美国Thermo Scientific公司);X-4数字显示显微熔点测定仪(郑州予华仪器有限公司)。
试药:苯妥英原料药(API,朗德化学品科技有限公司,批号为201901,含量为98.5%);Soluplus(德国BASF公司,批号为36369336WO);乙腈为色谱纯,丙酮为分析纯,水为纯化水。
2 方法与结果
2.1 固体分散体制备
喷雾干燥技术:将1 g苯妥英API和4 g Soluplus混合均匀(物理混合物,样品S1),溶于100 mL的丙酮-水(9∶1,V/V)溶液,采用喷雾干燥仪喷雾(喷雾条件:入口温度85℃,流速3 mL/min,出口温度60~70℃)干燥,收集干粉,即得样品S2。
热熔挤出技术:使用双螺杆热熔挤出机,挤出温度160℃,转速100 r/min,预热5 min后加入样品S1,挤出,冷却,粉碎,过200目筛,即得样品S3。
共喷共挤技术:取样品S2适量,按热熔挤出方法挤出,冷却,粉碎,过200目筛,即得样品S4。
2.2 高效液相色谱(HPLC)条件
色谱柱:BDS Hypersil C18柱(50 mm×2.1 mm,2.4 μm);流动相:乙腈-水(35∶65,V/V);流速:400 μL/min;检测波长:254 nm;柱温:35℃;进样量:5 μL。
2.3 外观性质
样品S2为白色疏松固体粉末;样品S3外观不透明,显暗黄色,表面有光泽,呈圆柱形条状物,药物可能以部分微晶形式分散于载体中;样品S4外观透明,显亮黄色,呈典型玻璃态圆柱形条状物,为单一均相无定形固体分散体。详见图1。

图1 固体分散体外观性质A.Sample S2 B.Sample S3 C.Sample S4Fig.1 Appearance properties of solid dispersions
2.4 理化性质分析
XRPD分析:采用X射线衍射仪,测试条件为铜靶,管电流40 mA,管电压40 kV,步长0.02°,扫描范围5~30°。将样品S2-S4及API均匀置塑料盘中压平,放入样品台操作。结果见图2。可见,API具有明显的结晶特征 峰(如8.40°,11.22°,12.83°,16.53°,18.04°和22.22°等),表明其晶型结构较强。样品S2无明显结晶特征峰,表明其为无定形态;样品S3存在少量衍射峰,表明其中存在部分微晶,与图1B挤出物的非透明状态结果一致;样品S4无晶体衍射峰,证明通过喷雾干燥后再进行热熔挤出,可制备出无定形SD。
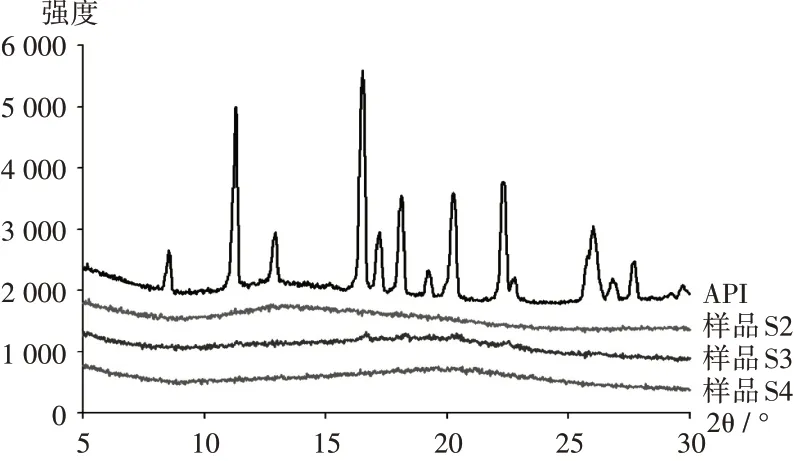
图2 X射线粉末衍射图Fig.2 XRPD pattern
DSC分析:称取样品S2-S4及API各3~5 mg,置坩埚中,以α-氧化铝坩埚作参比,采用差示扫描量热仪,升温速率10℃/min,温度范围50~350℃。结果见图3。可见,在296℃时API有尖锐的熔化吸热峰,样品S2-S4均未见明显的熔融峰,其中样品S4在126℃左右有明显的结晶峰。结果提示,不同方法制备的样品,药物在Soluplus中高度分散,形成SD。
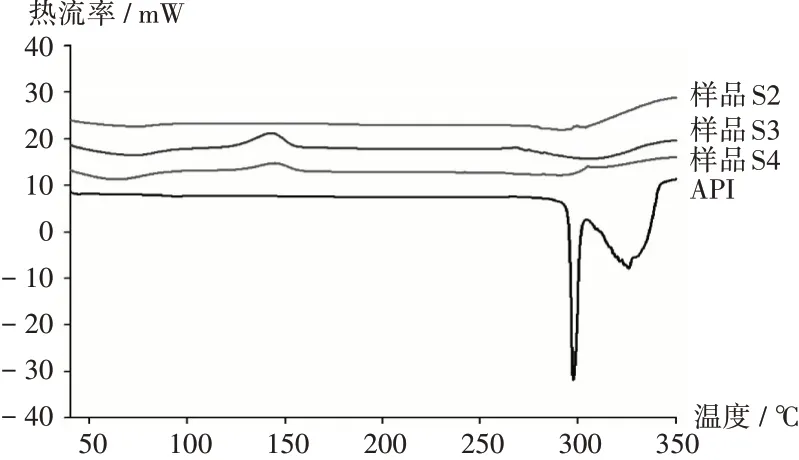
图3 差示扫描量热法图谱Fig.3 DSC atlas
热台显微镜分析:显微镜下分别观察样品S1-S4在40~300℃范围内药物和辅料的混合状态。温度为160℃时的样品显微图见图4。可见,160℃时,样品S1为明显的固体状态,即药物在无外力作用下为结晶固态,未发生相变。样品S2为熔融状态,说明喷雾干燥工艺有利于药物和辅料的相容作用。样品S3为熔融状态,表明药物在载体中高度分散;在热熔挤出过程中,剪切力加速了药物和辅料的相互作用,形成了部分微晶的状态。样品S4熔融得更好,表明相比于使用单一技术,样品经喷雾干燥后再热熔挤出相容性更佳。

图4 热台显微镜显微图(160℃)A.Sample S1 B.Sample S2 C.Sample S3 D.Sample S4Fig.4 Micrograph under hot stage microscope(160℃)
溶出度:参照2020年版《中国药典(四部)》第二法(桨法),取样品S1-S4及API(含苯妥英3 mg)各适量,精密称定,加入1 000 mL含0.2%十二烷基硫酸钠的水溶液中,在温度(37±0.5)℃下,75 r/min转动5,10,20,30,45,60 min时分别取1 mL溶液(补充等量的溶出介质),过0.45 μm微孔滤头后进行HPLC分析。样品溶出曲线见图5。可见,API和样品S1的溶出度结果相似,且在60 min内溶出率均低于20%,表明Soluplus对API的增溶作用有限;样品S2,S3,S4在60 min时的溶出率分别为51%,60%,64%,其中样品S2在10 min内溶出率增长更快,可能跟喷雾干燥固体分散体密度和表面积有关;而样品S3和S4溶出情况基本一致,虽然S3含有少量微晶,但对其溶出并无显著影响,而样品S4在30 min后溶出率较高。
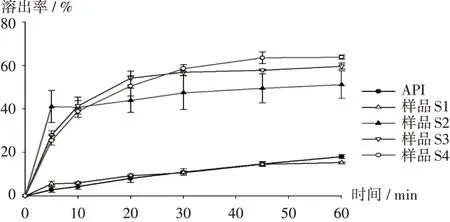
图5 样品溶出曲线(n=3)Fig.5 Dissolution profiles of samples(n=3)
表观溶解度:取样品S1-S4及API(含苯妥英8 mg)各适量,精密称定,置50 mL水溶液中,放入水浴恒温振荡器中振荡[60 r/min,(37±0.5)℃],于10,20,30 min以及1,2,4,24,48 h时取1 mL溶液(补充等量的溶出介质)过0.45 μm微孔滤头后进行HPLC分析。样品表观溶解度见图6,可见,API及样品S1的表观溶解度较低,表明辅料对原料药的增溶效果有限。在24 h时,样品S2,S3,S4与API的溶解度相比,分别提高1.66倍、1.94倍和2.00倍,且在48 h时均能维持较高的药物浓度。说明使用Solulplus为载体抑晶效果好,在过饱和状态中药物浓度仍可维持在较高水平,能增强药物在体内的吸收。
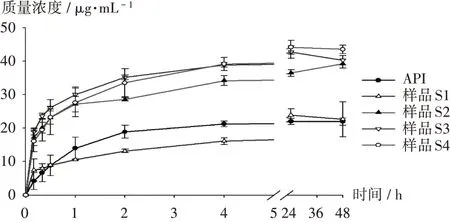
图6 样品表观溶解度(n=3)Fig.6 Apparent solubility of samples(n=3)
稳定性考察:取样品S2-S4各适量,放入干燥器中常温存储,12个月后,于温度25℃、相对湿度60%下进行XRPD表征,结果见图7。可见,样品S2出现微晶;而原本含少量微晶的样品S3较稳定;样品S4保持无定形状态,稳定性较好。
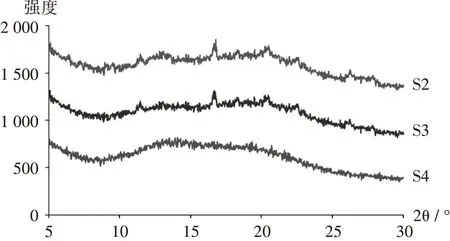
图7 样品稳定性Fig.7 Stability of samples
3 讨论
高熔点药物在较低温度下直接挤出,药物未熔融,多以微晶形式分散于载体中,一般难以得到无定形SD。SERENA等[4]指出,高熔点化合物相比于低熔点化合物更难被吸收,熔点增加100℃,最大给药剂量需降低90%才能保证至少50%的吸收。因此,通过制剂学手段提高药物的溶出度和溶解度以减少高熔点难溶性药物苯妥英的服用剂量具有重要意义。
SD制备方法主要有熔融法和溶剂蒸发法,而热熔挤出技术和喷雾干燥技术是近年来制药工业兴起的新技术[5]。BCSⅡ类和Ⅳ类药物(如黄芩苷[6-7]、姜黄素[8-9]、穿心莲内酯[10]等)常用这两种新方法制备SD。喷雾干燥技术传热快,干燥时间短[11],可制备具有较大比表面积的SD,有效改善难溶性药物的溶出速率[12]。但该技术具有产品得率较低、有机溶剂残留、具有吸湿性及自发聚集趋势等局限性[13-15]。热熔挤出技术物料的滞留时间较短,工艺步骤简单,是一项具有工业规模的、可连续加工制备药物传递系统的先进技术[16-17]。但在高温下,原料药和载体可能会发生热降解[18],无定形转化率低,不适用于高熔点药物。
通过热熔挤出技术和喷雾干燥技术制备的SD,药物多以无定形状态分散于高分子聚合物中。无定形药物分子处于高能状态,具有自发降至低能级的趋势,故无定形SD在储存过程中易出现重结晶或相分离等不稳定的问题[19-20],这限制了SD技术在改善药物溶出性能的应用[21]。故本研究在现有技术的基础上,探索共喷共挤技术对制备无定形SD的适用性,以寻找改善其稳定性的新技术。
本研究中采用了3种方法制备苯妥英SD。喷雾干燥技术制备的SD为无定形态,溶出度和表观溶解度均显著高于原料药,但需消耗较多溶剂,成本较高,且稳定性较差,放置过程中晶型易发生转变[22];热熔挤出技术制备的苯妥英SD存在少量微晶,但未对药物的释放造成太大影响,溶出度和表观溶解度较好,可能是由于在挤出过程中,辅料已与药物较好地分散,强大的剪切作用能显著降低药物的晶体尺寸,将部分机械能转为内能,进一步帮助部分高熔点药物实现相变;共喷共挤技术制备的SD为玻璃态,溶出度、表观溶解度和稳定性均较好。
综上所述,采用喷雾干燥、热熔挤出、共喷共挤3种技术制备的SD均能显著提高药物的溶出性能;且采用共喷共挤技术制备的SD稳定性较好,该技术对于提升高熔点难溶性药物的溶出性能和稳定性具有借鉴意义。
