药物性肝损伤78例临床分析
2022-10-24王亚南
王亚南
(金昌市中心医院临床药学室,甘肃 金昌 737100)
药物性肝损伤(DILD)是指在使用药物进行治疗的过程中,由于药物或其代谢产物的毒性导致肝细胞损害或肝脏对药物及其代谢产物发生过敏反应所致的疾病[1],也称为药物性肝炎。DILD占所有药物所致不良反应的10%~15%,发生率仅次于皮肤黏膜损害和药物热。患者肝功能损害程度不同,可表现为无症状、乏力、黄疸、上腹部不适等,严重者可出现死亡,需引起临床重视。本文通过综合分析发生药物性肝损伤患者的临床特征、预后影响因素,为临床合理用药提供参考,现报道如下。
1 资料与方法
1.1 一般资料
选择2020年10月至2021年10月在本院接受治疗且发生药物性肝损伤的患者78例,纳入标准:(1)符合《常见严重药品不良反应技术规范及评价标准》[2]中关于肝损伤的诊断标准:①连续两次检测ALT>1×ULN(正常值上限)或/和TBil>1×ULN;②单次检测ALT>2×ULN或TBil>2×ULN,符合上述两项内容之一即可定义为肝损伤。(2)既往有关于该药导致肝损伤的报道且有服用相关药物史。(3)停药后症状及肝功能缓解,再次服药后再次出现症状和肝功能损伤。排除标准:(1)服药时已经出现肝损伤;(2)其他原因导致的肝损伤;(3)胆汁淤积型停药至肝功能检查正常时间>6个月或肝细胞损伤型停药至肝功能检查正常时间>2个月[3]。
1.2 方法
收集患者一般资料(性别、年龄、既往史、临床分型、用药种类、临床表现、用药至出现肝损伤的时间、给药途径等)。采用普朗医疗PUZS-300全自动生化分析仪检测肝生化指标,包括谷丙转氨酶(ALT)、谷草转氨酶(AST)、血清总胆红素(TBil)、直接胆红素(DBil)、血清碱性磷酸酶(ALP)、γ-谷氨酰转移酶(GGT)。
1.3 临床分型标准
根据医学科学国际组织委员会关于药物性肝损伤的分型标准[4]分为:(1)肝细胞损伤型:ALT>2×ULN或ALT/ALP≥5;(2)胆汁淤积型:ALP>2×ULN或ALT/ALP≤2;混合型:ALT和ALP均>2×ULN或2 (1)治愈:症状及体征消失或明显改善,肝生化指标恢复正常;(2)好转:症状及体征减轻,肝生化指标较治疗前下降>50%;(3)无效:症状及体征未改善,肝生化指标无明显变化或加重;(4)死亡。 78例患者中,男30例,占38.5%,女48例,占61.5%;年龄5个月~81岁,其中40~60岁的患者51例,占65.4%;所患疾病种类:结核病43例,占55.1%,糖尿病35例,占44.9%,心脑血管病32例,占41.0%,肿瘤26例,占33.3%,皮肤病15例,占19.2%,其他疾病9例,占11.5%;有吸烟、饮酒史52例,占66.7%。 78例患者中,肝细胞损伤型52例,占64.1%,胆汁淤积型17例,占21.8%,混合型9例,占11.5%。 导致药物性肝损伤的药物见表1。 表1 导致药物性肝损伤的药物(n) 主要临床表现见表2,实验室检查结果见表3。 表2 主要临床表现 表3 实验室检查 78例患者中,用药至出现肝损伤的时间中位数为53.2d,其中≤2周的共45例,占57.7%;口服给药所致的肝损伤共55例,占70.5%,静脉用药共20例,占25.6%,其他给药途径共3例,占4.8%。 所有患者均立即停用引起肝损伤的药物,并给予还原型谷胱甘肽、甘草酸二铵、异甘草酸镁、硫普罗宁等护肝药物,根据预后判断标准,将治愈和好转的患者归为有效组,将未愈和死亡的患者归为无效组,其中有效组共60例,占76.9%,无效组共18例,占23.1%。 单因素分析结果显示,两组之间年龄、TBil水平差异有统计学意义(P<0.05),性别、临床分型、ALT、AST、DBil、ALP、GGT水平差异无统计学意义(P>0.05)。见表4。 表4 影响预后的单因素分析 将单因素分析结果有统计学意义的因素纳入多因素Logistic回归分析,结果显示,年龄、TBil水平是影响患者预后的独立危险因素,差异有统计学意义(P<0.05)。见表5。 表5 影响预后的多因素分析 肝脏是药物代谢的主要场所,含有丰富的药酶系统,大多数药物均要通过肝脏的氧化、还原、水解等生物转化作用,再由胆道通过胆汁或尿液排出体外。肝内药酶系统最重要的是细胞色素P450(CYP)及其相关辅酶,大多数药物性肝损伤的发生机制主要与药物代谢中心的CYP相关,CYP的遗传多态性使得不同个体肝药酶活性表现出明显的差异,在某些个体,药物在代谢过程中会产生有毒物质,造成肝损伤;或原本不具有抗原性的药物,在肝内转化形成具有抗原性的代谢产物,引起免疫性肝损伤[5]。药物主要通过两种机制造成肝损伤,一是药物及其中间代谢产物对肝脏的直接毒性作用,二是机体对药物的特异质反应[6-7]。 本文结果显示,女性患者所占比例较男性患者高,老年患者所占比例较高,原因可能为:(1)男性肝脏内微粒体的药酶活性略高于女性,女性对药物的代谢能力较低,敏感度高,有研究[8]显示,女性是药物性肝损伤的高发人群;(2)老年人随着年龄增长,所患基础疾病的几率增加,服药机会增加,加之生理机能减退,肝肾功能减弱,肝脏内药酶活性降低,影响了对药物的代谢排泄能力,导致老年人药物性肝损伤的发病率增加;(3)老年人多合并心脑血管疾病、糖尿病或肿瘤等多种疾病,糖尿病自身会引起多种类型的肝脏损伤[9],心脑血管病及肿瘤均是导致药物性肝损伤的潜在危险因素[10]。多因素分析结果发现,年龄是影响患者预后的独立危险因素,与相关研究[11]结果一致,这提示临床医师在对老年患者,尤其是合并基础疾病的老年患者进行用药时,需高度警惕药物性肝损伤的发生。有研究表明,吸烟、饮酒史是药物性肝损伤的独立危险因素[12],本文药物性肝损伤患者中,既往有吸烟、饮酒史所占比例较高,达66.7%,这说明烟酒及其他不良生活习惯会导致肝功能受损,增加发生药物性肝损伤的几率。本文纳入患者中以肝细胞损伤型为主,其次是胆汁淤积型,混合型患者所占比例最少,与既往研究结果一致[13]。 本文结果发现,导致药物性肝损伤的药物前三位分别是中药及中成药、抗结核药及抗感染药物,原因可能是:(1)传统观念对中药的理解存在误区,多认为中药材是纯天然的、不良反应小,缺乏对中药潜在毒性的认识,服用时间长、剂量大,或在中药材的采集、加工、炮制过程中存在不合理的因素,增加了中药的毒性[14];(2)我国结核病发病率高,结核病以药物治疗为主,异烟肼、利福平等抗结核药物通过干扰肝细胞代谢过程导致肝内胆汁淤积,或者破坏肝细胞导致肝细胞坏死造成肝损伤[15],另外有患者同时服用中药及抗结核药,进一步加重了对肝脏的损伤;(3)部分患者抗感染药物应用不规范也可损伤肝功能,抗感染药物可干扰肝脏代谢,影响肝脏的脂肪转运,导致线粒体发生脂肪酸氧化,导致药物性肝损伤。 本文结果发现,药物性肝损伤的临床表现与病毒、酒精等原因导致的肝病无明显差异,且部分患者表现为无症状,仅有实验室检查结果异常,说明药物性肝损伤临床表现缺乏特异性、起病较隐匿、容易误诊,提示临床医师使用肝毒性药物时,需定期检测患者肝功能、追问服药史,争取做到早诊断、及时停药、早期治疗。本文中所有患者停用导致肝损伤的药物并给予保肝治疗后,有76.9%的患者痊愈或好转,其中还原性谷胱甘肽是治疗药物性肝损伤的常用药物,作为一种抗氧化剂,能维持细胞的正常代谢及细胞膜的完整性,增强肝脏的解毒作用[16];甘草酸二铵、异甘草酸镁等甘草酸类制剂,可通过抑制炎症而发挥抗肝损伤的作用[17]。经多因素分析,TBil水平也是影响患者预后的独立危险因素,与相关研究[11]结果一致。 本文结果发现,口服给药导致肝损伤所占比例最大,原因可能是某些药物经胃肠道给药,在尚未吸收进入血循环之前,受肝脏首过效应的影响,在肝脏内被相关酶代谢破坏,滞留在肝脏中,导致毒性累积,造成肝损伤。本文中,用药至发病时间≤2周的患者占57.7%,与相关报道[18]结果一致,提示临床医师在使用肝损伤高危药物时,需在前两周内密切监测患者肝功能,预防药物性肝损伤的发生。 药物性肝损伤关键在于预防,临床医师应提高对该病的认识,做到以下几点:(1)对合并有慢性基础疾病、联合用药的特殊人群应加强药物不良反应监测;(2)用药时注意剂量不宜过大、疗程不宜过长;(3)使用可疑损害肝功能的药物时,应动态监测肝功能;(4)患者在用药过程中出现黄疸或肝生化指标异常时,应仔细询问用药史,在病情允许的情况下停用相关药物并谨慎使用护肝药,因为护肝药物同样也会造成肝脏负担;(5)中药中的雷公藤、何首乌是导致药物性肝损伤的主要药物[19-20],需引起临床医师的重视,对患者正确宣传中药疗效,严格掌握适应证,对炮制工艺质量进行严密监控和规范管理。 综上所述,药物性肝损伤多发生于中老年人,临床表现不典型,多发生于用药2周内,起病隐匿、容易误诊,常见的导致药物性肝损伤的有中药及中成药、抗结核药及抗感染药物,口服给药易导致药物性肝损伤,临床医师应加强对患者肝功能的监测,预防药物性肝损伤的发生。1.4 预后判断标准
1.5 统计学方法
2 结果
2.1 临床特征
2.2 临床分型
2.3 用药种类

2.4 临床表现及实验室检查
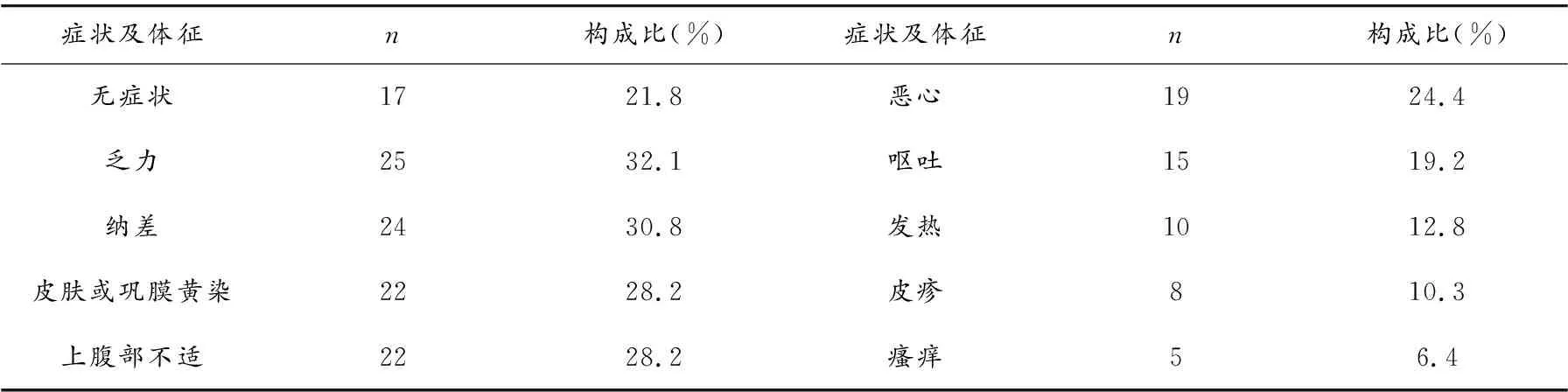
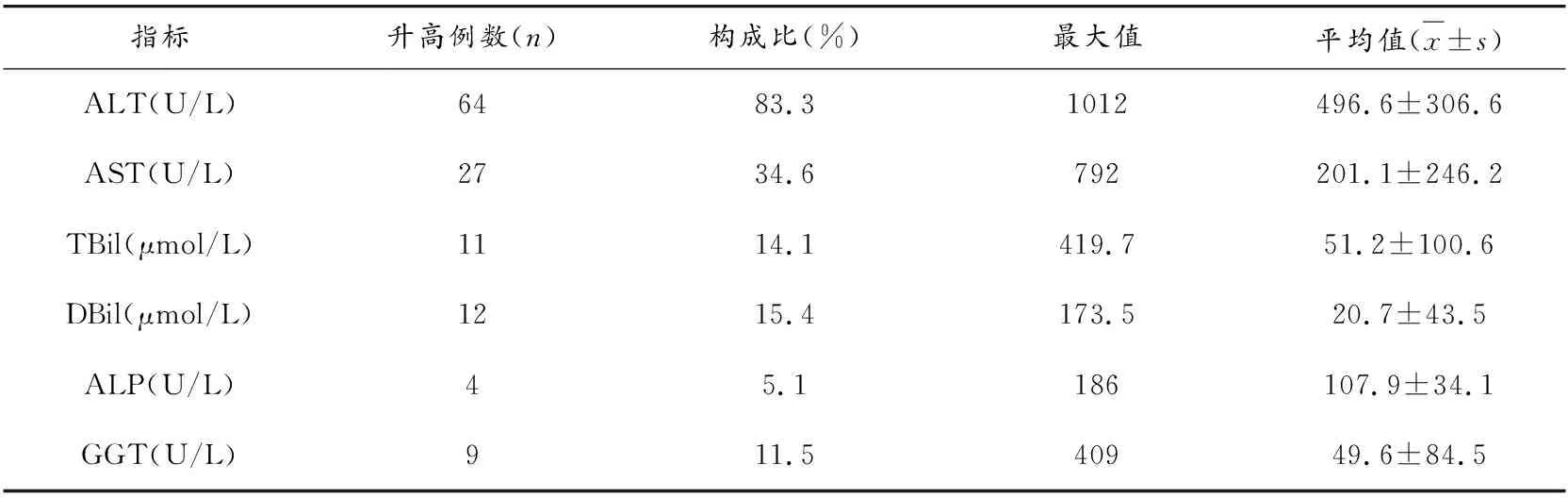
2.5 用药至出现肝损伤的时间、给药途径
2.6 治疗及预后
2.7 影响预后的单因素分析
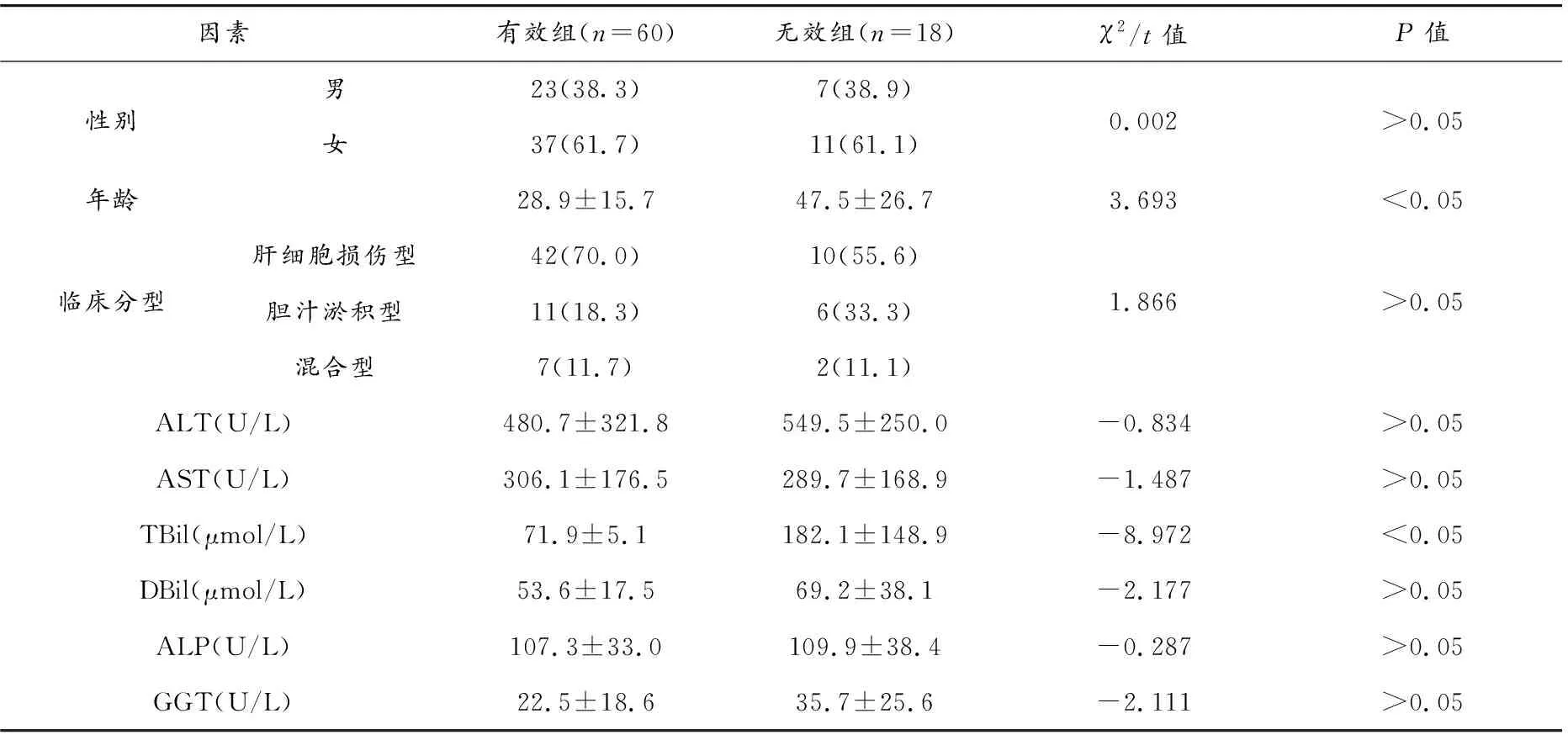
2.8 影响预后的多因素分析
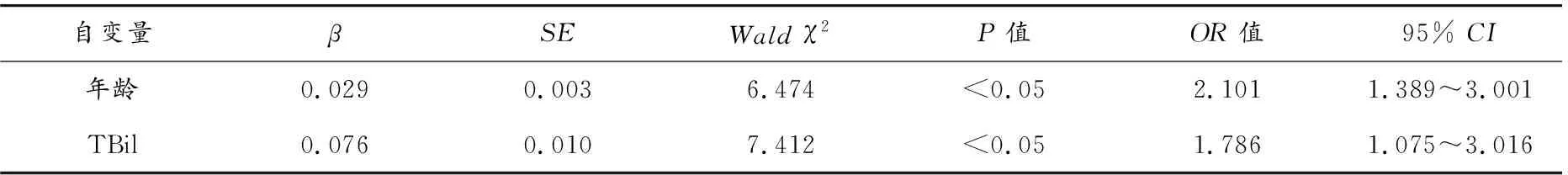
3 讨论
