多层螺旋CT特征联合模型列线图鉴别0期与ⅠA1期肺腺癌
2022-10-24曾显荣胡佑威刘庆玲
曾显荣,胡佑威,刘庆玲,党 鸽,马 捷*
[1.深圳市人民医院(暨南大学第二临床医学院,南方科技大学第一附属医院)放射科,2.神经内科,广东 深圳 518020]
肺癌是常见恶性肿瘤之一[1], 腺癌为其最常见病理类型[2]。根据国际肺癌研究学会第8版肺癌TNM分期标准[3],0期肺癌为TisN0M0期肿瘤,即原位癌(adenocarcinoma in situ, AIS);ⅠA1期肺癌包括T1miN0M0和T1aN0M0期肿瘤,即微浸润性腺癌(minimally invasive adenocarcinoma, MIA)及浸润性腺癌(invasive adenocarcinoma, IAC)。第五版胸部肿瘤WHO分类将AIS归为腺体前驱病变[4],可随访观察或选择更小范围的手术切除治疗;而ⅠA1期为浸润性病变,均应积极手术治疗。本研究观察基于多层螺旋CT(multi-slice spiral CT, MSCT)特征的联合模型列线图鉴别0期与ⅠA1期肺腺癌的价值。
1 资料与方法
1.1 一般资料 回顾性收集2019年1月—2022年3月深圳市人民医院230例肺腺癌患者,男85例,女145例,年龄21~82岁,平均(49.1±12.2)岁; 210例为单发病灶,17例存在2个、3例存在3个病灶;根据病理分期将患者分为0期组(n=83)和ⅠA1期组(n=147,包括112例MIA和35例IAC)。纳入标准:①术前胸部MSCT和临床资料完整;②经手术病理证实为肺腺癌,病理分期为0期或ⅠA1期肺癌分期标准[3]。排除标准:①术前接受放射、化学等抗肿瘤治疗;②非原发性肺腺癌。
1.2 仪器与方法 采用GE Optima CT680 64排、Philips Brilliance 16排或Philips iCT 256层MSCT机行胸部平扫。嘱患者仰卧,头先进,于吸气末采集图像,范围自肺尖至肺底;参数:管电压120 kVp,管电流为自动mAs或130~150 mAs,层厚5 mm;扫描结束重建薄层图像,层厚1.0~1.5 mm。
1.3 图像分析 由2名分别具有14年及11年胸部影像学诊断经验、且不知晓病理结果的主治医师独立阅片,调整肺窗图像窗位均为-600 HU、窗宽均为1 200 HU,分析病灶CT表现,包括结节类型[纯磨玻璃结节(pure ground-class nodule, pGGN)、混杂磨玻璃结节(mixed ground-glass nodule, mGGN)或实性结节(solid nodule, SN)]、病灶形态(有无分叶征)、病灶内部结构(有无微血管征、支气管征、空泡征)、病灶边缘(有无毛刺征、脐凹征)、瘤肺界面(清楚、模糊)、病灶周围结构(有无血管集束征、胸膜凹陷征)及病灶密度(最大密度、最小密度、平均密度);存在多发病变时,以体积最大或分期最高者为靶病灶;意见分歧时经讨论达成一致。
由1名具有16年工作经验的主管技师于薄层CT图像上逐层勾画病灶轮廓,获得其最大径、最小径和体积;测量mGGN实性成分最大径,计算肿瘤实性成分占比(consolidation tumor ratio, CTR),CTR=实性成分最大径/肿瘤最大径×100%。由上述具有14年工作经验的主治医师对测量结果进行复核后确认。
1.4 统计学分析 采用SPSS 24.0软件及R软件(4.1.1)进行统计分析。以Kolmogorov-Smirnov检验分析计量资料的正态性,符合者以±s表示,不符合者以中位数(上下四分位数)表示,组间行独立样本t检验或Mann-WhitneyU检验。以χ2检验比较计数资料。采用二元logistic回归分析针对差异有统计学意义的参数筛选肺腺癌分期的独立影响因子,并建立联合模型,获得其预测概率值。以“pROC”程序包绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC),评估独立影响因子及联合模型鉴别0期与ⅠA1期肺腺癌的效能;以Z检验比较其AUC的差异。应用“rms”程序包基于独立影响因子构建联合模型列线图,以BootsWap法绘制其校正曲线(设置重复抽样次数为500),以“rmda”程序包行临床决策曲线分析(decision curve analysis, DCA),验证联合模型列线图的效能。P<0.05为差异有统计学意义。
2 结果
2.1 单因素分析 0期与IA1期组间患者性别及病灶空泡征、胸膜凹陷征差异均无统计学意义(P均>0.05),其余参数差异均有统计学意义(P均<0.05),见表1及图1、2。
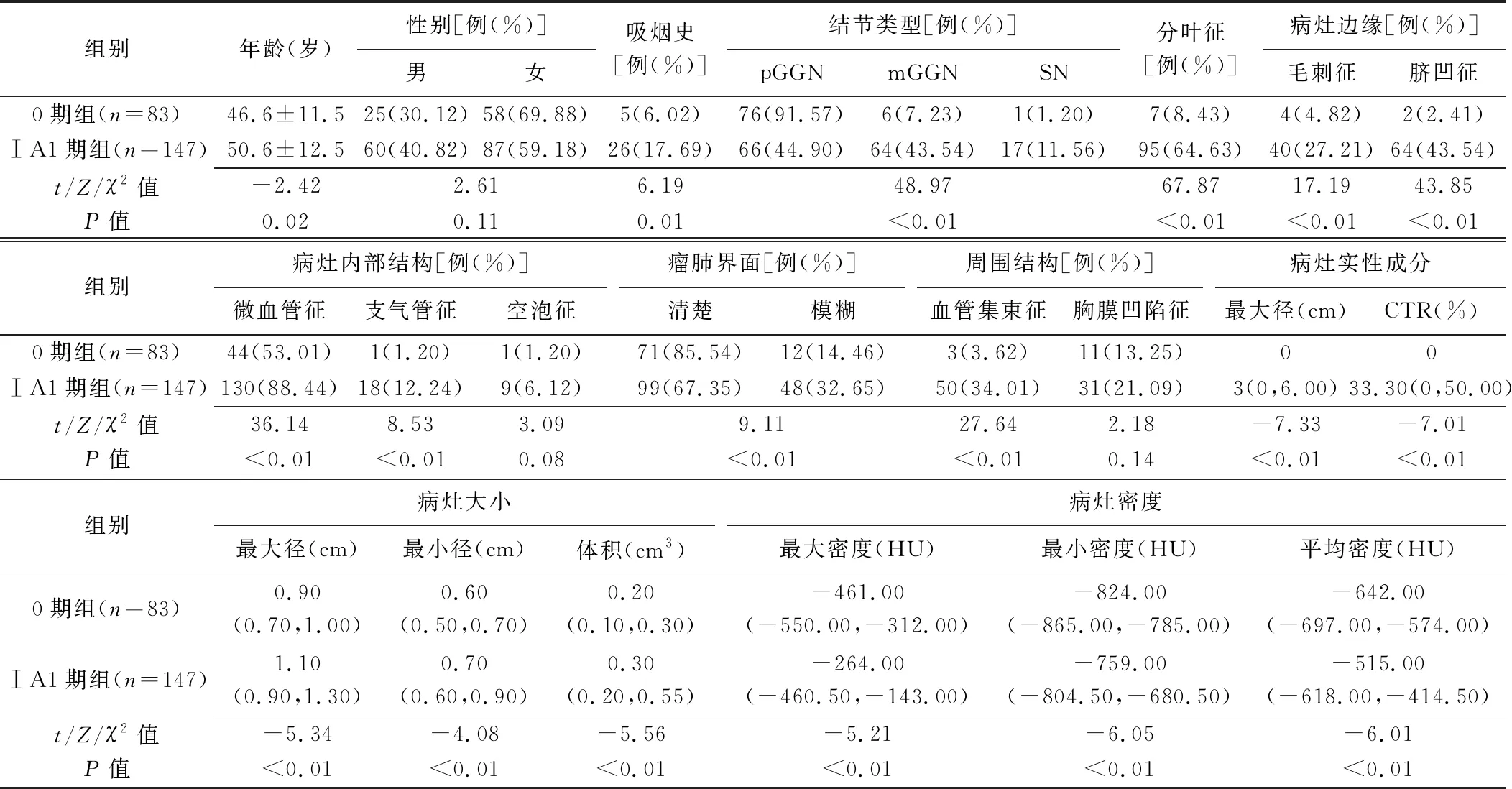
表1 0期与ⅠA1期肺腺癌患者一般资料及病灶CT表现比较
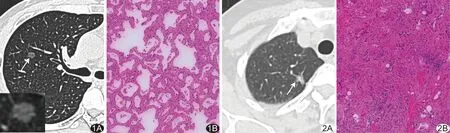
图1 患者男,31岁,右肺腺癌(0期组) A.胸部轴位平扫CT图示右肺上叶后段pGGN(箭),形态规则,其内密度较均匀,无分叶及微血管征,瘤-肺界面清楚(左下角为放大图像); B.病理图(HE,×100)示肿瘤细胞沿肺泡贴壁生长,未突破基底膜 图2 患者女,45岁,右肺腺泡型IAC(ⅠA1期组) A.胸部轴位平扫CT图示右肺上叶尖段mGGN(箭),可见微血管征、毛刺征、脐凹征、血管集束征及胸膜凹陷征; B.病理图(HE,×100)示肿瘤细胞突破基底膜在间质内弥漫性浸润生长,促纤维形成反应明显,未累及神经、脉管及胸膜
2.2 logistic回归分析及建立模型 病灶分叶征[OR=4.28,95%CI(1.21,15.07),P=0.02]、微血管征[OR=2.55,95%CI(1.03,6.31),P=0.04]、脐凹征[OR=7.02,95%CI(1.08,45.61),P=0.04] 、最小密度[OR=1.01,95%CI(1.00,1.02),P<0.01]及CTR[OR=1.15,95%CI(1.01,1.30),P=0.03]为肺腺癌分期的独立影响因子,据此获得联合模型:logit(P)=3.95+0.01×最小密度+1.61×CTR+1.53×分叶征+0.93×微血管征+1.73×脐凹征;其中分叶征、微血管征及脐凹征均定义为阳性=1,阴性=0。
2.3 联合模型的诊断效能 ROC曲线显示联合模型鉴别0期与ⅠA1期肺腺癌的AUC为0.876,高于分叶征、微血管征、脐凹征、最小密度及CTR(Z=4.99、7.41、7.66、4.65、5.70,P均<0.01)。见表2及图3。
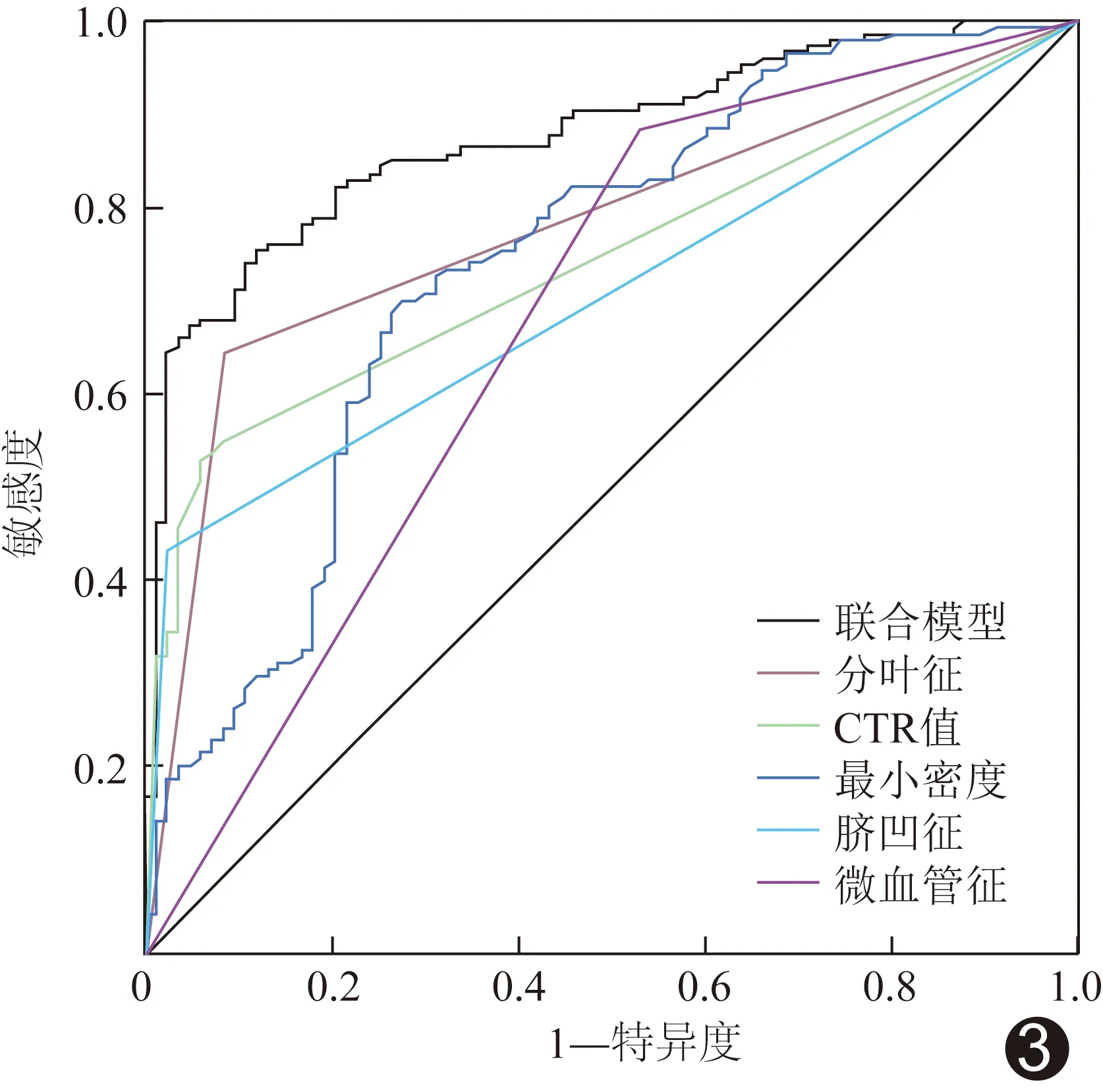
图3 独立影响因子及联合模型鉴别0期与ⅠA1期肺腺癌的ROC曲线
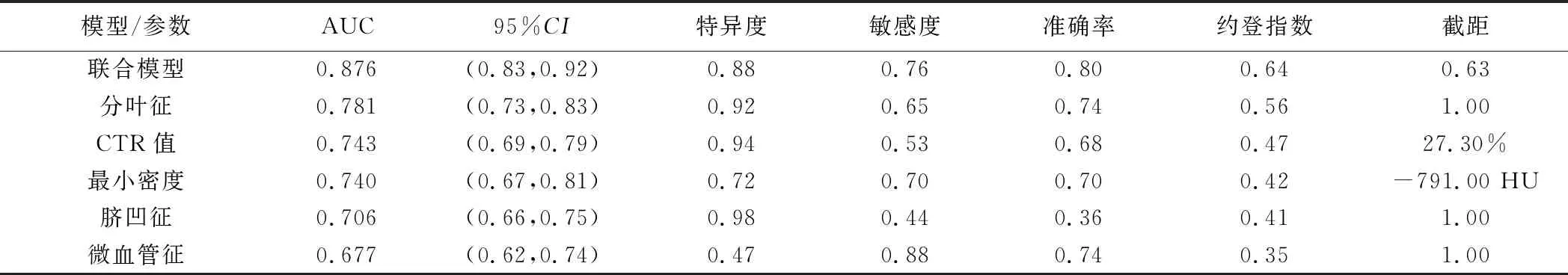
表2 独立影响因子及联合模型鉴别0期与ⅠA1期肺腺癌的效能
基于独立影响因子构建联合模型列线图(图4)以可视化联合模型;校正曲线(图5)显示预测概率曲线与标准曲线非常接近,联合模型鉴别0期与ⅠA1期肺腺癌准确率达0.80,一致性指数为0.88,平均绝对误差为0.01,提示模型校准度及区分度良好。DCA显示,阈值为0.2~0.9时,联合模型的临床净效益均高于单一独立影响因子(图6)。
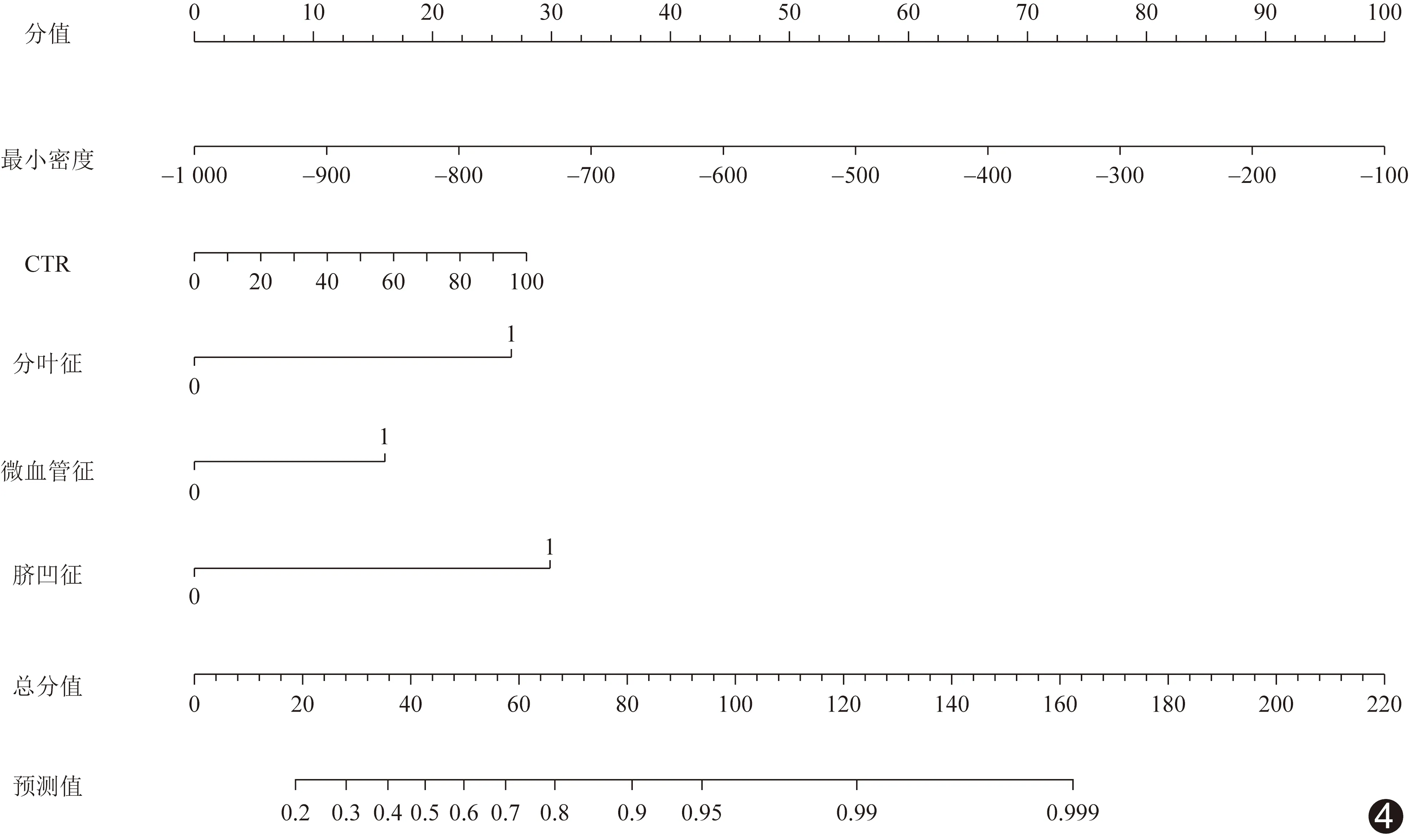
图4 基于独立影响因子获得的联合模型列线图,将各影响因子的得分相加,得到总分值,获得鉴别0期与ⅠA1期肺腺癌的预测值
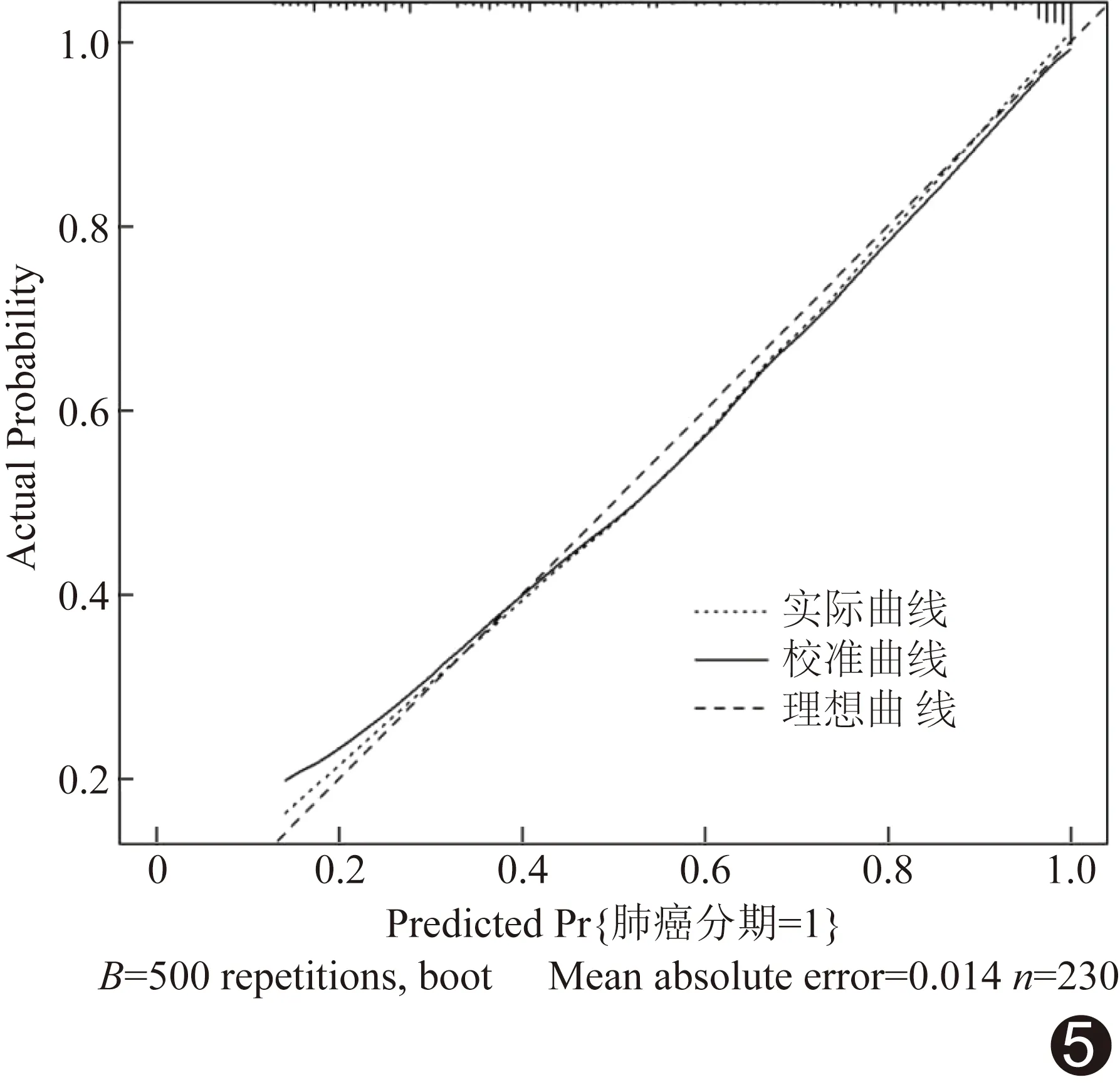
图5 联合模型校准曲线
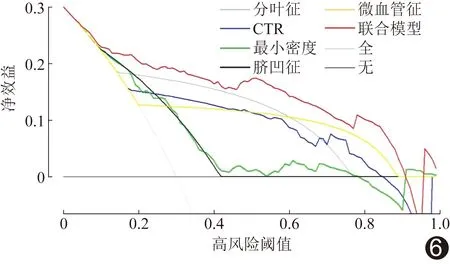
图6 联合模型DCA图 “全”代表所有患者均为ⅠA1期肺腺癌;“无”代表所有患者均为0期肺腺癌
3 讨论
对于0期与ⅠA1期肺腺癌的治疗方式不同,鉴别二者诊断对临床治疗决策具有重要意义。0期肺腺癌表现为肿瘤沿肺泡壁贴壁生长而未侵及间质;ⅠA1期肺腺癌表现为肿瘤突破肺泡基底膜,并有不同程度浸润[5];二者MSCT表现存在部分重叠,但仍有所差异[5]。本研究基于MSCT特征构建列线图,以鉴别0期与ⅠA1期肺腺癌。
本研究发现,分叶征、微血管征、脐凹征、最小密度及CTR为肺腺癌分期(0期与ⅠA1期)的独立影响因子。ICHINOSE等[6]报道,病灶最大CT值(截距-300 HU)为肺腺癌浸润性的独立预测因子;本组中,最小密度(截距-791 HU)为独立影响因子。mGGN实性成分与肿瘤浸润程度密切相关,病灶CTR值越大,则恶性可能性越大、浸润性越强[7]。SN常见于体积较大的晚期肺腺癌,本研究纳入病例均为病灶体积较小的较早期肺腺癌,SN占比较低。分叶征及脐凹征的形成机制相似,是因肿瘤生长过程中各个方向的生长速度不同[8],病灶内纤维瘢痕收缩或侵犯邻近胸膜而形成[9],多见于体积较大或较晚期肺腺癌。本研究ⅠA1期组分叶征或脐凹征发生率显著高于0期组,且可见于部分体积较小且不靠近胸膜的病灶,系早期肺腺癌生长过程中局部受到邻近小叶间隔、纤维条索或血管阻挡而形成[10],即早期肺腺癌亦可出现分叶征及脐凹征。微血管征指病灶内血管穿行、增粗、扭曲、聚拢、连接等异常改变[11],肿瘤生长过程中释放血管内皮生长因子可诱导血管生成[12];肿瘤内纤维化是血管扭曲的主要原因,随着肿瘤体积增大,肿瘤内血流量增加导致血管扩张增粗[13]。本研究ⅠA1期组微血管征发生率高于0期组。总之0期与ⅠA1期肺腺癌MSCT表现存在一定差别,不能仅强调某单一CT征象,而需综合分析其各项特征加以鉴别。
本研究基于独立影响因子构建鉴别0期与ⅠA1期肺腺癌联合模型,并以列线图将其可视化,联合模型的校准度良好,其诊断的AUC为0.88,高于单一独立影响因子;且阈值为0.2~0.9时,联合模型的临床净效益均高于单一独立影响因子,提示其诊断效能较高,可有效鉴别0期与ⅠA1期肺腺癌。
综上,基于MSCT特征联合模型列线图可有效鉴别0期与ⅠA1期肺腺癌,为临床诊疗提供影像学依据。但本研究为单中心回顾性研究,未以外部数据对模型进行验证,有待扩大样本量、纳入更多相关因素行多中心前瞻性研究,进一步验证模型的效能。
