二维斑点追踪成像评价胸主动脉腔内修复术后升主动脉纵向应变
2022-10-24张梦菲何杨燕余姗姗王旭明孙智超杨欣月蒋天安
石 璨,余 蕾*,张梦菲,何杨燕,王 璆,余姗姗,王旭明,孙智超,杨欣月,蒋天安
(1.浙江大学医学院附属第一医院超声医学科,2.血管外科,浙江 杭州 310000)
胸主动脉疾病发病率及死亡率均高,传统治疗方法包括保守治疗和手术干预。因具有创伤小、出血少、恢复快等优点,胸主动脉腔内修复术(thoracic endovascular aortic repair, TEVAR)[1]现已逐渐取代传统开放性手术而广泛用于治疗主动脉夹层、主动脉瘤等疾病[2-4],通过封堵动脉破口使真腔扩张,而假腔内的血液逐渐血栓化、机化并被吸收。目前主要通过主动脉重塑进行TEVAR术后评估[5],而评估近端升主动脉弹性的研究较少。本研究以二维斑点追踪成像(two-dimensional speckle tracking echocardiography, 2D-STE)观察TEVAR术后胸主动脉疾病患者升主动脉纵向应变(longitudinal strain, LS)的变化。
1 资料与方法
1.1 研究对象 回顾性分析2020年10月—2021年10月82例以TEVAR作为一线治疗的胸主动脉疾病患者,男67例,女15例,年龄23~78岁,平均(55.7±14.4)岁;其中53例主动脉夹层(Debakey Ⅰ型1例、Ⅲ型52例)、12例主动脉瘤、9例主动脉壁间血肿及8例主动脉弓穿通性溃疡。排除标准:①夹层累及冠状动脉或心脏瓣膜;②主动脉瓣或升主动脉疾病术后;③肾功能不全或心肺疾病,无法接受全身麻醉;④左侧椎动脉起源于主动脉弓;⑤心律失常;⑥图像质量不佳。根据术前升主动脉收缩末期内径(ascending aorta end-systolic diameter, AoS)将患者分为A组(n=37,AoS≥35 mm)及B组(n=45,AoS<35 mm);同期纳入20名年龄、性别相匹配的健康人作为对照组。本研究通过医院伦理委员会批准。
1.2 仪器与方法 分别于术前、术后7天及1个月记录A、B组收缩压(systolic blood pressure, SBP)、舒张压(diastolic blood pressure, DBP)、脉压(pulse pressure, PP)及心率(heart rate, HR)。嘱患者仰卧,由2名具有3年以上工作经验的超声科医师采用GE Vivid E95型彩色多普勒超声诊断仪、M5S线阵探头(1~5 MHz),于左心室长轴切面以M型超声测量收缩期距窦管交界3 cm处的AoS及舒张末期内径(ascending aorta end-diastolic diameter, AoD),根据公式计算升主动脉应变(ascending aorta M-mode strain, Aortic Strain)及动脉硬化指数β。以EchoPAC图像后处理软件进行脱机分析,自窦管交界至升主动脉4 cm处手动描绘升主动脉内膜边界并调整ROI宽度,系统自动将ROI分为3节段,分别将升主动脉前、后壁3节段的应变峰值的平均绝对值记为前、后壁LS(LS-anterior/posterior wall, LS-AW/PW),二者均值记为平均LS(mean LS, LSmean)。每名医师测量A、B组以上参数3次,取平均值作为结果(图1);对照组仅采集并记录1次。
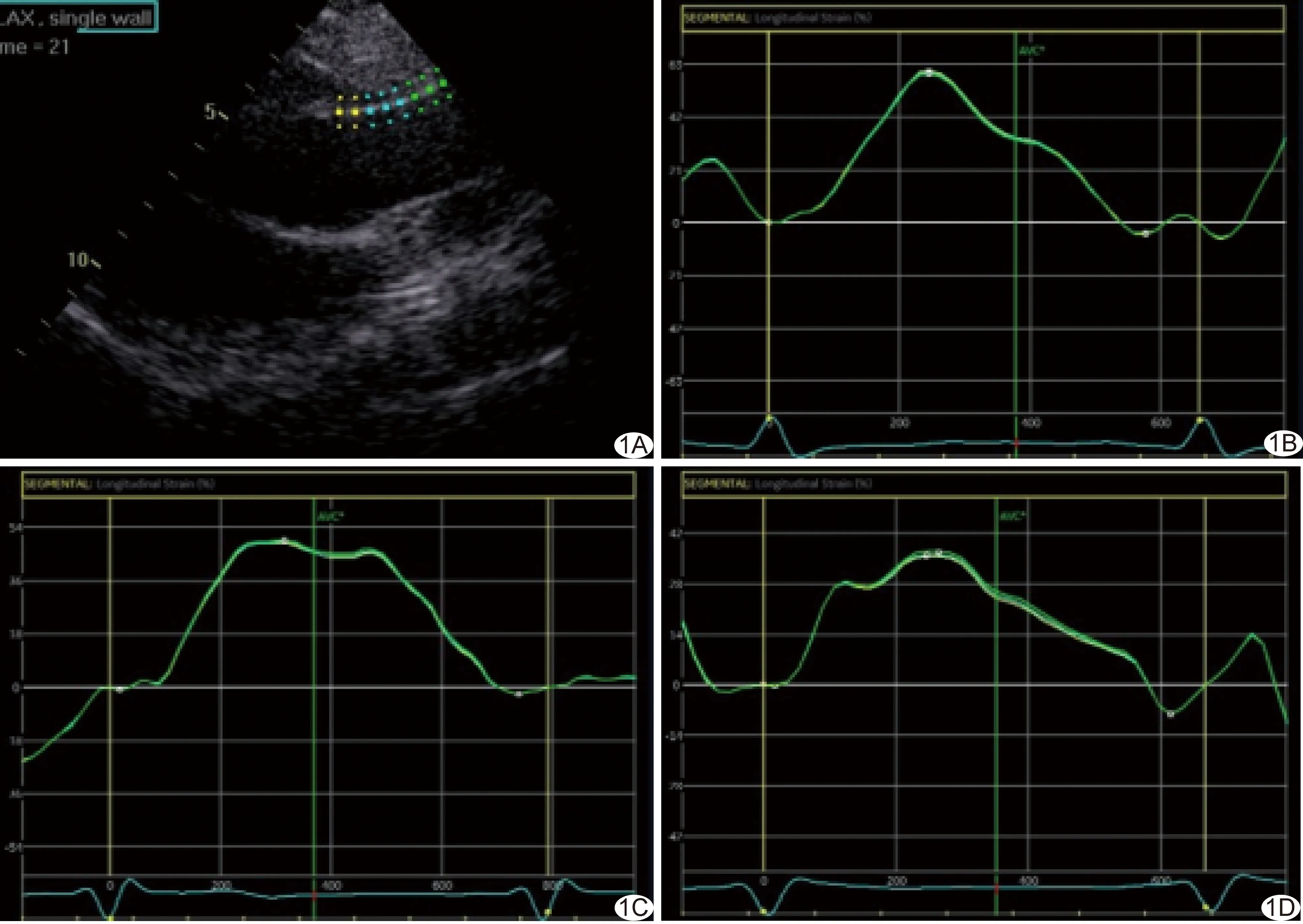
图1 患者男,36岁,主动脉夹层Debakey Ⅲ型(B组) A.描记声像图示升主动脉ROI; B~D.TEVAR术前、术后7天及1个月升主动脉前壁纵向应变曲线,LS-AW分别为61%、49%及35%
1.3 统计学分析 采用SPSS 23.0统计分析软件。以±s表示计量资料,组间行方差分析,两两比较采用SNK-q法;采用配对t检验比较TEVAR前后各参数。以频数和百分率表示计数资料,采用χ2检验及Fisher精确概率法进行组间比较。校正患者年龄后,以偏相关分析评价应变参数与基本资料和其他超声参数的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 胸主动脉疾病患者与健康人比较 3组间性别、年龄、DBP、HR、高血压史、糖尿病史及高血压/糖尿病规律用药史差异均无统计学意义(P均>0.05)。A组SBP、PP均高于对照组(P均<0.05);B组PP高于对照组(P<0.05);A组PP及吸烟史比例均高于B组(P均<0.05),见表1。

表1 胸主动脉疾病患者与健康人基本资料比较
3组间AoD、AoS、Aortic Strain及β差异均有统计学意义(P均<0.05)。A、B组LS-AW、LSmean均较对照组降低(P均<0.05);A组LS-PW较对照组降低(P<0.05),B组LS-PW与对照组差异无统计学意义(P>0.05)。随升主动脉内径增加,各LS参数均进一步降低(P均<0.05)。见表2。
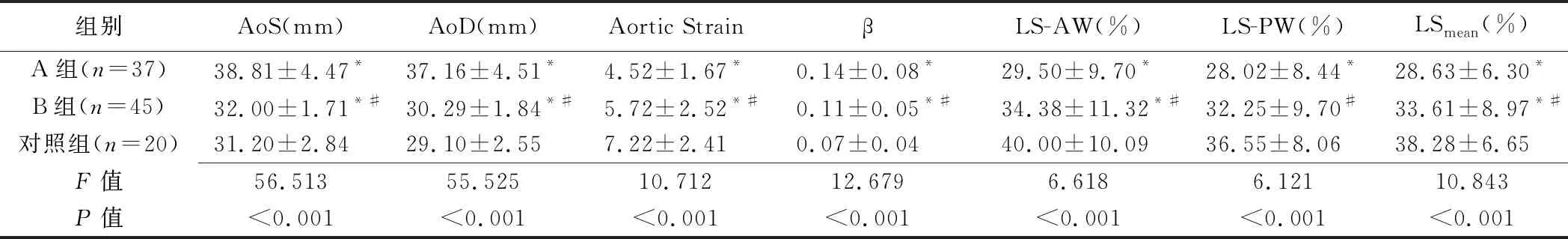
表2 TEVAR术前胸主动脉疾病患者与健康人超声参数比较
2.2 胸主动脉疾病患者TEVAR前后比较 A、B组术前SBP、DBP、PP、AoS、AoD、Aortic Strain、β及LS-PW与术后7天、1个月比较差异均无统计学意义(P均>0.05);术后1个月患者心率较术前增快(P<0.05)。术后7天、术后1个月,患者LS-AW、LSmean均较术前降低(P均<0.05);术后7天与1个月升主动脉应变各参数差异均无统计学意义(P均>0.05)。见表3。

表3 胸主动脉疾病患者TEVAR前、后基本资料及超声参数比较(n=82)
2.3 相关性分析 LS-AW与SBP、PP、AoS及AoD均呈负相关(r=-0.22、-0.25、-0.32、-0.30,P均<0.05),LS-PW与PP、AoS及AoD呈负相关(r=-0.24、-0.24、-0.23,P均<0.05)。
3 讨论
目前TEVAR是治疗胸主动脉疾病的首选方式。作为动脉缓冲体系的重要组成部分,升主动脉受心脏舒缩运动及血流射入升主动脉的负荷影响而发生形变,包括径向和纵向膨胀。TEVAR术后,植入支架节段主动脉纵向僵硬度快速增加[6]、升主动脉及主动脉弓部张力增大,可能削弱主动脉壁顺应性而使支架移植物近端主动脉纵向弹性发生改变,引起近端主动脉扩张和延长,为主动脉夹层和不良心血管事件的重要因素。
2D-STE可通过计算运动和形变变量评估血管壁改变[7-8]。本研究发现胸主动脉疾病患者升主动脉LS较对照组降低,且随升主动脉内径增宽,LS呈降低趋势,即动脉弹性降低,与BIESEVICIENE等[9]研究结果相符。LS与PP及动脉内径呈负相关,血管内径增宽,弹力纤维变薄,血管壁变形能力减弱,所受机械应力增加,PP反映动脉弹性功能,同时又是预测不良心血管事件的独立因子;升主动脉LS降低意味着动脉僵硬度增加,血压稳定性及动脉内径可能也会出现相应变化。
临床部分升主动脉内径<35 mm也可能发生升主动脉夹层[10],而目前缺乏合理指标,以预测动脉扩张进展。2D-STE可提供动脉弹性信息,具有重要临床意义。本研究A、B组TEVAR术前与术后升主动脉内径及PP无明显差异,即TEVAR术后早期,LS不受内径及PP影响;但术后7天及1个月升主动脉LS-AW及LSmean较术前降低,提示术后升主动脉LS受植入支架影响,其长轴方向形变能力减弱,原因可能在于植入支架后降主动脉扩张性减弱,而升主动脉随心脏收缩运动发生形变时张力增加,为维持正常血流动力而出现纵向拉长、变形[11];另一方面,TEVAR术后胸主动脉真腔扩张,假腔内血流在重塑过程中减少,假腔血栓化情况可能影响主动脉形态及血流动力恢复,降主动脉形态发生改变后,血流作用在血管壁的剪切力方向亦发生改变,也可能导致升主动脉被动产生轴向形变而致其纵向弹性功能减弱。
既往研究[12]发现,TEVAR术后升主动脉内径增长速度持续增快,血管内皮功能损伤。升主动脉近段内径较宽,血流状态复杂,其内径增宽可使LS进一步减低,血管壁所受机械性压力和冲力增加,致弹性功能进一步受损。动脉顺应性增加可降低心脏射血负荷和阻抗[13],心室-动脉耦联变化可能引起心脏功能障碍。本研究发现术后1个月患者心率较术前加快,预示其未来发生心脑血管事件的风险可能增加,有待进一步观察。
综上所述,TEVAR术后早期,胸主动脉疾病患者升主动脉弹性降低。但本研究为单中心回顾性观察,可能存在选择偏倚;且部分高血压患者规律服用降压药物,可能对结果造成一定影响,有待后续进一步完善。
