Pv-aCO2在非体外循环冠状动脉旁路移植术后低血容量患者液体复苏中的应用价值
2022-10-24赖小刚赵科研
赖小刚,徐 殊,孙 畅,赵科研
(北部战区总医院 心外科,辽宁 沈阳110812)
早在2001年Rivers等报道早期目标导向治疗(EGDT)通过调整氧供需平衡,可以显著降低脓毒症及脓毒性休克患者的病死率[1]。近年来,围术期监护和治疗水平的提高促进了心脏外科的迅猛发展。非体外循环冠状动脉旁路移植术(OPCABG)越来越多的应用于多支血管病变的冠心病患者。患者OPCABG术后早期常常存在有效血容量相对不足,过度复苏或复苏不足可发生多器官功能障碍综合征(MODS)[2]。适宜的液体复苏应达到充分的组织灌注和氧供需平衡,减少MODS的发生,改善预后。因此,如何优化OPCABG术后液体复苏一直是临床研究重点。研究报道[3-4],中心静脉-动脉血二氧化碳分压差(Pcv-aCO2)能有效指导脓毒性休克以及高危手术后患者的液体复苏,并在最新版的脓毒性休克早期复苏指南中推荐应用。混合静脉血是全身静脉血经右心系充分混合后流至肺动脉的血液。混合静脉-动脉血二氧化碳分压差(Pv-aCO2)较Pcv-aCO2更能反映全身组织灌注的情况,动态反映机体氧供需平衡的变化。本研究拟探讨Pv-aCO2在OPCABG术后低血容量患者液体复苏中的临床价值,以期为OPCABG术后早期液体复苏提供指导和参考。
1 资料与方法
1.1 一般资料选择北部战区总医院2019年5月至2020年8月择期行OPCABG后低血容量冠心病患者120例为研究对象,男73例,女47例;年龄(61.83±8.52)岁。排除标准:①急诊手术;②同期行心脏瓣膜置换/成形手术;③二次开胸手术;④术中转体外循环;⑤围手术期主动脉内球囊反搏辅助;⑥合并严重肝肾功能异常及呼吸系统疾患。本研究符合医学伦理学标准,并经医院伦理委员会批准。
1.2 方法全部入组患者术前经右侧颈内静脉穿刺分别放置深静脉导管和Swan-Ganz导管,前者用于中心静脉压(CVP)监测、液体输入以及血管活性药物泵入,后者用于心输出量(CO)、血管阻力及氧代谢等指标的监测。常规行桡动脉穿刺置管用于动脉采血及有创动脉血压监测。患者术后带气管插管由手术室转运至心外科重症监护室(ICU),给予心电、有创血压等监测,行呼吸机辅助通气,并立即给予EGDT治疗。EGDT治疗具体措施[2]:①以Swan-Ganz导管监测的数据为指导进行循环与容量支持,即维持平均动脉压(MAP)≥65 mmHg(1 mmHg=0.1333 kPa),CVP 8-12 cmH2O,尿量≥0.5 ml/(kg·h),混合静脉氧饱和度(SvO2)≥65%。若CVP<8 cmH2O、MAP<65 mmHg,则以30 min输入250 ml液体的速度(晶胶比例1∶0.6-1∶1)进行复苏;当CVP达到8-12 cmH2O后,再根据目标血压适当调整去甲肾上腺素等血管活性药物维持MAP在65-90 mmHg,尿量≥0.5 ml/(kg·h)。若此时SvO2仍未达标则静脉泵入多巴酚丁胺,以2.5 μg/(kg·min)为起始剂量,按需调节,直至达标,最大可增加至20 μg/(kg·min)。②所有患者均采用SIMV模式进行机械通气,潮气量8-10 ml/kg,PEEP 5-8 cmH2O,FiO240%-60%,呼吸频率10-12次/分,维持动脉血二氧化碳分压(PaCO2)35-45 mmHg。③术后必要时输入红细胞悬液维持血红蛋白≥90 g/L、红细胞压积≥0.30,增加血液携氧能力。④镇静和镇痛。
1.3 观察指标经Swan-Ganz漂浮导管采用温度稀释法对患者的CO进行测定,并计算心脏指数(CI),经漂浮导管、桡动脉导管分别取混合静脉血和动脉血进行血气分析。入ICU后12 h内每2 h分别监测混合静脉和动脉血气指标,并计算出Pv-aCO2。根据术后12 h的Pv-aCO2平均值分为两组,Pv-aCO2≥ 6 mmHg设定为高Pv-aCO2组(n=52),Pv-aCO2<6 mmHg设定为低Pv-aCO2组(n=68)。比较两组患者T0、T6及T12三个时间点的CVP、MAP、CI及动脉血乳酸(Lac)水平。记录两组患者术后机械通气辅助时间、ICU停留时间、术后并发症发生情况。

2 结果
2.1 两组患者一般资料比较
两组患者性别、年龄、体质指数(BMI)、高血压、糖尿病、慢性阻塞性肺疾病、SinoSCORE评分、纽约心脏病协会(NYHA)分级、左室射血分数(LVEF)以及手术时间比较,无统计学差异(均P>0.05),具有一定可比性。见表1。
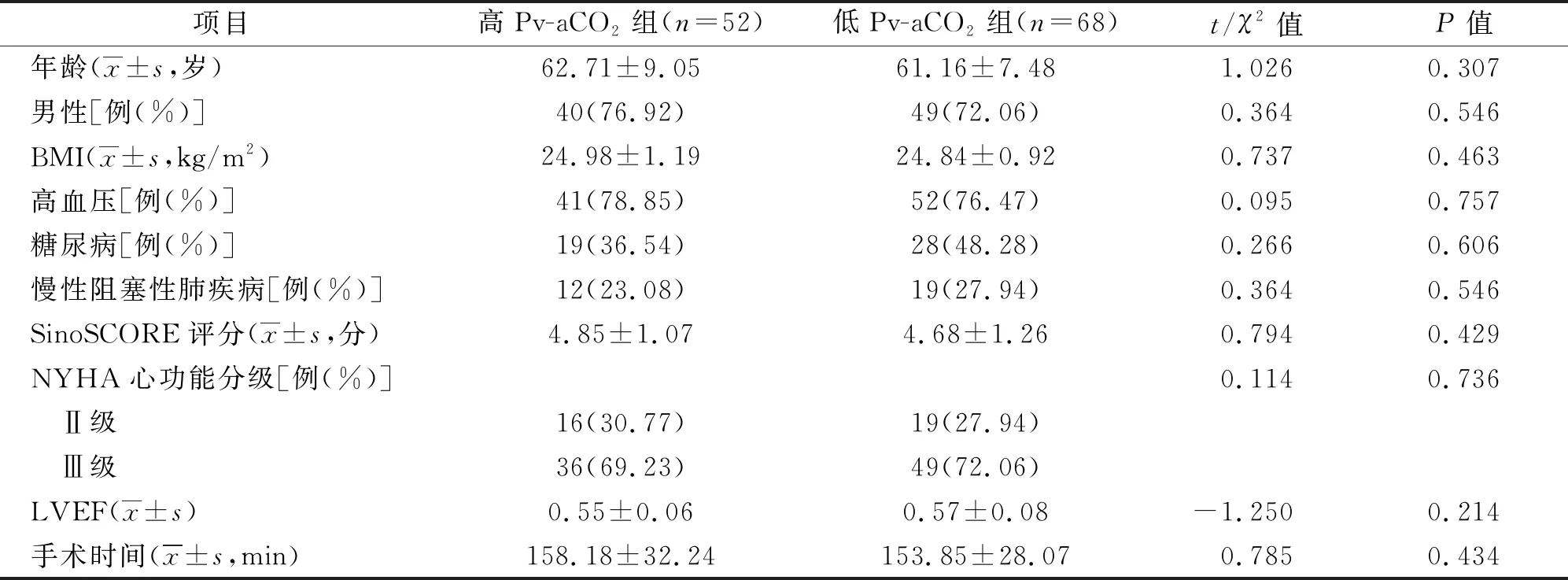
表1 两组患者一般资料比较
2.2 两组患者OPCABG术后12 h内血流动力学指标和乳酸水平比较
两组患者T0时CVP、MAP、CI、Lac比较差异无统计学意义(P>0.05),T6、T12时CVP、MAP、CI均明显升高(P<0.05),Lac明显下降(P<0.05),且低Pv-aCO2组MAP、CI水平高于高Pv-aCO2组,差异具有统计学意义(P<0.05)。两组间CVP、Lac比较差异无统计学意义(P>0.05)。见表2。

表2 两组患者OPCABG术后血流动力学及乳酸比较
2.3 两组患者OPCABG术后机械通气和ICU停留时间及并发症比较
与高Pv-aCO2组比较,低Pv-aCO2组患者机械通气辅助时间、ICU停留时间均明显缩短,差异有统计学意义(P<0.05)。高Pv-aCO2组术后发生低心排血量综合征11例、急性肾损伤2例、呼吸机相关性肺炎2例,并发症发生率为28.85%(15/52);低Pv-aCO2组术后发生低心排血量综合征9例、急性肾损伤3例、呼吸机相关性肺炎1例,脑梗死1例,并发症发生率为20.59%(14/68),两组患者并发症的发生率无统计学差异(P>0.05)。见表3。
2.4 Pv-aCO2与CI、Lac的相关性分析
将两组患者不同时间点测得的Pv-aCO2、CI及Lac水平绘制成散点图并分析其相关性,T0、T6、T12时Pv-aCO2与CI均呈负相关(r=-0.751、-0.735、-0.742,P<0.001),与Lac均无相关性(r=0.156、0.209、0.185,P=0.125、0.085、0.106)。见图1。

图1 非体外循环冠状动脉旁路移植术后转入ICU 6 h(T6)时Pv-aCO2与CI(A)、Lac(B)的相关性
3 讨论
近年来,随着冠心病的发病率呈井喷式增长,尤其是合并高危因素的多支血管病变患者越来越多,冠状动脉旁路移植术(CABG)成为其延长生存时间、改善生存质量的主要方法。尽管与常规体外循环CABG对比,OPCABG避免了体外循环对组织器官的损伤,但由于麻醉药物的体内代谢、失血等因素,OPCABG术后早期多存在相对不足的有效循环血量。传统方法常常根据CVP、血压和尿量进行容量复苏,维持循环,然而由于患者术前心功能差、开胸手术对呼吸循环的影响等诸多因素,对液体耐受性差,容易出现容量负荷过重导致心衰、肺水肿、低氧血症等发生,或容量负荷不足影响循环稳定、组织灌注而出现MODS[2,5]。目前如何在OPCABG术后早期识别组织灌注不足、及时进行液体复苏及减少术后并发症成为当前心血管外科临床研究的重点。
近二十年来,随着对EGDT认识的进一步深入及临床应用的进一步推广,个体化的EGDT得到了越来越多的临床医生的认同[2-7]。SvO2是肺动脉血中的血氧饱和度,代表全身组织代谢后剩余的氧在混合静脉的饱和度,可反映组织的灌注和氧合程度。根据Fick公式SvO2=SaO2-(VO2/CO×13.4×Hb),可见SvO2既能反映呼吸功能、氧合状态,又能反映循环变化及组织氧耗。与SaO2、CO及Hb对比,SvO2能更特异地反映氧供需平衡的变化,比传统的血流动力学指标更具有优势,常用于评估危重症及心脏术后的血流动力学功能状态[8]。本团队以往的研究表明[2],联合SvO2的EGDT可有效提高心脏术后低血容量患者的临床疗效,降低术后并发症的发生率和死亡率。通常认为SvO2<65%,机体开始出现代偿并发生无氧代谢。然而SvO2的应用存在一定的局限性,如果出现微循环障碍、组织摄氧能力下降或动静脉分流,可出现SvO2的假性正常,而局部组织仍存在缺氧[6-7]。近年来,国内外已开始尝试应用Pv-aCO2或Pcv-aCO2代替SvO2指导休克的早期复苏治疗[5,7,9-10]。由Fick公式Pv-aCO2=k×VCO2/CO可知,Pv-aCO2与VCO2(总二氧化碳含量)成正比,与CO成反比,表示机体是否有足够的血液将外周组织产生的二氧化碳清除,能更好地反映氧供需状态及组织灌注情况。
由于Swan-Ganz导管在非心脏外科的重症患者中应用较少,通常用Pcv-aCO2来代替Pv-aCO2。国内外多位学者报道[6-7],在严重烧伤、感染性休克等重症患者的液体复苏中,Pcv-aCO2≥6 mmHg组较Pcv-aCO2<6 mmHg组CO低且Lac水平高,认为Pcv-aCO2≥6 mmHg提示机体循环血量不足和组织氧合灌注不良。Pcv-aCO2监测也可指导重型颅脑损伤患者的液体治疗[11]。因此,本研究观察SvO2和Pv-aCO2指标在OPCABG术后早期容量复苏中的作用,通过EGDT治疗措施使SvO2≥65%的前提下,发现Pv-aCO2<6 mmHg组MAP、CI水平在T6、T12时显著高于Pv-aCO2≥6 mmHg组(P<0.05)。提示OPCABG术后使Pv-aCO2<6 mmHg的早期容量复苏可进一步改善患者的组织灌注和血流动力学指标。两组OPCABG术后患者入ICU后检测Lac水平普遍升高,分别为高Pv-aCO2组3.70±1.22 mmol/L、低Pv-aCO2组3.89±1.29 mmol/L,提示OPCABG手术虽然避免了体外循环对机体内环境的影响,但术中对心脏的搬动、提升及稳定器内固定等操作可导致患者血流动力学的剧烈波动,产生组织的缺血缺氧,乳酸生成增加,所以术中也应重视血流动力学稳定和组织氧供需平衡。
Morel等报道[12],Pcv-aCO2水平的高低与心外科术后患者的机械通气时间、ICU停留时间及并发症无关。Habicher等报道[13],经体外循环心脏手术的患者在ScvO2≥70%的前提下,Pcv-aCO2≥8 mmHg与乳酸水平增加、脏器功能不全有关,并延长了机械通气时间和ICU停留时间。本研究结果表明,与Pv-aCO2≥6 mmHg组患者对比,Pv-aCO2<6 mmHg组患者机械通气时间、ICU停留时间明显缩短(P<0.05),术后发生低心排血量综合征、新发急性肾损伤、呼吸机相关性肺炎及脑梗死并发症的发生率无统计学差异(P>0.05)。导致以上不完全相同结果的原因可能与研究人群、手术类型以及检测指标等不同有关。本研究选择冠心病、手术类型单一,且均为非体外循环下手术,检测指标为更能准确反映全身组织氧供需平衡的指标Pv-aCO2,能准确反映出OPCABG术后以Pv-aCO2为指导的早期容量复苏对机体的影响。根据Fick公式,Pv-aCO2与VCO2成正比,与CO成反比。本研究通过相关性分析发现Pv-aCO2与CI呈显著负相关,可评估CI/CO是否足以清除体内产生的二氧化碳;Pv-aCO2与乳酸水平无相关性,提示Pv-aCO2指标的高低不能反映机体缺氧的情况,与霍丽坤等[5]研究报道一致,需要进一步筛选出能反应机体缺氧的临床指标。
综上所述,Pv-aCO2可作为SvO2的有益补充,进一步指导OPCABG术后患者早期的容量复苏,有助于判定CO/CI能否作为机体清除外周组织产生的二氧化碳的指标。以Pv-aCO2为导向的EGDT在OPCABG术后患者治疗中有助于缩短机械通气时间和ICU停留时间,具有一定的临床应用价值。
