冻结及冻藏温度对小龙虾品质的影响
2022-10-24杨海琦陈季旺田宏伟王海滨
杨海琦,陈季旺,3,4*,徐 言,田宏伟,廖 鄂,3,4,王海滨,3,4
(1 武汉轻工大学 食品科学与工程学院 武汉 430023 2 湖北周黑鸭食品工业园有限公司 武汉 430000 3 湖北省农产品加工与转化重点实验室 武汉 430023 4 国家小龙虾加工技术研发分中心(潜江) 湖北潜江 433100)
小龙虾的季节效应非常明显,从秋季开始到第二年的春季是小龙虾的“枯竭期”,虾的资源紧缺且肉质较差。小龙虾具有地域性,养殖和加工主要集中于我国湖北、湖南、安徽、江苏等长江流域地区[1]。研究小龙虾的保藏方法,延长其贮藏期,为小龙虾的周年加工提供稳定的原料非常迫切。
冻藏可以抑制微生物生长和内源酶活性,延长水产品的贮藏期。目前,国内外关于水产品冻藏保鲜的研究集中于冻藏条件的优化。江艳华等[2]为分析冰衣量对冻南美白对虾品质的影响,测定了不同冰衣处理的冻虾肉的持水力、弹性、硬度、pH值、挥发性盐基氮(TVB-N 值)、丙二醛(MDA)含量。结果显示:包冰衣能显著抑制冻虾肉TVB-N值的增加,对持水力、pH 值、MDA 含量和硬度无显著影响。Tanaka 等[3]探究了冻藏温度和冻藏时间对金枪鱼肉品质特性的影响,他们根据pH 值将金枪鱼肉分为两组(pH 值<6.2,pH 值>6.8),冻藏温度分别为-20,-35,-40,-45,-60 ℃,冻藏16 个月,测定金枪鱼肉的高铁肌红蛋白含量(MetMb%)、汁液流失率、微观结构并进行感官评价。结果显示: 对于-40 ℃以上冻藏的金枪鱼肉,pH 值越低,MetMb%越高;对于-45 ℃及-45 ℃以下冻藏的鱼肉,MetMb%稳定,与pH 值无相关性。有研究对水产品冻藏保鲜机制做了深入分析。Yang 等[4]为确定河豚冻藏过程中肉质软化的主要因素,分别比较3 种处理(液氮冻结、碘乙酸浸渍、抗坏血酸协同茶多酚浸渍)的河豚的冰晶、内源蛋白酶活性、蛋白质和脂质氧化程度,结果显示:冰晶形成与分布是导致冻藏河豚软化的主要因素。
长期冻藏导致冰晶的形成、升华和重结晶,促进蛋白质变性和脂质氧化,使水产品质构、风味和感官品质劣变[5]。冷冻过程中冰晶形成和分布与冻藏温度和冻结速度密切相关,而冻结速度与冻结温度密切相关。说明冻结温度和冻藏温度对水产品品质有重要影响。目前,工业化生产中常采用液氮冻结或鼓风冻结小龙虾原料及其制品,然而,冻结温度的选定通常依靠经验,有关冻结温度对小龙虾冻藏过程中品质的影响未见报道。Sun 等[6]通过测定3 种处理方式 (保水剂浸渍、60 W 超声处理结合保水剂浸渍、80 W 超声处理结合保水剂浸渍)的小龙虾肉在-18 ℃冻藏42 d 的解冻损失、水分含量、水分活度、持水性、质构、TVB-N 值、肌原纤维蛋白含量和三磷酸腺苷酶(ATPase)活性,研究超声波和纳米保水剂对小龙虾冻藏过程中的协同保护作用,结果显示:结合保水剂的60 W 超声波处理,可有效改善冻藏过程中小龙虾的品质。
本文采用冰柜冻结鲜活小龙虾原料 【采用3个冻结温度(-20,-40 ℃和-55 ℃)和2 个冻藏温度(-20 ℃和-40 ℃)】,测定冻藏过程中小龙虾肉的汁液流失率、持水率、剪切力、pH 值、TVB-N值、水分状态,肌肉组织显微结构,分析冻结及冻藏温度对其品质的影响,为小龙虾原料周年供应提供科学依据。
1 材料与方法
1.1 材料与试剂
鲜活小龙虾,湖北周黑鸭食品工业园有限公司提供;三氯乙酸(优级纯)、硼酸(优级纯)、甲基红(优级纯)、溴甲酚绿(优级纯),购于国药集团化学试剂有限公司;硫酸标准滴定溶液 (0.01 mol/L)、2.5%戊二醛溶液,上海源叶生物有限公司。
1.2 设备与仪器
DW-60W388 超低温冰柜,青岛海尔生物医疗有限公司;冷冻干燥机,北京博医康实验仪器有限公司;XHF-DY 高速分散器,宁波新芝生物科技有限公司;XH-C 型涡旋混合器,常州金坛宏华仪器厂;GL-20-Ⅱ高速冷冻离心机,上海安亭科学仪器厂;C-LM3B 数显式肌肉嫩度仪,东北农业大学工学院;DELTA-320pH 计、AL204 精密天平,梅特勒-托利多国际贸易(上海)有限公司;TM4000II扫描电子显微镜,日立高新技术有限公司;NMI20-040V-I 低场核磁共振仪,苏州纽迈分析仪器股份有限公司。
1.3 方法
1.3.1 冻藏小龙虾的制备 选取大小均等,质量约为20~30 g 的鲜活小龙虾。将挑选好的小龙虾用自来水刷洗,用超声波清洗20 min(水的添加量以覆盖虾体为准),放入沸水中热烫1 min,装盒(每盒1 kg 小龙虾),盒中灌入清水(水的添加量以覆盖虾体为准),将盒抽成真空。盒装小龙虾分别置于-20,-40,-55 ℃冰柜中冻结至中心温度达到-15 ℃。将装盒的虾随机分为两组,分别置于-20 和-40 ℃冰柜中冻藏,冻藏周期为24 周,每隔6 周取样用于检测。每次随机取约1 kg 小龙虾,使用流动水解冻。取虾肉时去除头、壳和肠线。通过预试验发现,热烫过程中,小龙虾肉的中心温度保持在85~94 ℃的时间超过35 s,热烫后的小龙虾肉ATPase 活性从2.80 降低至1.08 mg prot/mL,ATPase 活性较低,因此,本文不考虑ATPase对小龙虾品质变化的影响。
1.3.2 汁液流失率 参考Xu 等[7]的方法。准确称量每盒虾冻藏前的初始质量,并做记录。冻藏一定时间将虾取出解冻后,沥干汁液并用滤纸擦干虾壳表面的水分,再次称重。水分含量根据公式(1)计算:

式中:X——汁液流失率,%;M1——小龙虾的初始质量,g;M2——小龙虾解冻后的质量,g。
1.3.3 持水率 参照宋敏等[8]的方法。小龙虾解冻后,去除头、壳和肠线,取2 g 左右的虾肉,搅碎,放入装有定量滤纸5 mL 的离心试管中。称好滤纸和离心管的质量并做好记录,5 000 r/min 离心10 min,然后记录滤纸的质量,持水率根据公式(2)计算:

式中:X——持水率,%;M1——小龙虾肉质量,g;A——小龙虾肉水分含量,%;M2——增重,g。
1.3.4 剪切力 参照NY/T 1180-2006 中剪切力的测定方法[9]。小龙虾解冻后,去除头、壳和肠线,用刀片沿着虾壳内侧取样,取长×宽×高分别为1.2 cm×0.5 cm×0.5 cm 的整块虾肉。将虾肉置于数显式肌肉嫩度仪刀刃上,使切向与肌肉纤维走向垂直,测量剪切力(嫩度)[9]。
1.3.5 pH 值 参考GB 5009.237-2016 中pH 值的测定方法[10]。小龙虾解冻后,去除头、壳和肠线,取2 g 虾肉,加入20 mL 蒸馏水,2 000 r/min 均质1 min,用pH 计测定pH 值。
1.3.6 TVB-N 值 参照GB 5009.228-2016 中的半微量定氮法[11]。称取10 g 虾肉,加入20 g/L 三氯乙酸溶液,摇匀,用滤纸过滤。向接收瓶内加入10 mL 硼酸溶液,5 滴混合指示液 (使用1 份甲基红乙醇溶液与5 份溴甲酚绿乙醇溶液混合指示液)。蒸馏结束后,以盐酸或硫酸标准滴定溶液(0.01 mol/L)滴定至终点,终点颜色为紫红色,同时做试剂空白。
1.3.7 肌肉组织的显微结构观察 参考Li 等[12]的方法。将虾腹部的肉横切成1 mm×1 mm×1 mm 左右的正方形小块,立即置于2.5%的戊二醛溶液中进行固定处理(4 ℃),固定后用磷酸盐缓冲溶液冲洗,然后依次使用50%,70%,80%,90%,100%乙醇梯度脱水,真空冷冻干燥、喷金后使用扫描电子显微镜 (SEM) 观察肌原纤维的横切面微观结构(100×)。
1.3.8 水分状态 参考Wang 等[13]的方法。将小龙虾肉切成2 cm×2 cm×2 cm 左右的正方体,用保鲜膜包裹后置于40 mm 圆形玻璃管底部的中间位置,将玻璃管放入已预热好且温度稳定在32 ℃的低场核磁共振仪的探测口中。测定序列为CPMG。参数设定为:PRG=1,PFD=0.002,RG1=30,TW=3 000,NS=8,TE=0.1,NECH=7 000。测得曲线后,用SIRT 进行反演。
1.3.9 数据处理 每组数据重复测定3 次,持水率和剪切力重复测定6 次。结果用平均值±标准偏差(SD)表示。应用SPSS 软件对数据进行统计分析,采用ANOVA 进行方差分析、Duncan 多重极差检验比较平均值在显著性水平上的差异,P>0.05判定为差异不显著,P<0.05 判定为差异显著。
2 结果与分析
2.1 小龙虾冻结过程中温度的变化
在水产品冻结过程中,中心温度从-1 ℃降到-5 ℃是生成最大冰晶的阶段[14]。由图1可以看出,冻结温度为-20,-40,-55 ℃时,小龙虾肉的中心温度达到-5 ℃的时间分别为4,13,35 min。-20 ℃冻结速度明显低于-40,-55 ℃。
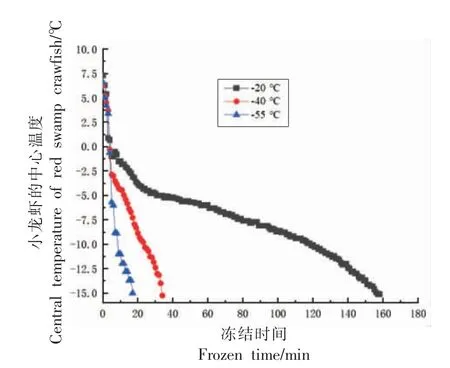
图1 小龙虾冻结过程中心温度的变化Fig.1 Change in central temperature of red swamp crawfish during frozen
2.2 小龙虾冻藏过程中汁液流失率和持水率的变化
水分含量可以用来评价虾肉的新鲜程度,衡量小龙虾肉水分含量的指标有持水率、汁液流失率等[15]。由表1可以看出,小龙虾肉的汁液流失率随着时间的延长呈现上升的趋势,可能是虾肉中的自由水在冻结过程中形成冰晶,冰晶破坏了虾肉的细胞结构,而且这种破坏是不可逆的,因此在解冻过程中,形成冰晶的这部分水流失[16]。此外,冻结过程中形成的冰晶使肌纤维被破坏,导致虾肉蛋白质变性,与蛋白质紧密结合的一部分水转化成自由水,在低温环境下冻结成冰晶,解冻后流失(低场核磁共振仪观察到的小龙虾的水分分布确认了这种变化)。冻结温度相同时,-40 ℃冻藏的小龙虾汁液流失率显著低于-20 ℃冻藏(P <0.05),可能是较低的冻藏温度抑制了微生物的生长,降低了肌纤维被破坏程度(SEM 观察到的小龙虾微观结构验证了这种变化),减轻了虾肉蛋白质的变性程度,延缓了结合水向自由水的转化;冻藏温度相同时,-20 ℃冻结的小龙虾肉的汁液流失率较低。这可能是较低的冻结温度使小龙虾冻结更快,形成冰晶较小,减少了小龙虾肉水分的流失。
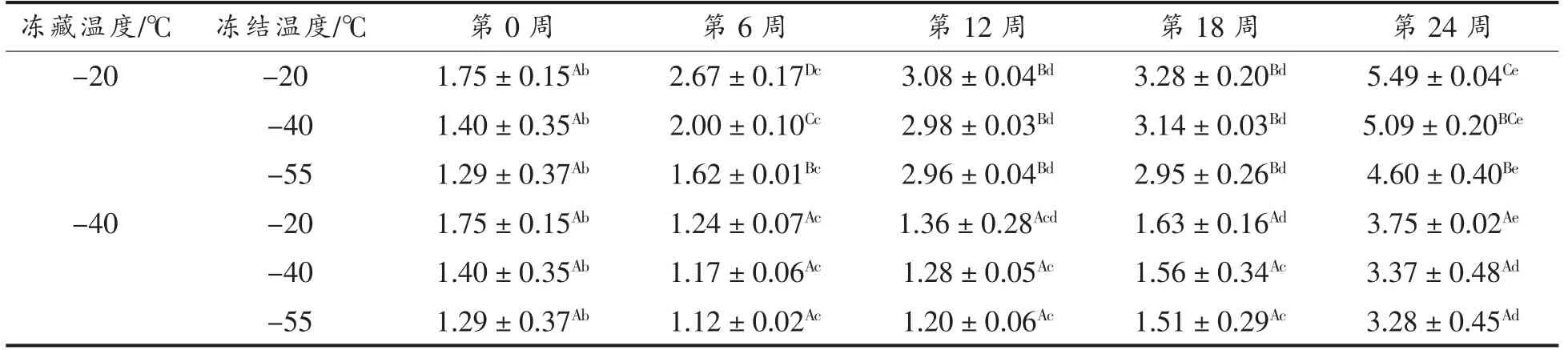
表1 小龙虾冻藏过程中汁液流失率的变化(%)Table 1 Change in juice leakage of red swamp crayfish during freezing storage (%)
由表2可以看出,小龙虾肉的持水率随着时间的延长均呈现先降低再增加的趋势,与谭明堂等[17]和Zang 等[18]报道的结果类似。-20 ℃冻藏的小龙虾肉的持水率在冻藏至第6 周显著降低 (P<0.05),-40 ℃冻藏的持水率在第6 周也明显下降,但不显著(P>0.05)。可能是-20 ℃冻藏的小龙虾发生更严重的重结晶,较大的冰晶使细胞产生机械损伤、虾肉蛋白质变性,导致肌肉结合水的能力降低。持水率在冻藏第12 至第24 周显著增加(P<0.05),可能是采用了加水覆盖冻藏方式,虾肉中的自由水在结晶时,部分组织被一起冻结,使得虾肉内部的冰晶和外面覆盖的冰层存在浓度差。在冻藏过程中,外部冰层的水分向虾肉转移,导致虾肉水分含量增加(数据未显示),使持水率呈现升高的趋势。
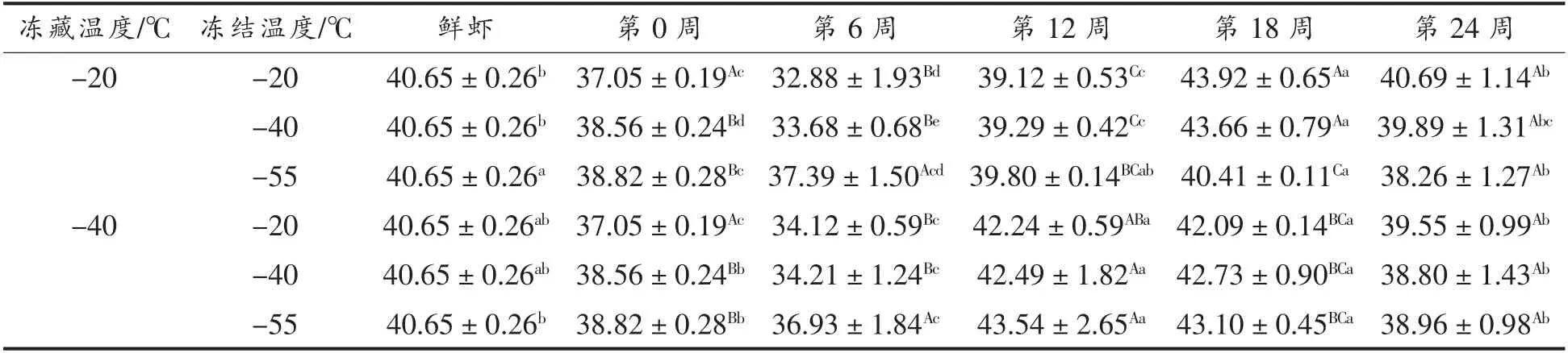
表2 小龙虾冻藏过程中持水率的变化(%)Table 2 Change in WHC of red swamp crayfish during freezing storage (%)
冻藏温度相同时,冻藏第6 周至18 周,-55 ℃冻结小龙虾肉的持水率显著高于-20 和-40 ℃冻结组(P<0.05)。这可能是-55 ℃比-20 ℃和-40℃冻结的冻结速度更快,因此小龙虾在冻结时形成的冰晶更小,肌纤维被破坏程度更低,使得-55℃冻结组小龙虾肌肉结合水的能力更强,持水率更高。冻结温度相同时,冻藏第12 周后,-40 ℃冻藏组虾肉中的持水率显著高于-20 ℃冻藏组 (P<0.05)。持水率的变化趋势跟汁液流失率类似。
2.3 小龙虾冻藏过程中剪切力的变化
由表3可以看出,小龙虾肉的剪切力随着时间的延长均呈现先增大再减小然后稳定的趋势。对比小龙虾肉的剪切力与持水率发现,二者的变化趋势相反。这说明小龙虾肉的剪切力可能与持水率有关:冻藏第12 周时,虾肉的剪切力显著增大(P<0.05),可能是冻结时虾肉内部的水分形成冰晶,冰晶破坏了虾肉肌纤维,导致解冻时失水,损伤了虾肉的收缩能力,使得剪切力增大。虾肉的剪切力在第18 周开始显著减小(P<0.05),可能是随冻藏时间增大,冰晶增大,虾肉的蛋白质发生变性,肌纤维遭到破坏,使得剪切力减小[19]。
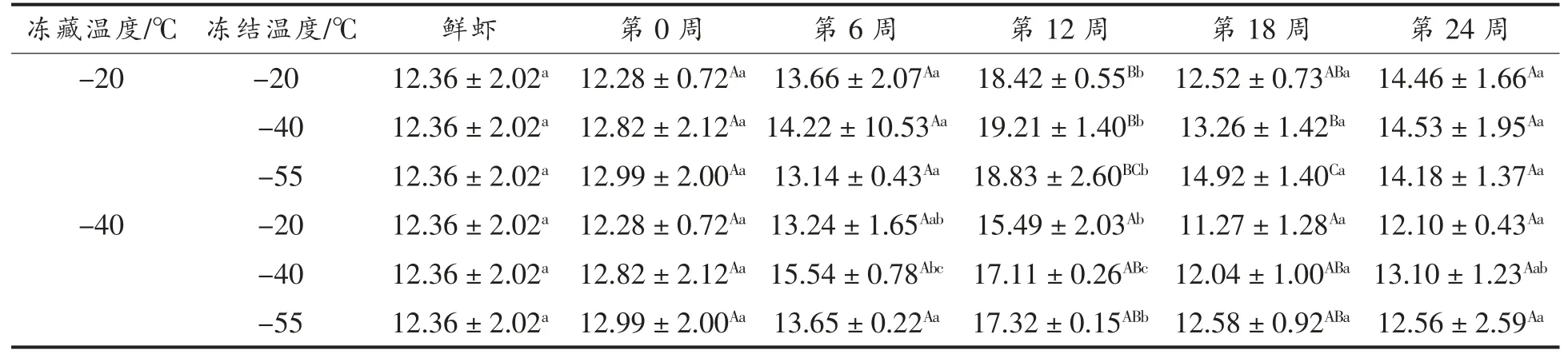
表3 小龙虾冻藏过程中剪切力的变化(N)Table 3 Change in shearing force of red swamp crayfish during freezing storage (N)
冻藏温度相同时,-20 ℃较-40 ℃和-55 ℃冻结降低了小龙虾肉的剪切力,可能是较低的冻结温度使小龙虾在冻结时形成的冰晶较小,肌纤维被破坏程度较低,因此剪切力保持较好(SEM 观察到的肌肉显微结构验证了这种变化)。冻结温度相同时,-40 ℃冻藏虾肉剪切力的变化程度低于-20 ℃。这可能是较低的冻藏温度抑制了冻藏过程中的重结晶,减少了大冰晶的形成,使得虾肉细胞结构被破坏的程度降低,减轻了肌肉的损伤,导致了较低的剪切力的变化。
2.4 小龙虾冻藏过程中pH 值的变化
由表4可以看出,小龙虾肉的pH 值随着时间的延长均呈现先减小再增大然后稳定的趋势。冻藏至第6 周,各组pH 值均显著减小(P<0.05),可能是游离脂肪酸质量分数增加所导致(数据未显示)。第6 周至12 周,各组pH 值均显著增大(P<0.05),可能是蛋白质在微生物的作用下分解,产生的碱性物质堆积,使虾肉的pH 值呈增大趋势[20-22]。冻藏12 至24 周,各组pH 值仍呈增大趋势,但不显著(P>0.05),可能是虾肉蛋白质已被大量分解,同时,水分含量轻微增加(数据未显示),使得碱性物质浓度较低。
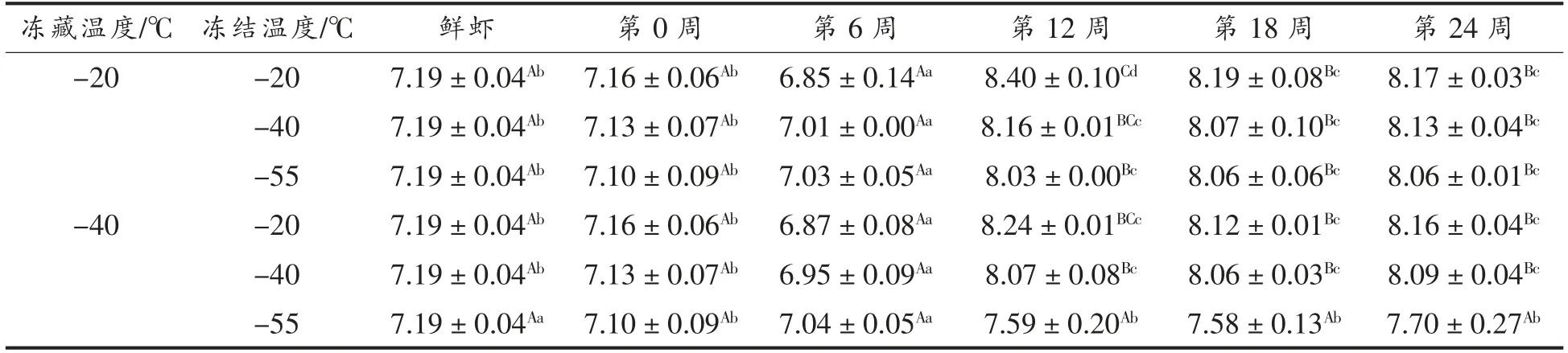
表4 小龙虾冻藏过程中pH 值的变化Table 4 Change in pH value of red swamp crayfish during freezing storage
冻藏温度相同时,冻藏至第12 周,pH 值随冻结温度的降低而减小,冻结温度-20 ℃与-55 ℃差异显著(P<0.05)。这与范碧琴等[23]的研究结果类似,可能是-55 ℃使小龙虾的中心温度更快达到-15 ℃,减少了微生物繁殖的时间。同时,较低的冻结温度能灭活更多不耐低温的微生物,降低了小龙虾肉的初始微生物数量,微生物分解蛋白质产生的碱性胺类物质更少,因此较低冻结温度组的pH 值更小。这种碱性胺类物可以通过TVBN 值的半微量定氮法检测出,后面的TVB-N 值测定结果验证了pH 值在冻藏中后期增大的现象;冻藏第12 至第24 周,冻结温度为-55 ℃时,冻藏温度-40 ℃相较-20 ℃,小龙虾肉的pH 值显著减小(P<0.05)。这可能是较低的冻藏温度较好地抑制微生物的繁殖,使蛋白质降解速度减慢,导致pH 值变化减缓,pH 值较小。
2.5 小龙虾冻藏过程中TVB-N 值的变化
我国标准规定了可食用淡水鱼虾的TVB-N值应不超过20 mg/100 g[23]。由表5可以看出,小龙虾肉的TVB-N 值随着时间的延长均呈现增大的趋势。这可能是微生物数量随时间的延长而增加,降解蛋白质产生的非蛋白氮更多[24]。
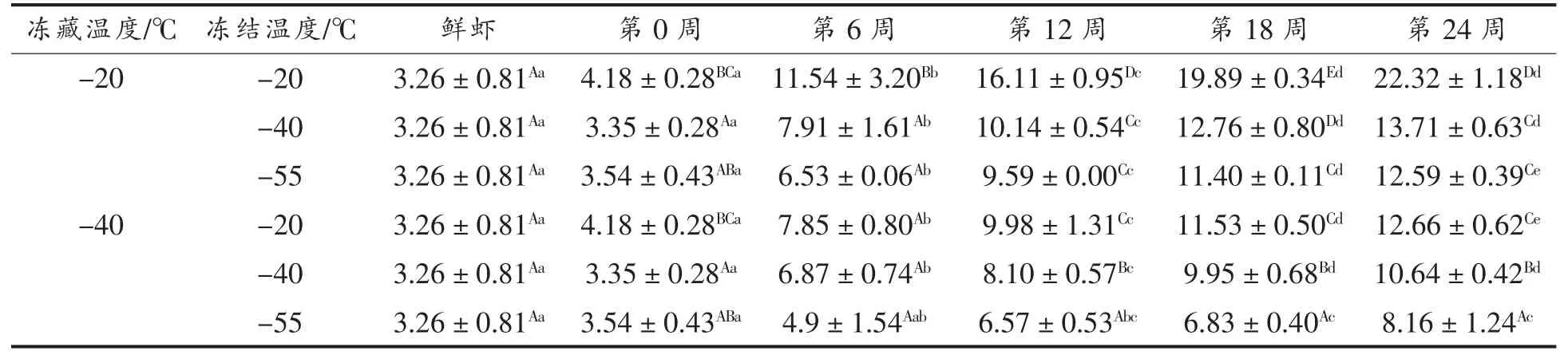
表5 小龙虾冻藏过程中TVB-N 值的变化Table 5 Change in TVB-N value of red swamp crayfish during freezing storage
-20 ℃冻结的小龙虾肉的TVB-N 值显著低于-40 和-55 ℃(P<0.05)。这可能是较低的冻结温度使更多不耐低温的微生物失活甚至死亡,也验证了pH 值在冻藏中后期增大的现象[25]。
冻结温度相同时,冻藏温度-40 ℃相较-20 ℃,TVB-N 值增大速率降低(P<0.05)。这可能是较低的冻藏温度使得小龙虾在冻藏期间增长的微生物数量较低,因此小龙虾在冻藏期间腐败变质的速度降低。-20 ℃冻结-20 ℃冻藏的小龙虾在冻藏至第24 周时,TVB-N 值达到约22.32 mg/100 g,超过了国家标准(GB 2733-2015)规定值,已不适合食用。
2.6 小龙虾冻藏过程中肌肉微观结构的变化
由图2可以看出,未经冻藏的小龙虾肉肌纤维孔隙分布均匀、排列有序,一层薄的结缔组织(肌内膜)包围着肌纤维,肌束膜和肌内膜与肌纤维连接紧密,肌纤维之间的孔隙可能是沸水热烫导致的肌纤维热变性或制样切割时造成的机械损伤。
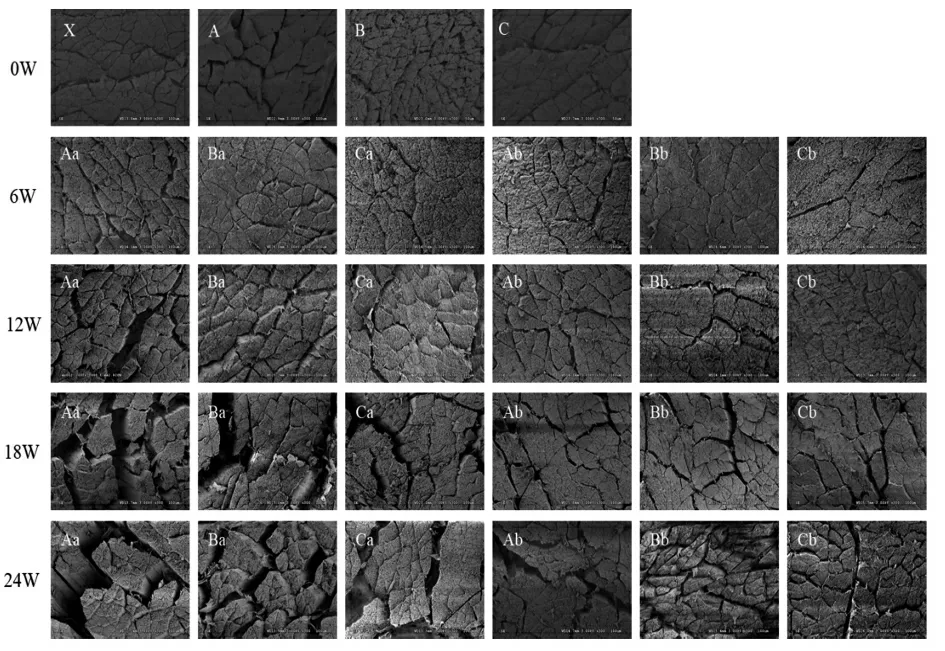
图2 小龙虾冻藏过程中肌肉微观组织结构的变化Fig.2 Change in myofibrillar microstucture of red swamp crawfish during freezing storage
冻藏温度相同时,随着冻藏时间的延长,小龙虾肌肉结构(横断面)的孔隙均增大、肌纤维排列混乱。冻结温度较低的小龙虾,肌纤维之间孔隙更小更均匀,肌束膜、肌内膜和肌纤维之间更紧密。-55 ℃冻结的小龙虾肉的肌纤维横断面在冻藏6周与新鲜时差别不大。这可能是较低的冻结温度使小龙虾的中心温度更迅速降至-15 ℃,形成冰晶较小,因此较好地保持了小龙虾冻结过程中肌肉的完整性。这也验证了-55 ℃冻结的小龙虾肉剪切力和持水率较高的现象[26]。
冻结温度相同时,与-20 ℃比较,冻藏温度-40 ℃的肌纤维孔隙更多、更小,且肌纤维断裂程度较轻,膜和结缔组织颗粒脱落更多,与Qian等[28]观察到的现象类似。这可能是较高的冻藏温度下,更多肌纤维和肌内膜、肌束膜等结缔组织被降解,使得蛋白质变性更严重,因此SEM 能观察到不平整的肌纤维横切面,以及覆盖在肌纤维表面破碎的颗粒状的膜。这与Xie 等[29]观察到冻藏虾肉的微观结构类似。-20 ℃冻藏组在冻藏第12 周时,肌纤维孔隙明显增大,肌纤维发生断裂,并可以看到膜和结缔组织颗粒的脱落,这可能是失水和蛋白质降解导致肌纤维收缩[29-31]。-40 ℃冻藏组在冻藏第18 周时出现上述现象。冻藏第24 周时,所有试验组的孔隙进一步增大,每束肌肉被挤压,聚集更加紧密。
SEM 观察到的小龙虾肌肉横断面的变化跟汁液流失率、持水率、剪切力、水分状态等类似,进一步说明了冻结温度和冻藏温度明显影响了小龙虾肉的肌纤维结构,较低的冻结和冻藏温度使小龙虾冻藏过程中的品质劣化程度轻,小龙虾肉的品质更好。
2.7 小龙虾冻藏过程中水分状态的变化
如图3所示,弛豫时间小于10 ms 的部分代表结合水,弛豫时间小于100 ms 大于10 ms 的部分代表不易流动水,弛豫时间大于100 ms 的部分代表自由水,峰面积占比P21、P22、P23分别代表结合水、不易流动水、自由水3 种水分状态的占比[32]。
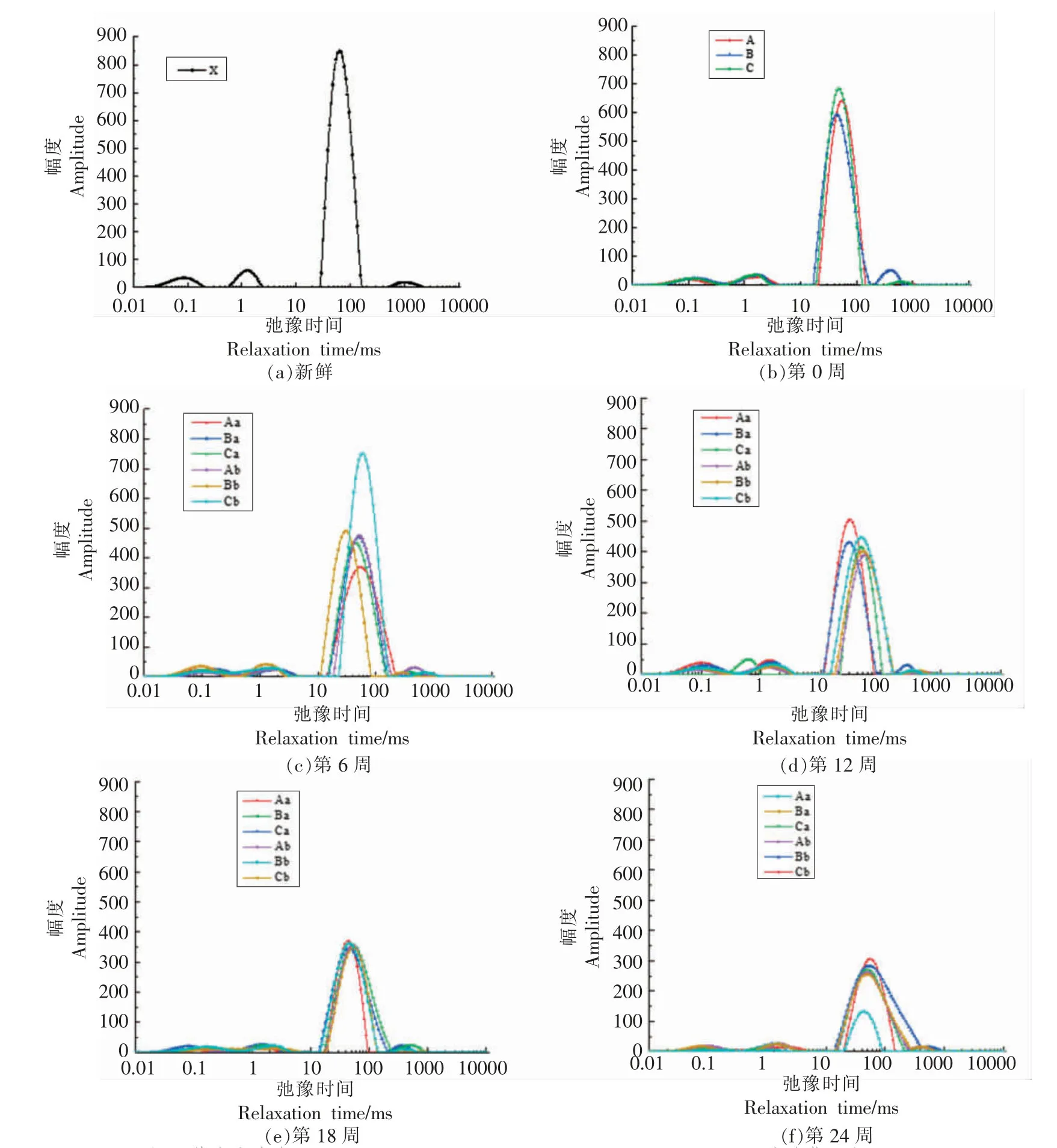
图3 小龙虾冻藏过程中水分状态的变化Fig.3 Change in moisture state of red swamp crawfish during freezing storage
P21和P22随冻藏时间的延长逐渐减小,P23则逐渐增大。这说明小龙虾肉的水分逐渐由结合水和不易流动水转化成自由水,自由水增多造成解冻后汁液流失率增大,与汁液流失率结果一致。这可能是冻藏过程中肌纤维被微生物降解,同时冰晶逐渐增大,破坏肌纤维的结构,使得肌纤维结合水的能力下降。
冻藏温度相同时,冻结温度对P21、P22、P23影响不显著。冻结温度相同时,冻藏温度-20 ℃组的P22明显小于-40 ℃组的,P23则大于-40 ℃组的。这可能是较低的冻藏温度抑制了重结晶过程和微生物对肌纤维的降解,减少了向自由水转化的不易流动水。
3 结论
冻结温度和冻藏温度显著影响了小龙虾冻藏过程中的品质变化。较低的冻结温度通过加快冻结速度,使得形成的冰晶较小,降低了对肌纤维的破坏程度;较低的冻藏温度抑制重结晶和微生物繁殖,保护了小龙虾肌肉的组织结构和肌纤维的完整性,结合水和不易流动水的比例较高,使得小龙虾肉的汁液流失率、剪切力、pH 值、TVB-N 值较低,持水率较高,从而使小龙虾保持更好的品质。
