刺梨多糖改善肥胖大鼠胰岛素抵抗的作用和机制
2022-10-24张帅军唐月梅牛英鹏
张帅军 唐月梅 牛英鹏 张 锦
(1. 赣南师范大学科技学院,江西 赣州 341000;2. 河南大学,河南 开封 475001;3. 平顶山市第一人民医院,河南 平顶山 467000)
肥胖是一种普遍存在且严重危害人类健康和生活质量的疾病,可加剧胰岛素抵抗(IR)的产生[1],诱发2型糖尿病(T2DM)的发生、发展[2],增加心血管系统疾病的危险性[3]。IR是许多内分泌代谢失调相关疾病的重要发病基础,可引起T2DM、高脂血症、动脉硬化等代谢失调性疾病的发生、发展[4]。刺梨(Rosaroxburghii)是蔷薇科落叶灌木刺梨的果实,具有药食同源属性[5]。刺梨多糖(Rosaroxburghiipolysaccharide,PRR)是刺梨最主要的活性成分之一[6],其抗氧化、降血糖等生理活性已被证实,但具体作用机制还不够明确。研究拟采用高脂膳食诱导大鼠肥胖胰岛素抵抗模型,通过补充不同剂量的PRR,观察PRR对模型大鼠体质量和血清生化指标的影响,从PI3K/AKT/GLUT4信号通路方面探究PRR改善IR的作用机制,以期为刺梨作为功能性食品、医药、保健品的进一步开发和利用提供参考。
1 材料与方法
1.1 材料与仪器
刺梨果粉:陕西盛恒生物有限公司;
SD雄性大鼠:SPF级,8周龄,体质量210~220 g,河南省实验动物中心;
西格列他钠:规格16 mg,成都微芯药业有限公司;
超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、丙二醛(MDA)检测试剂盒:南京建成生物工程研究所;
葡萄糖、胰岛素检测试剂盒:上海科顺生物科技有限公司;
总胆固醇(TC)、甘油三酯(TG)检测试剂盒:北京索莱宝科技有限公司;
磷脂酰肌醇3激酶(PI3K)检测试剂盒:合肥知恩生物技术有限公司;
葡萄糖转运蛋白4(GLUT4)检测试剂盒:武汉科斯坦生物科技有限公司;
超声波清洗机:JM-03D-40型,深圳洁盟清洗设备有限公司;
紫外可见分光光度计:721N型,上海仪电分析仪器有限公司;
电子分析天平:FA2004型,上海精密仪器仪表有限公司;
血糖测定仪:GA-3型,上海聚慕医疗器械有限公司;
全自动生化分析仪:AU480型,贝克曼库尔特商贸中国有限公司;
荧光定量PCR反应仪:HH222-LD-PCR型,山东莱恩德智能科技有限公司;
转印电泳仪:DYCZ-40K型,北京六一生物科技有限公司;
凝胶成像分析系统:WD-9413B型,北京六一生物科技有限公司。
1.2 方法
1.2.1 刺梨多糖的提取和纯化 取刺梨果粉,参照唐健波等[7]超声辅助提取法,液料比(m刺梨果粉∶V水)为1∶40 (g/mL),功率120 W、温度80 ℃、4 000 r/min下离心10 min,提取滤液,重复上述操作2次,合并3次提取液,减压浓缩,用80%的乙醇4 ℃下醇沉24 h,Sevag法除蛋白(V氯仿∶V正丁醇=4∶1)、AB-8大孔树脂脱色(60~16目)、过滤收集滤液,上DEAE-纤维素柱,依次用蒸馏水和不同浓度梯度的NaCl洗脱,用琼脂糖凝胶CL-6B纯化,洗脱液分部收集,再用0.2 mol/L NaCl洗脱,经苯酚硫酸法检测,收集多糖高峰部分,真空干燥得PRR-1 (蒸馏水洗脱)、PRR-2 (0.1 mol/L NaCl洗脱)、PRR-3 (0.2 mol/L NaCl洗脱)、PRR-4 (0.3 mol/L NaCl洗脱)等多糖干品。
1.2.2 刺梨多糖含量和相对分子量的测定
(1) 刺梨多糖含量:采用苯酚—硫酸法[8],取刺梨纯多糖各组分样品,溶于0.2 mol/L NaCl中,上琼脂糖凝胶CL-6B凝胶柱,分部收集,在紫外可见分光光度计上记录491 nm处的OD值,根据标准曲线计算刺梨多糖含量。
(2) 相对分子量:采用凝胶渗透色谱法[9],以标准品的相对分子质量对数为纵坐标,以洗脱体积为横坐标,对曲线进行回归拟合得标准品分子量标准曲线,根据曲线下的样品洗脱体积求刺梨多糖组分的相对分子量。
1.2.3 刺梨多糖溶液的配制 称取1 g刺梨多糖溶于20 mL去离子水中,配置质量浓度为50 mg/mL的刺梨多糖溶液。
1.2.4 分组、建模与给药
(1) 分组:按体质量大小采用区组化分组的方法,分为正常对照组(NC)、模型组(M)、阳性对照组(PC)、低剂量刺梨多糖组(SM)、高剂量刺梨多糖组(HM),每组10只。
(2) 建模:参照张晓圆等[10]高脂饲料诱导大鼠肥胖胰岛素抵抗方法建模,以口服葡萄糖耐量试验(OGTT)为基准,计算曲线下面积(AUC),以AUC高于NC组AUC均值为IR造模成功的标准。
(3) 给药:参照《实验动物学》中人与动物剂量的换算标准,SM组、HM组分别以100,200 mg/kg的剂量灌胃刺梨混悬液,NC组、M组以SM组剂量灌胃0.9% NaCl溶液,PC组以0.11 g/kg的西格列他钠片(常人用量为32 mg/d,通过体表面积法换算SD大鼠等效剂量约为2.82 mg/d)溶解灌胃,每天1次,直至第12周次末。
1.3 指标检测
1.3.1 大鼠体质量的测量 试验期间,每周专人定时用分度值为0.1 g秤称量大鼠体质量。
1.3.2 大鼠血清脂代谢指标和氧化应激指标的测定
12周末大鼠禁食12 h,麻醉下腹部主动脉取血3 mL,离心、分离血清,-20 ℃冰箱保存。取待测血清,比色法检测血清TC、TG的含量、黄嘌呤氧化酶法测定血清SOD的活性、微量酶标法测定血清GSH的浓度,硫代巴比妥酸法测定血清MDA含量。
1.3.3 大鼠血清葡萄糖、胰岛素含量的测定 取待测血清,以葡萄糖氧化酶法测定空腹血糖(FBG)值,酶联免疫吸附法检测空腹胰岛素(FINS)的含量,按试剂盒说明进行测试。按式(1)[11]计算胰岛素抵抗指数(HOMA-IR)。
HOMA-IR=FBG×FINS/22.5,
(1)
式中:
HOMA-IR——胰岛素抵抗指数;
FBG——空腹血糖值,mmol/L;
FINS——空腹胰岛素含量,mU/L。
1.3.4 骨骼肌组织中PI3K、GLUT4蛋白表达的检测
采用蛋白免疫印迹(Western blot)法。用含有蛋白酶抑制剂的RIPA裂解液提取腓肠肌组织蛋白,二辛可宁酸(BCA)法测各组待测液蛋白浓度,稀释到相同浓度,蛋白定量后加上述混合液,按照分离胶为12%、积层胶为4%的SDS-PAGE电泳(120 V,35 min)、转膜(70 V,60 min),5%脱脂奶粉于37 ℃封闭2 h,置一抗稀释液中4 ℃孵育24 h,TBST洗膜,滴加HRP标记的二抗室温下孵育1 h,以增强型化学发光试剂曝光,在WD-9413型凝胶成像系统显影,测量目的蛋白条带的积分光密度。
1.3.5 骨骼肌组织PI3K、GLUT4mRNA表达的检测
采用实时聚合酶链式反应(RT-PCR)法。用含有蛋白酶抑制剂的RIPA裂解液提取腓肠肌组织蛋白,Trizol法提取总的RNA,单样本以2 μg RNA作为初始模板,在逆转录酶的作用下反转录成cDNA。参照魏祎[12]设计的基因引物序列(表1),按照试剂盒说明配置20 μL的反应体系,每组样本检测3个复孔,进行实时荧光PCR。预变性95 ℃、30 s,PCR 95 ℃、5 s,60 ℃、30 s,共40个循环,根据各反应孔Ct值,以2-△△Ct法分析基因的相对表达量。

表1 实时PCR基因引物序列
1.4 数据处理与分析
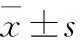
2 结果与分析
2.1 刺梨多糖组分、含量和相对分子量
对多糖组分进行鉴定,经称量计算PRR-1、PRR-2、PRR-3、PRR-4的得率分别为9.38%,6.57%,22.41%,2.98%(粗多糖干重计),其中PRR-3为分离纯化得到的主要组分。根据单糖标准品确定的标准曲线方程,即Y=3.956x-0.007 8,R2=0.999 7,计算出PRR-3总糖含量为86.4%,且单糖组分主要为阿拉伯糖、半乳糖、葡萄糖、甘露糖、木糖等中性单糖。建立PRR-3相对分子量与出峰时间(x)之间的标准曲线,得标准曲线方程为Mw=-0.000 8x3+0.069 8x2-2.169 2x+27.963 1,R2=0.997 1,经分析计算PRR-3的相对分子量大小为56.8 kDa。由于PRR-3分离效果较好,且纯度较高,所以后续以PRR-3为研究对象。
2.2 刺梨多糖PRR-3干预前后各组大鼠体质量和血清脂代谢指标的变化
长期高脂膳食干扰脂质代谢、能量代谢及肠道微生态,触发脂代谢异常,导致肥胖[13]。由图1、表2可知,各组大鼠初始体质量无统计学差异(P>0.05),试验期间M组体质量均显著高于NC组(P<0.01),经刺梨多糖干预后,与M组相比,SM组体质量显著下降(P<0.05),TG、TC含量显著下降(P<0.05);HM组体质量显著下降(P<0.01),TG、TC含量显著下降(P<0.01),且HM组疗效好于SM组,接近于PC组。已有研究[14]表明,刺梨多糖可通过降低全身低度系统性炎症,改善脂代谢紊乱,减少脂肪的储存,降低体质量。试验中,不同剂量的刺梨多糖干预后,各组大鼠均出现体质量和TG、TC含量的下降,且与阳性药物西格列他钠组具有相似的效果。西格列他钠是中国新一代胰岛素增敏剂类候选药物、国家1类新药,临床显现出良好的综合治疗效果及临床安全性特征[15]。说明PRR-3能通过降低炎症从而调节脂代谢,减少脂肪过多储存,有效降低IR大鼠体质量。
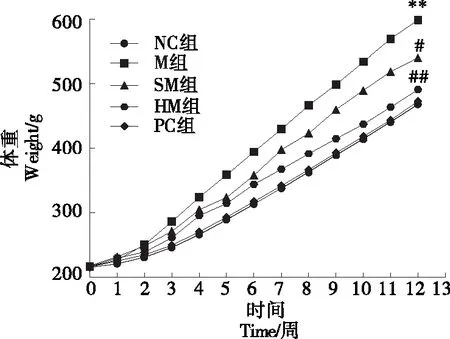
**与NC组比较P<0.01;#与M组比较P<0.05;##与M组比较P<0.05

表2 各组大鼠体质量和血清脂代谢指标的变化†
2.3 刺梨多糖PRR-3干预后各组大鼠血清氧化应激指标的变化
肥胖可触发代谢异常,引起免疫细胞激活和浸润,诱发炎症,触发过氧化应激[16]。由表3可知,M组与NC组相比具有显著性差异(P<0.01),经刺梨多糖干预后能显著提高SOD的活性(P<0.01)、GSH的浓度(P<0.01)和降低MDA的含量(P<0.01),且存在剂量效应关系。主要原因可能与多糖的结构成分有关。研究[17]显示,植物多糖结构多糖环上的羟基可与产生羟自由基等必需的金属离子(Fe2+、Cu2+)发生络合,使其不能产生启动脂质过氧化的羟自由基或不能分解脂质过氧化产生的脂过氧化物,抑制活性氧的生成,发挥抗氧化作用。PRR-3属于植物多糖中的组分,具有植物多糖的结构成分,所以说PRR-3也具有抗氧化作用。
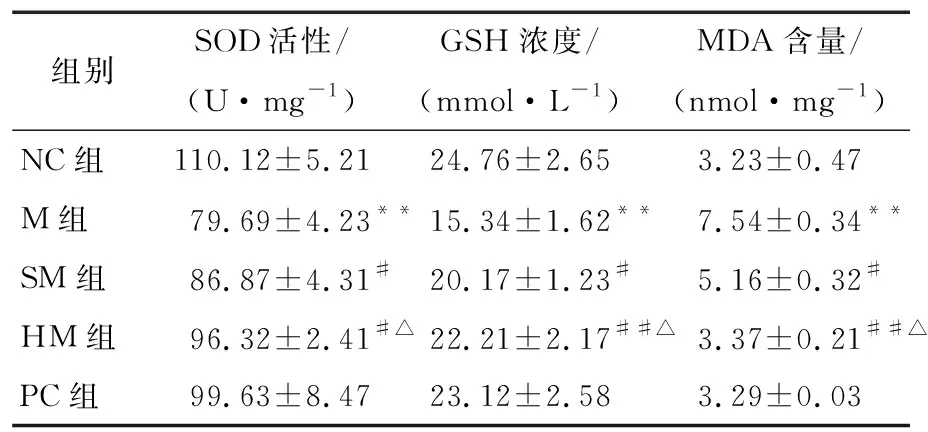
表3 各组大鼠血清氧化应激指标的变化†
2.4 刺梨多糖PRR-3干预后各组大鼠血清葡萄糖、胰岛素水平的变化
生理状态下,胰岛素可通过对葡萄糖的摄入和抑制肝糖原的输出等措施调控血糖的稳定。由表4可知,M组与NC组相比,血糖水平、胰岛素含量和胰岛素抵抗指数方面均有显著性差异(P<0.01)。与M组相比,刺梨多糖干预后的IR大鼠血清水平显著降低(P<0.01),胰岛素含量显著降低(P<0.05或P<0.01),胰岛素抵抗指数也显著降低(P<0.01),且组间呈剂量效应关系,效果与阳性对照组相当。陈超等[14]指出刺梨活性成分(刺梨总多糖提取物)可通过调节胰岛素改善糖尿病小鼠糖代谢紊乱。汪洋等[18]采用体外化学和细胞试验评价了刺梨多糖的降血糖活性。研究结果与陈超等[14]和汪洋等[18]的具有一致性。PRR-3具有调控胰岛素分泌、调节血糖代谢异常等功能。其原因可能是PRR-3抗氧化作用减轻胰腺组织炎症,提升了胰腺的调控能力,降低胰岛素的分泌,增加胰岛素敏感性。
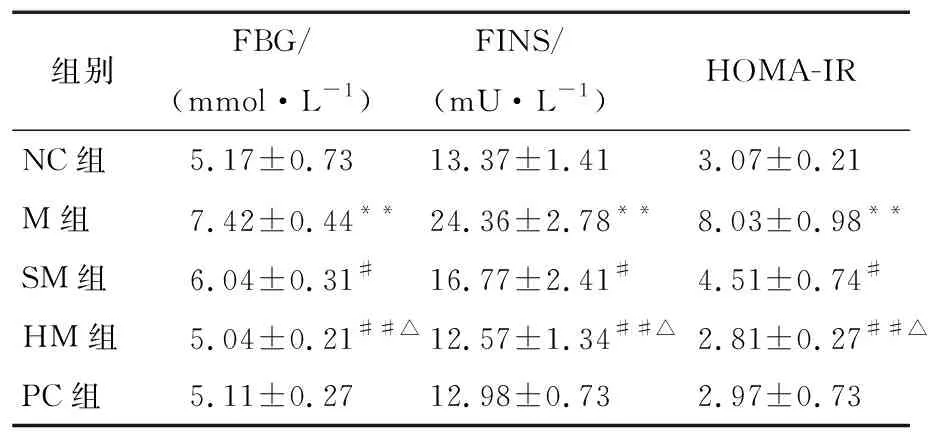
表4 各组大鼠血清FBG、FINS和HOMA-IR的变化†
2.5 刺梨多糖PRR-3干预后各组大鼠骨骼肌PI3K、GLUT4基因和蛋白相对表达的变化
PI3K是骨骼肌介导葡萄糖进入肌纤维内的关键性激酶,可调节胰岛素信号通路上游因子,调控骨骼肌GLUT4转运[19]。由图2、图3可知,M组骨骼肌组织中PI3K、GLUT4mRNA和蛋白表达与NC组相比具有显著差异(P<0.05或P<0.01)。炎症是胰岛素抵抗发生的重要原因之一,Rosca等[20]指出炎性因子可通过自分泌或旁分泌等方式影响核因子等信号途径,诱发胰岛素抵抗加剧,与研究结果一致。经刺梨多糖干预后的大鼠骨骼肌中PI3K、GLUT4mRNA和蛋白表达都升高,与M组相比有显著差异(P<0.05或P<0.01),与阳性药物组作用相当,且效果存在剂量关系。说明PRR-3可上调IR大鼠骨骼肌组织中PI3K、GLUT4mRNA和蛋白表达,提升GLUT4的合成和转运。
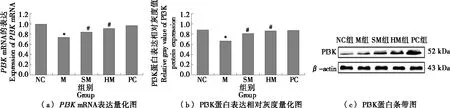
*与NC组比较P<0.05;#与M组比较P<0.05
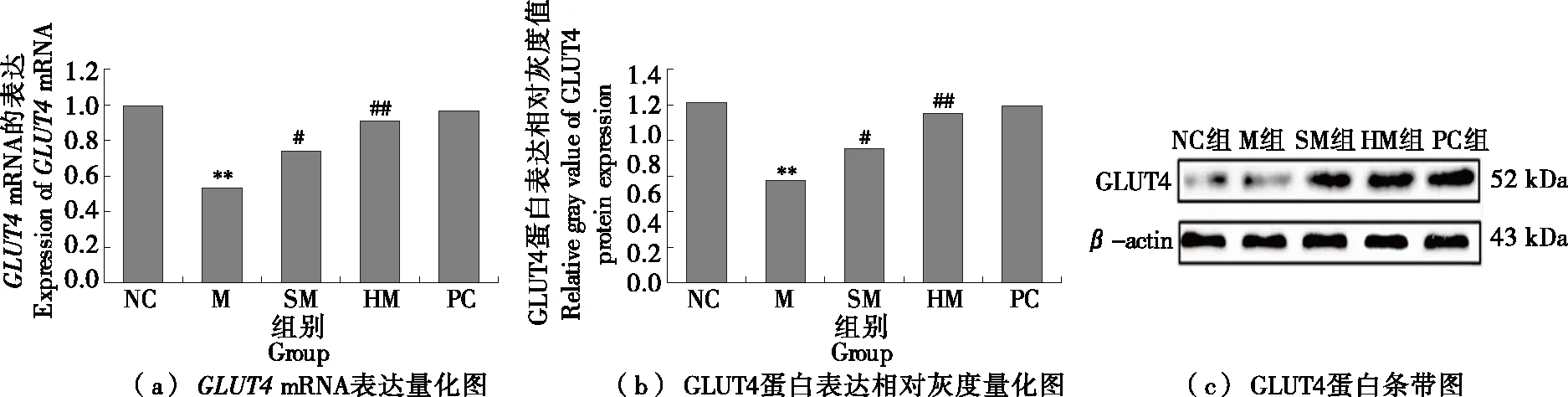
**与NC组比较P<0.01;#与M组比较P<0.05,##与M组比较P<0.01
3 结论
刺梨多糖主要活性成分为0.2 mol/L NaCl洗脱组分,具有抗氧化作用,能够降低胰岛素抵抗大鼠体质量、调节糖脂代谢,改善胰岛素抵抗,其机制可能是通过介导磷脂酰肌醇3激酶/蛋白激酶B/葡萄糖转运蛋白4信号通路提升葡萄糖转运蛋白4实现的。试验中仅对刺梨多糖进行了提取并测定其含量和分子量,未对0.2 mol/L NaCl洗脱组分的分子结构、构效关系及0.2 mol/L NaCl洗脱组分通过磷脂酰肌醇3激酶/蛋白激酶B/葡萄糖转运蛋白4信号通路提升葡萄糖转运蛋白4,转运改善胰岛素抵抗的具体机制进行分析,这是后续将要研究的内容。
