雌二醇降低细胞外组蛋白诱导内皮细胞损伤的作用及机制研究*
2022-10-24舒林飞袁志舟龙永其
杨 帆,舒林飞,袁志舟,李 涛,龙永其,谌 磊△
(1.湖南省株洲市中心医院泌尿外一科 412007;2.海南医学院第二附属医院器官移植科,海口 570216)
脓毒症是临床常见的危重症,其救治难度大、病死率高。脓毒症的主要病理生理特征是全身炎症反应激活,涉及炎症细胞因子的大量释放、氧化应激及细胞凋亡的异常激活等生物学环节,严重者可进展为多器官功能障碍综合征[1-2]。血管内皮细胞损伤在脓毒症病情发展、多脏器功能损伤中起到重要作用,造成内皮损伤的因素复杂,其中从细胞核小体释放进入细胞外的组蛋白具有细胞毒性。多项临床研究[3-4]和基础研究[5]证实,脓毒症患儿及动物模型的血清细胞外组蛋白水平升高且与预后相关。采用大剂量组蛋白短时间冲击处理的方式通过激活核因子-κB(nuclear factor-κB,NF-κB)及p38通路可建立内皮细胞损伤模型[6]。
雌激素是目前已知具有心脑血管保护作用的激素,有临床研究显示血清雌二醇(estradiol,E2)水平不足是脓毒症患者预后不良的危险因素之一[7],另有动物实验证实补充E2可减轻脓毒症动物的脏器损伤[8]。但E2在脓毒症发病过程中的内皮保护作用及机制尚不十分清楚。有研究报道,E2在神经元损伤及心肌肥大模型中的细胞保护作用与抑制p38通路及NF-κB通路有关[9-10]。基于此,本研究在大剂量组蛋白短时间冲击诱导的内皮细胞损伤模型中探索了E2的保护作用,以及NF-κB、p38通路相关的分子机制。
1 材料与方法
1.1 材料
1.1.1细胞株
人脐静脉内皮细胞株(human umbilical vein endothelial cell,HUVEC)购自美国ATCC公司。
1.1.2试剂
小牛胸腺组蛋白(calf thymus histone,CTH)、四唑氮化合物(MTS)细胞增殖试剂盒购自武汉艾美捷科技公司,E2、p38激动剂P79350(储存液浓度0.5 mol/L)购自美国Sigma公司,白细胞介素(interleukin,IL)-1β、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)的ELISA检测试剂盒购自南京建成生物工程研究所,裂解液及TUNEL凋亡检测试剂盒购自上海碧云天公司,活化型caspase-3(cleaved caspase-3)、p38、磷酸化p38(p-p38)、NF-κB、磷酸化NF-κB(p-NF-κB)特异性一抗购自美国CST公司。
1.1.3仪器
细胞培养箱购自美国Thermo公司,多功能酶标仪购自美国Bio-tek公司,荧光显微镜购自日本Nikon公司,凝胶成像仪购自美国Bio-rad公司。
1.2 方法
1.2.1HUVECs培养及分组
HUVECs在含有10%胎牛血清的完全培养基中贴壁培养,密度生长至90%时用0.25%胰蛋白酶进行消化传代。传代的HUVECs接种在不同规格的培养板,分为对照组、CTH组、E2组、二甲基亚砜(DMSO)组、DMSO+CTH组、DMSO+E2组、P79350+E2组,处理方法如下:对照组用不含药物的培养基处理60 min;CTH组用含有200 μg/mL CTH的培养基处理60 min;E2组先给予含有0.1 mmol/L E2的培养基预处理60 min,而后用含有200 μg/mL CTH的培养基处理60 min;DMSO组用含有0.1% DMSO的培养基连续处理2 h;DMSO+CTH组用含有0.1% DMSO的培养基预处理60 min,而后用含有200 μg/mL CTH的培养基处理60 min;DMSO+E2组用含有0.1% DMSO和0.1 mmol/L E2的培养基预处理60 min,而后用含有200 μg/mL CTH的培养基处理60 min;P79350+E2组用含有50 μmol/L P79350和0.1 mmol/L E2的培养基预处理60 min,而后用含有200 μg/mL CTH的培养基处理60 min。所有分组均重复5次。
1.2.2细胞活力的检测
HUVECs接种在96孔培养板中,CTH处理后15、30、45、60 min时,采用MTS法进行细胞活力检测,在每个培养孔内加入20 μL检测液并继续培养4 h,而后在酶标仪上检测490 nm波长的吸光度(A490)值。
1.2.3培养基中炎症反应和氧化应激反应指标的检测
HUVECs接种在12孔培养板中,CTH处理后60 min分别收集培养基和细胞,采用南京建成生物工程研究所的ELISA试剂盒检测培养基中IL-1β、IL-6、TNF-α、MDA、SOD水平,采用BCA法检测细胞中的蛋白水平,计算每毫克细胞蛋白中IL-1β、IL-6、TNF-α、MDA、SOD水平。
1.2.4细胞凋亡率的检测
HUVECs接种在24孔培养板中,CTH处理后60 min收集细胞并用4%多聚甲醛固定,采用TUNEL法检测细胞凋亡,按照试剂盒说明书进行TUNEL染色和4’,6-二脒基-2-苯基吲哚(DAPI)染色,在显微镜下观察TUNEL阳性细胞及DAPI阳性细胞并计数,计算细胞凋亡率=TUNEL阳性细胞数/DAPI阳性细胞数×100%。
1.2.5细胞中蛋白表达水平的检测
HUVECs接种在12孔培养板中,CTH处理后60 min收集细胞并加入上海碧云天公司的裂解液提取细胞蛋白,与上样缓冲液混合、煮沸变性后进行Western blot检测,将样品加入聚丙烯酰胺凝胶中进行电泳、电转移至硝酸纤维素膜,5%脱脂牛奶封闭1 h后4 ℃孵育cleaved caspase-3、p38、p-p38、NF-κB、p-NF-κB及β-actin特异性一抗过夜,次日孵育辣根过氧化物酶二抗1 h并在凝胶成像仪中采用电化学发光(ECL)法显影得到蛋白条带,按照蛋白条带的灰度值计算cleaved caspase-3/β-actin、p-p38/p38、p-NF-κB/NF-κB水平。
1.3 统计学处理

2 结 果
2.1 E2对CTH诱导HUVECs活力降低的影响
CTH处理后15、30、45、60 min,CTH组的A490值均明显低于对照组(P<0.05),E2组的A490值均明显高于CTH组(P<0.05),见表1。
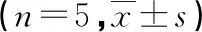
表1 3组HUVECs活力A490值比较
2.2 E2对CTH诱导HUVECs中炎症反应和氧化应激反应激活的影响
CTH处理后60 min,CTH组细胞培养基中IL-1β、IL-6、TNF-α、MDA水平均明显高于对照组,SOD水平明显低于对照组(P<0.05);E2组细胞培养基中IL-1β、IL-6、TNF-α、MDA水平均明显低于CTH组,SOD水平明显高于CTH组(P<0.05),见表2。
表2 3组HUVECs培养基中IL-1β、IL-6、TNF-α、MDA及SOD水平比较
2.3 E2对CTH诱导HUVECs中细胞凋亡激活的影响
CTH处理后60 min,CTH组的细胞凋亡率及细胞中cleaved caspase-3表达水平均明显高于对照组(P<0.05);E2组的细胞凋亡率及细胞中cleaved caspase-3表达水平均明显低于CTH组(P<0.05),见图1。
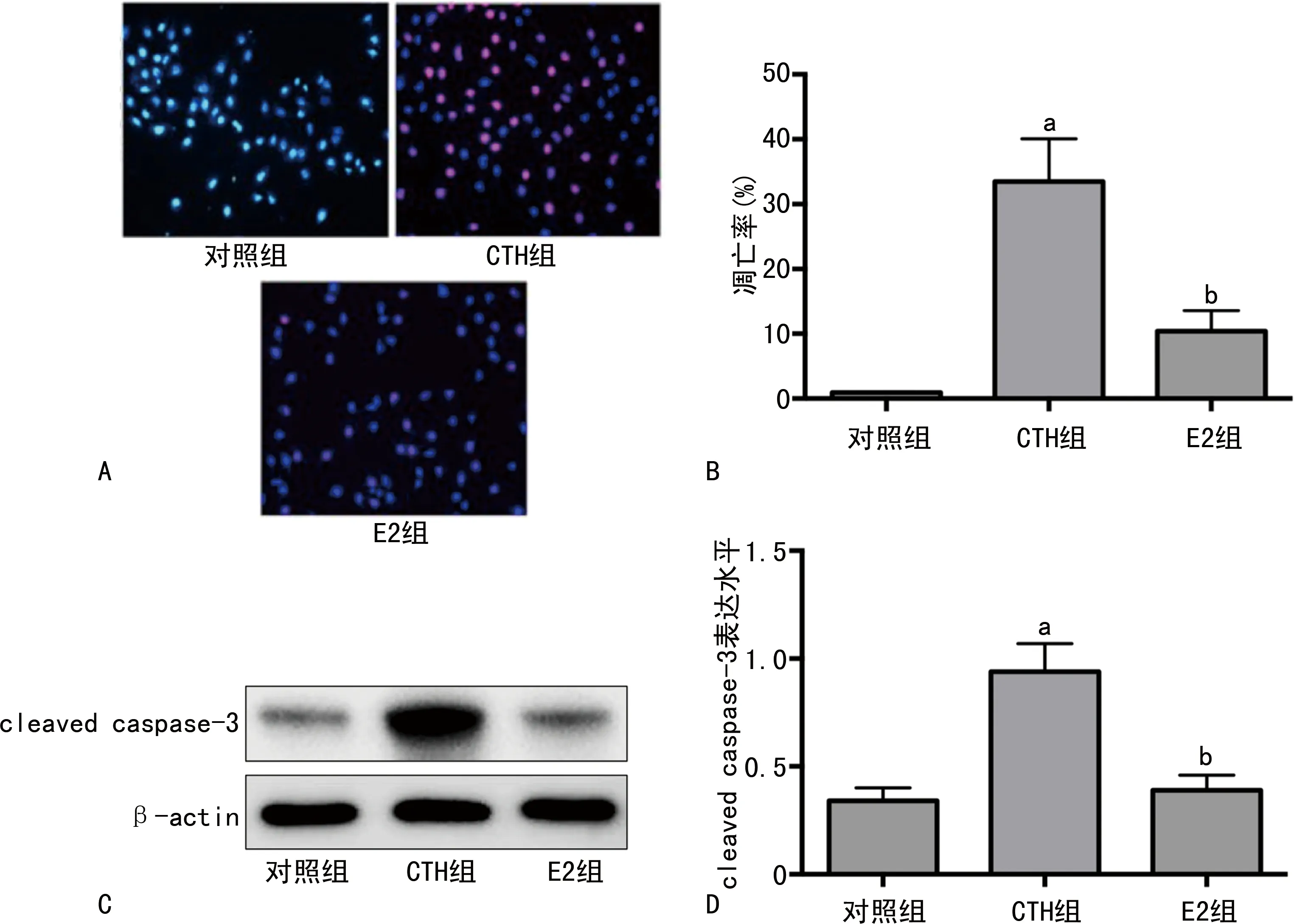
A:细胞凋亡的TUNEL染色;B:细胞凋亡率柱状图;C:cleaved caspase-3蛋白条带;D:cleaved caspase-3表达水平柱状图。a:P<0.05,与对照组比较;b:P<0.05,与CTH组比较。
2.4 E2对CTH诱导HUVECs中p38/NF-κB通路激活的影响
CTH处理后60 min,CTH组细胞中p-p38、p-NF-κB表达水平均明显高于对照组(P<0.05);E2组细胞中p-p38、p-NF-κB表达水平均明显低于CTH组(P<0.05),见图2。
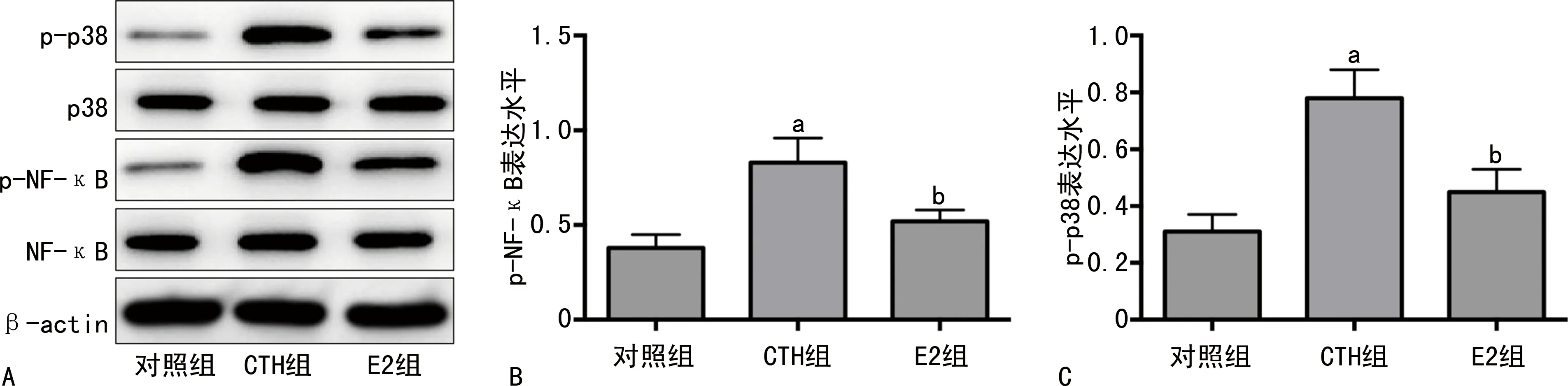
A:p38/NF-κB通路相关蛋白的蛋白条带;B:p-NF-κB表达水平柱状图;C:p-p38表达水平柱状图;a:P<0.05,与对照组比较;b:P<0.05,与CTH组比较。
2.5 p38激动剂对E2改善CTH诱导HUVECs中p38/NF-κB通路激活的影响
CTH处理后60 min,DMSO+CTH组细胞中p-p38、p-NF-κB表达水平均高于DMSO组(P<0.05);DMSO+E2组细胞中p-p38、p-NF-κB表达水平均明显低于DMSO+CTH组(P<0.05);P79350+E2组细胞中p-p38、p-NF-κB表达水平均明显高于DMSO+E2组(P<0.05),见图3。

A:p38/NF-κB通路相关蛋白的蛋白条带;B:p-p38表达水平柱状图;C:p-NF-κB表达水平柱状图;a:P<0.05,与DMSO组比较;b:P<0.05,与DMSO+CTH组比较;c:P<0.05,与DMSO+E2组比较。
2.6 p38激动剂对E2改善CTH诱导HUVECs活力降低的影响
CTH处理后15、30、45、60 min,DMSO+CTH组的A490值均明显低于DMSO组(P<0.05),DMSO+E2组的A490值均明显高于DMSO+CTH组(P<0.05),P79350+E2组的A490值均明显低于DMSO+E2组(P<0.05),见表3。
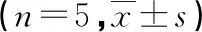
表3 4组HUVECs活力A490值比较
2.7 p38激动剂对E2改善CTH诱导HUVECs中炎症反应和氧化应激反应激活的影响
CTH处理后60 min,DMSO+CTH组细胞培养基中IL-1β、IL-6、TNF-α、MDA水平均明显高于DMSO组,SOD水平明显低于DMSO组(P<0.05);DMSO+E2组细胞培养基中IL-1β、IL-6、TNF-α、MDA水平均明显低于DMSO+CTH组,SOD水平明显高于DMSO+CTH组(P<0.05);P79350+E2组细胞培养基中IL-1β、IL-6、TNF-α、MDA水平均明显高于DMSO+E2组,SOD水平明显低于DMSO+E2组(P<0.05),见表4。
表4 4组HUVECs培养基中IL-1β、IL-6、TNF-α、MDA及SOD水平比较
2.8 p38激动剂对E2改善CTH诱导HUVECs中细胞凋亡激活的影响
CTH处理后60 min,DMSO+CTH组的细胞凋亡率及细胞中cleaved caspase-3表达水平均明显高于DMSO组(P<0.05);DMSO+E2组的细胞凋亡率及细胞中cleaved caspase-3表达水平均明显低于DMSO+CTH组(P<0.05);P79350+E2组的细胞凋亡率及细胞中cleaved caspase-3表达水平均明显高于DMSO+E2组(P<0.05),见图4。
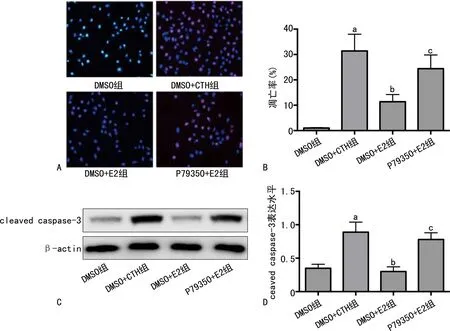
A:细胞凋亡的TUNEL染色;B:细胞凋亡率柱状图;C:ceaved caspase-3的蛋白条带;D:cleaved caspase-3表达水平柱状图;a:P<0.05,与DMSO组比较;b:P<0.05,与DMSO+CTH组比较;c:P<0.05,与DMSO+E2组比较。
3 讨 论
组蛋白是一种在细胞核内与DNA互相结合形成核小体的核蛋白,在不同病理因素刺激下组蛋白异常释放进入细胞外并产生细胞毒性。近些年,多项脓毒症相关的研究证实细胞外组蛋白的产生与疾病病情及预后相关[3-4],但相关的分子机制及防治手段尚不清楚。在脓毒症发生、发展的过程中,血管内皮细胞损伤与病情加重及全身多个脏器功能损伤有关,细胞外组蛋白的细胞毒性作用可能是脓毒症病程中引起内皮损伤的关键因素[11]。有多项细胞研究通过大剂量组蛋白短时间冲击处理,即200 μg/mL CTH处理1 h的方式诱导血管内皮细胞发生损伤[6,12]。
本研究采用0.1 mmol/L E2预处理HUVECs,200 μg/mL CTH处理15、30、45、60 min后细胞的A490值明显降低,与既往研究中CTH诱导内皮细胞损伤的实验结果吻合[6,12]。脓毒症发病过程中炎症反应、氧化应激反应及细胞凋亡的过度激活是与多器官功能障碍、内皮细胞损伤直接相关的因素[13-14]。本研究在CTH诱导HUVECs损伤模型中检测到培养基中炎症因子IL-1β、IL-6、TNF-α及氧化应激产物MDA水平均升高,抗氧化酶SOD水平降低,同时细胞凋亡率及细胞中凋亡基因cleaved caspase-3表达水平升高,与脓毒症发病过程中炎症反应、氧化应激反应及细胞凋亡激活的特点吻合[13-14]。以此为基础,本研究将继续在CTH诱导HUVECs损伤模型中以炎症反应、氧化应激反应及细胞凋亡为切入点研究相关的分子机制及防治手段。
E2是具有心血管保护作用的性激素,在多种病理因素引起内皮细胞损伤的模型中发挥保护作用,对内皮细胞在病理状态下的炎症反应、氧化应激反应及细胞凋亡均具有抑制作用[15-16]。本研究在CTH诱导HUVECs损伤前进行E2预处理,E2预处理后给予CTH 15、30、45、60 min时细胞的A490值均明显增加,表明E2对CTH诱导HUVECs损伤具有改善作用。进一步分析炎症反应、氧化应激反应及细胞凋亡可知:E2预处理后CTH诱导HUVECs损伤模型中IL-1β、IL-6、TNF-α、MDA的生成,凋亡率及cleaved caspase-3表达水平均降低,SOD水平升高,表明E2在改善CTH诱导HUVECs损伤时发挥了抗炎、抗氧化、抗凋亡的作用,与既往研究中有关E2生物学特性的报道一致[15-16],也与本研究已经观察到E2减轻CTH诱导HUVECs损伤的作用吻合。
根据国内曹清等[6]研究中细胞实验结果,CTH诱导HUVECs损伤与激活NF-κB和p38通路有关。p38属于丝裂原活化蛋白激酶(MAPK)家族,发生磷酸化后生成有活性的p-p38,后者能够引起下游NF-κB发生磷酸化并参与炎症反应、氧化应激反应及细胞凋亡的调控[17]。已有多项研究证实,E2的心脑血管保护作用与抑制p38及NF-κB的磷酸化有关[9-10,18],本研究在CTH诱导HUVECs损伤的模型中检测到p-p38及p-NF-κB的表达水平增加,符合NF-κB和p38激活的特点;E2预处理后,p-p38及p-NF-κB的表达水平降低,表明E2在CTH诱导HUVECs损伤模型中抑制NF-κB和p38的激活。进一步通过使用p38激动剂P79350与E2联合预处理的方式验证p38/NF-κB通路在E2减轻CTH诱导HUVECs损伤中的作用,加用p38激动剂后,E2预处理减轻细胞损伤、炎症反应、氧化应激反应及细胞凋亡的作用被削弱,表明E2改善CTH诱导HUVECs损伤的作用部分与抑制p38/NF-κB通路有关。
综上所述,本研究通过一系列细胞实验证实E2具有改善CTH诱导内皮细胞损伤的作用,这一改善作用与抑制p38/NF-κB通路介导的炎症反应、氧化应激及细胞凋亡有关。以上结果为今后深入认识细胞外组蛋白诱导内皮细胞损伤的分子机制及防治手段提供了依据,E2可能作为细胞外组蛋白诱导内皮细胞损伤的防治药物,p38/NF-κB通路则有望成为研究细胞外组蛋白诱导内皮细胞损伤分子机制的靶点。
