茯苓多糖通过NF-κB通路减轻心肌梗死大鼠组织损伤*
2022-10-24赵明君马淑慧胡子恒
王 琼,赵明君,董 静,赵 运,陈 凯,马淑慧,胡子恒△
(1.陕西中医药大学第二附属医院心内科,陕西咸阳 712000;2.陕西中医药大学附属医院心内科,陕西咸阳 712000)
近几十年来,心肌梗死(myocardial infarction,MI)仍然是全球主要的死亡原因之一,其发病率和病死率高居不下[1]。MI缺血会导致心肌细胞、内皮细胞和巨噬细胞等发生细胞凋亡[2]。若能在MI发生前或发生时改善缺血心肌内皮细胞存活,可减轻心脏组织损伤,有利于心脏损伤组织与血管的重建修复[3],从而降低病重率与病死率。
炎症与氧化应激失衡在MI过程中起着核心作用,缺血时心肌细胞活性氧及其代谢产物增多,出现氧化应激失衡,从而诱导炎症反应发生[4]。核因子-κB(NF-κB)通路作为经典炎症通路,与氧化应激失衡密切相关[5],是研究与开发MI治疗药物的重要突破口。茯苓为常用中药之一,具有药食同源的特性。研究发现,茯苓的有效药用成分以多糖为主,具有调节机体免疫、抗肿瘤、抗炎、抗氧化等药理作用[6-7]。目前尚缺少茯苓在MI相关疾病中作用的研究报道,因此,本研究主要从茯苓多糖的抗氧化与抗炎作用探讨其是否能减轻MI导致的组织损伤,为临床用药提供实验基础,现报道如下。
1 材料与方法
1.1 材料
1.1.1实验动物
雄性SD大鼠40只,无特殊病原体(SPF)级,体重210~230 g,购自成都达硕实验动物有限公司,生产许可证号:SCXK(川)2020-030。
1.1.2仪器与试剂
茯苓多糖(纯度≥98%)购自成都埃法生物科技有限公司;异丙肾上腺素(isoproternol,ISO)购自上海禾丰制药有限公司;白细胞介素(IL)-1β、IL-6、IL-10、肿瘤坏死因子-α(TNF-α)ELISA试剂盒、TUNEL细胞凋亡检测试剂盒均购自北京索莱宝科技有限公司;细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司;磷酸化NF-κB抑制蛋白α(p-IκB-α)、IκB激酶β(IκK-β)、p-P65 NF-κB和β-actin均购自美国Cell Signaling Technology公司。CytationTMC10全自动酶标仪购自美国BioTek公司,XSP-8CA显微镜购自上海光学仪器厂,蛋白质电泳仪、多功能凝胶成像仪购自美国Bio-Rad公司。
1.2 方法
1.2.1实验分组、给药与造模[8]
将40只大鼠分为空白组、模型组、茯苓多糖高剂量组、茯苓多糖低剂量组,每组10只。适应性喂养1周后进行给药处理:空白组与模型组给予生理盐水,茯苓多糖高、低剂量组分别灌胃茯苓多糖水溶液(200、100 mg/kg),持续7 d。于第6、7天给药1 h后造模,除空白组外,其余各组大鼠背部皮下多点注射ISO(85 mg/kg),以心电图S-T段升高作为造模成功的标志。
1.2.2氯化三苯四氮唑(TTC)染色观察大鼠MI面积
第7天造模后30 min,进行TTC染色操作:右颈总动脉注射1%依文思蓝溶液2 mL,待观察到大鼠口唇变蓝时快速取出心肌组织,预冷生理盐水清理表面血液与多余的染液,在-20 ℃下冷冻20 min,取出后沿平行房室沟方向进行切片,厚度约2 mm,将薄片在1% TTC溶液中室温染色20 min,再使用10%甲醛固定24 h,拍照并分析各组大鼠心肌组织坏死区域。
1.2.3苏木素-伊红(HE)染色观察大鼠心肌组织病理学变化
收集各组大鼠心肌组织,4%多聚甲醛固定过夜,制备石蜡切片后使用HE染色,观察大鼠心肌组织病理学变化情况。
1.2.4荧光TUNEL染色观察大鼠心肌组织中细胞凋亡情况
收集各组大鼠心肌组织,放入4%多聚甲醛中固定过夜,制备石蜡切片。使用TUNEL荧光试剂盒染色,观察心肌组织中细胞凋亡情况。
1.2.5分光光度计法检测大鼠血清氧化应激指标超氧化物歧化酶(SOD)活性与丙二醛(MDA)水平
收集各组大鼠腹主动脉血,4 000 r/min离心10 min,按分光光度计检测试剂盒说明书检测血清SOD活性、MDA水平。
1.2.6ELISA检测大鼠血清炎症因子水平
收集各组大鼠腹主动脉血,4 000 r/min离心10 min,按ELISA试剂盒说明书检测血清IL-1β、IL-6、IL-10、TNF-α水平。
1.2.7Western blot检测大鼠心肌组织p-IκB-α、IκK-β及p-P65 NF-κB表达水平
取各组大鼠心肌组织约50 mg,加入组织裂解液制成组织匀浆,12 000 r/min离心10 min,收集上清液,使用BCA试剂盒进行蛋白定量。加入4×上样缓冲液在97 ℃下金属浴加热10 min,按30 μg蛋白上样量进行凝胶、转膜,5%脱脂牛奶室温封闭2 h,4 ℃过夜孵育一抗,稀释倍数为IκB-α(1∶1 000)、IκK-β(1∶1 000)、P65 NF-κB(1∶1 000)、β-actin(1∶1 200),TBST漂洗3遍后室温孵育二抗2 h,TBST漂洗3遍后进行电化学发光(ECL)试剂盒显影,在凝胶成像系统中对条带进行曝光分析拍照,以β-actin作为蛋白内参计算蛋白相对表达水平。
1.3 统计学处理
2 结 果
2.1 茯苓多糖对MI大鼠心肌组织梗死面积的影响
TTC染色结果显示,空白组、模型组、茯苓多糖高剂量组、茯苓多糖低剂量组大鼠MI面积比例分别为0、(14.00±1.47)%、(3.56±1.43)%、(9.32±1.46)%,差异有统计学意义(F=72.39,P<0.05)。与空白组相比,模型组大鼠MI面积比例增大,差异有统计学意义(P<0.01);与模型组相比,茯苓多糖高、低剂量组大鼠MI面积比例均降低,差异有统计学意义(P<0.01),见图1。

图1 各组大鼠MI面积比例观察(TTC染色)
2.2 茯苓多糖对MI大鼠心肌组织的病理学改变
空白组大鼠心外膜结构完整清晰,中膜层心肌纤维呈螺旋状排列,多集合成束,肌束间有较多结缔组织和丰富的血管;心肌纤维形态正常,细胞质染色均匀,结构清晰;间质内无炎症细胞浸润及纤维结缔组织增生;心内膜内皮细胞完好。模型组大鼠心肌层内大量心肌纤维组织呈片状变性坏死,伴炎症细胞浸润,见心肌纤维形态结构模糊,染色变浅,坏死细胞的细胞核深染,不规则,细胞质溶解甚至消失,坏死区域内可见淋巴细胞或中性粒细胞聚集。茯苓多糖高剂量组大鼠心肌纤维排列较为整齐,形态较为正常,染色较为均匀,局部区域可见少量心肌纤维变性坏死,形态结构模糊。茯苓多糖低剂量组大鼠局部心肌层内心肌纤维灶状坏死较为明显,坏死心肌细胞的细胞核深染、固缩,细胞质溶解甚至基本消失。见图2。
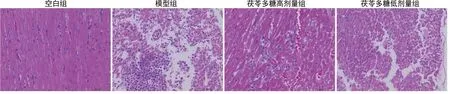
图2 各组大鼠心肌组织病理学观察情况(HE染色,400×)
2.3 茯苓多糖对MI大鼠心肌中细胞凋亡的影响
空白组、模型组、茯苓多糖高剂量组、茯苓多糖低剂量组大鼠心肌组织中细胞凋亡率分别为0、(35.69±5.62)%、(6.92±2.43)%、(16.37±4.13)%,差异有统计学意义(F=52.75,P<0.05)。与空白组相比,模型组大鼠心肌组织中细胞凋亡率升高,差异有统计学意义(P<0.01);与模型组相比,茯苓多糖高、低剂量组大鼠心肌组织中细胞凋亡率均降低,差异有统计学意义(P<0.01),见图3。
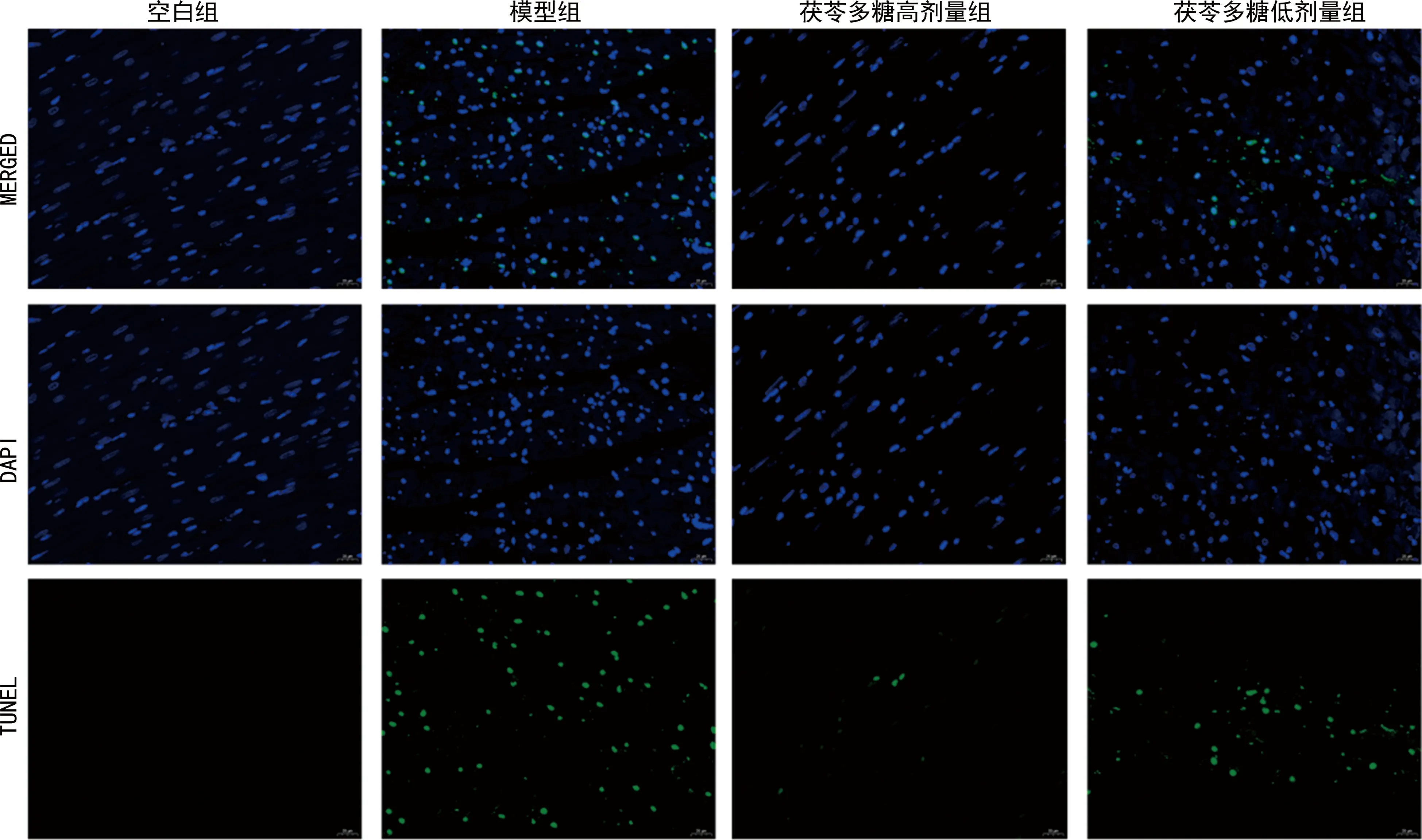
图3 各组大鼠心肌组织中细胞凋亡情况(TUNEL荧光染色,400×)
2.4 茯苓多糖对MI大鼠血清氧化应激指标的影响
与空白组相比,模型组大鼠血清SOD活性降低,MDA水平升高,差异均有统计学意义(P<0.01);与模型组相比,茯苓多糖高剂量组大鼠血清SOD活性升高(P=0.02 8),MDA水平降低(P=0.03 0),差异均有统计学意义,低剂量组指标变化与高剂量组一致,但差异均无统计学意义(P>0.05),见表1。
表1 各组大鼠血清SOD活性与MDA水平比较
2.5 茯苓多糖对MI大鼠血清炎症因子水平的影响
与空白组相比,模型组大鼠血清IL-1β、IL-6、TNF-α水平升高,IL-10水平降低,差异均有统计学意义(P<0.01);与模型组相比,茯苓多糖高剂量组大鼠血清IL-1β、IL-6、TNF-α水平降低,IL-10水平升高,差异均有统计学意义(P=0.034、0.024、0.034、0.019),低剂量组指标变化与高剂量组一致,但差异均无统计学意义(P>0.05),见表2。
表2 各组大鼠血清炎症因子水平比较
2.6 茯苓多糖对MI大鼠心肌组织中IκK-β/IκB-α/NF-κB通路的影响
与空白组相比,模型组大鼠心肌组织中p-IκB-α、IκK-β及p-P65 NF-κB相对表达水平均升高,差异有统计学意义(P<0.01);与模型组相比,茯苓多糖高、低剂量组大鼠心肌组织中p-IκB-α、IκK-β、p-P65 NF-κB相对表达水平均降低,差异有统计学意义(P<0.01),见表3、图4。
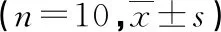
表3 各组大鼠心肌组织中p-IκB-α、IκK-β及p-P65 NF-κB相对表达水平比较

续表3 各组大鼠心肌组织中p-IκB-α、IκK-β及p-P65 NF-κB相对表达水平比较

1:空白组;2:模型组;3:茯苓多糖高剂量组;4:茯苓多糖低剂量组。
3 讨 论
MI是指流向心脏的血液减少或停止,从而引起的心肌细胞缺氧或坏死,最终导致心肌损伤的一种损伤类型。心肌细胞凋亡主要发生在梗死组织周围区域。有研究发现,在MI小鼠中,心脏组织再生能力与速度有限,抑制心肌细胞凋亡可改善心脏功能并减少心肌组织梗死面积[9]。目前抗心肌细胞凋亡的治疗手段还处于探索阶段,其中新兴的细胞疗法对改善MI似乎没有明显的临床效益[10]。中药多糖普遍具有毒性小、作用靶点多的优点,而茯苓多糖的抗炎、抗氧化作用突出,具有减少细胞凋亡的潜力。在本实验中,经过茯苓多糖预处理的大鼠在发生MI后,因心肌组织缺氧导致的坏死面积有效减少,心肌细胞凋亡减少,保全了组织功能,表明茯苓多糖对MI大鼠有保护作用。
造成机体氧化应激失衡的原因很多,活性氧(ROS)过度分泌为其中一种。蛋白质作为细胞膜的主要成分,是最先受到ROS损伤的分子之一,高水平的ROS最终导致细胞因脂质过氧化而坏死。有研究发现,在ISO所致大鼠急性MI模型中检测到氧化应激失衡情况[11]。氧化应激失衡过程中,内源性抗氧化剂如SOD活性明显降低,堆积的脂质过氧化物导致MDA水平增加,从而促进氧自由基的产生,抑制内源性抗氧化状态[12]。在本研究中,茯苓多糖预处理后增强了大鼠心肌组织的抗氧化能力,使机体在面对MI时未出现严重的氧化应激失衡,通过增强SOD活性与降低MDA水平抑制了心肌细胞凋亡与组织坏死。
炎症反应也是MI造成心肌损伤的主要原因之一。MI后心肌组织中的炎症因子和趋化因子水平迅速升高,进一步加剧炎症反应、MI、心室重塑等导致的心功能障碍[13]。有证据表明体内注射ISO后,在MI区域发现了多种细胞因子,说明ISO能诱导分泌大量趋化因子和炎症因子造成MI[14]。IL-1β、IL-6和TNF-α这些因子都已被证明是造成心肌细胞凋亡、心肌组织损伤的因素。而IL-10被视为炎症抑制因子[11],其水平高低对MI后炎症反应的测定具有重要意义。在本研究中,茯苓多糖预处理能有效降低MI大鼠血清IL-1β、IL-6和TNF-α水平,提高IL-10水平,说明茯苓多糖针对MI引起的炎症有抑制效果,同时也暗示着茯苓多糖减轻MI大鼠损伤的机制可能与炎症通路有关。
NF-κB是一种可诱导的细胞质转录因子,在细胞质磷酸化后转移到细胞核,然后与许多基因的启动子区域结合,激活如IL-1β、IL-6和TNF-α等炎症调控基因,并增加其下游蛋白的表达[15]。IκK-β是IκB-α上游调控蛋白,当出现氧化应激或炎症刺激后,IκB-α被IκK-β激活,出现磷酸化与泛素化降解,使NF-κB从复合体中分离并激活,然后转移到细胞核中参与特定基因的表达,进一步引发下游炎症因子的释放[16]。因此,抑制NF-κB通路有利于减少MI导致的炎症反应。在本研究中,茯苓多糖的预处理通过减少组织中IκK-β的表达,避免了IκB-α的磷酸化激活,使P65 NF-κB磷酸化减少,活性降低,从而减少下游基因的进一步表达,缓解了心肌组织因MI导致的损伤,与WU等[17]对茯苓多糖基于NF-κB抗炎的研究结果基本一致。
综上所述,本研究基于IκK-β/IκB-α/NF-κB通路分析茯苓多糖预处理对ISO所致MI大鼠的保护作用,发现茯苓多糖可有效保护心肌组织因MI诱导的氧化应激失衡与炎症反应,减少心肌坏死面积与细胞凋亡数量,其作用可能与抑制IκK-β/IκB-α/NF-κB通路有关。
