新生儿早发型败血症血液检查指标与预后的相关性研究
2022-10-24彭海波詹媛丽黄宜娥林小峰
彭海波,詹媛丽,黄宜娥,张 敏,杨 婷,林小峰,陈 幽△
深圳市宝安区妇幼保健院:1.新生儿科;2.医院感染管理科,广东深圳 518106
早发型败血症(EOS)是指新生儿生后72 h内发生的全身性细菌感染,是导致新生儿早期死亡的主要原因之一[1]。不同地区报道的EOS发病率存在差异,美国的发病率为0.108%,病死率为16.2%[2]。我国尚无EOS发病率及病死率的大样本量多中心研究,多项单中心研究结果显示EOS的病死率为7.4%~19.6%[3-5]。由于EOS具有较高的病死率,尽早识别高风险患者对降低病死率具有重要意义。有研究表明,EOS患者死亡的独立危险因素是出生体重<1 500 g和大肠埃希菌感染[6]。BERARDI等[7]发现小胎龄、急诊剖宫产及血小板计数(PLT)<150×109/L是EOS死亡或神经系统损害的危险因素。临床用于EOS诊断的血液检查指标包括白细胞计数(WBC)、中性粒细胞绝对计数(ANC)、PLT、C反应蛋白(CRP)等。而上述指标能否用于EOS预后判断,目前尚无统一意见。为探讨上述血液检查指标与EOS患者短期预后的相关性,本研究对本院新生儿科2011~2020年收治的89例确诊为EOS的患儿临床资料、血液检查结果进行了回顾性分析,旨在为临床治疗及预后判断提供参考依据。
1 资料与方法
1.1一般资料 将2011年1月1日至2020年12月31日广东省深圳市宝安区妇幼保健院新生儿科收治的确定诊断EOS的新生儿共89例纳入研究。纳入标准:符合EOS的确诊标准,即3日龄内出现中毒症状临床表现,且血培养或脑脊液、其他无菌腔液培养阳性的新生儿[8]。排除标准:(1)单份血培养或脑脊液培养结果为条件致病菌或污染菌;(2)非疾病本身因素放弃治疗者;(3)存在先天发育畸形、遗传代谢性疾病或免疫缺陷性疾病者;(4)检验结果缺失者。将纳入研究的患儿根据临床转归分为治愈/好转组(80例)和死亡组(9例),转归观察终点为患者死亡或出院。好转指经治疗后病情稳定,但因其他原因办理自动出院,未完成败血症治疗疗程。
1.2方法 本研究为回顾性研究,通过查询病历系统,收集并记录以下信息。(1)一般情况:胎龄、出生体重、性别、分娩方式、合并症、预后;(2)血液检查指标:血液非特异性指标(包括WBC、ANC、PLT、CRP)、血液培养结果及血培养阳性报警时间。由于降钙素原及外周血涂片在2017年前未常规检查,故本研究未纳入降钙素原及不成熟中性粒细胞/总中性粒细胞比值两项指标。根据距离发病的时间,将血液检查结果进行分段和汇总分析:起病后0~<12 h、起病后12~36 h及发病后7 d内。

2 结 果
2.1病原菌分布情况 纳入本研究的89例患儿中,病原菌为革兰阳性菌的有53例(59.55%),为革兰阴性菌的有36例(40.45%),真菌0例。革兰阳性菌感染包括B族链球菌(GBS)感染39例(43.82%)、凝固酶阴性葡萄球菌感染6例(6.74%)、李斯特菌感染3例(3.37%)、屎肠球菌感染2例(2.25%)、缓症链球菌感染1例(1.12%)、草绿色链球菌感染1例(1.12%)、粪肠球菌感染1例(1.12%);革兰阴性菌感染包括大肠埃希菌感染29例(32.58%)、肺炎克雷伯杆菌感染3例(3.37%)、黏质沙雷菌感染3例(3.37%)和溶血不动杆菌感染1例(1.12%)。
2.2两组患儿一般情况比较 死亡组患儿12 h内死亡4例,2 d死亡3例,3 d死亡1例,5 d死亡1例,与治愈/好转组比较,死亡组患儿胎龄更小、出生体重更低(P<0.05)。男性比例、阴道分娩比例、早产比例两组间比较差异无统计学意义(P>0.05)。
2.3血液检查指标与预后的关系 死亡组WBC<5×109/L比例(发病12 h内、12~36 h、7 d内)、PLT<100×109/L比例(12~36 h、7 d内)高于治愈/好转组(P<0.05)。与治愈/好转组相比,死亡组发病12 h内、12~36 h WBC及ANC更低(P<0.05),发病12~36 h PLT更低、CRP更高,7 d内最低WBC、最低PLT更低(P<0.05)。见表2~4。

表1 两组间一般情况比较

表2 两组12 h内血液检查指标比较[n(%),M(P25,P75)]
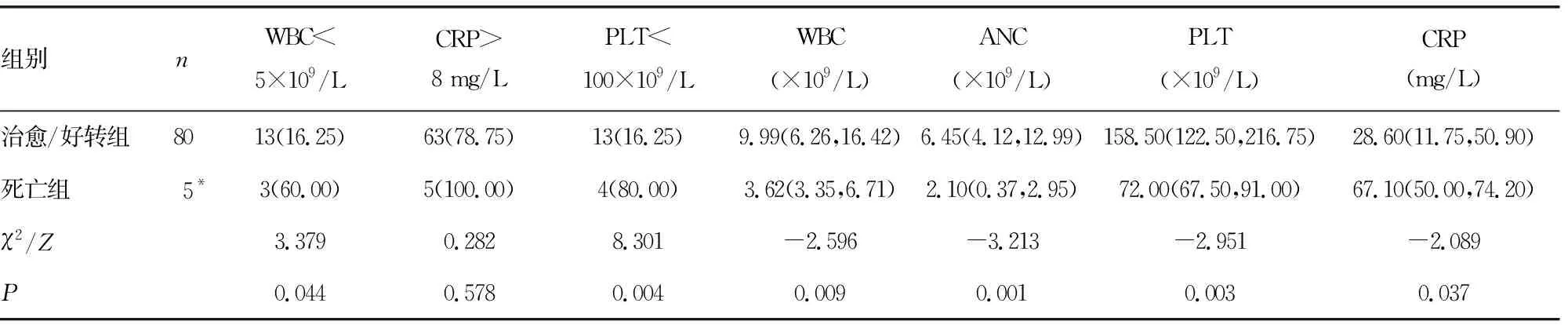
表3 两组12~ 36 h血液检查指标比较[n(%),M(P25,P75)]
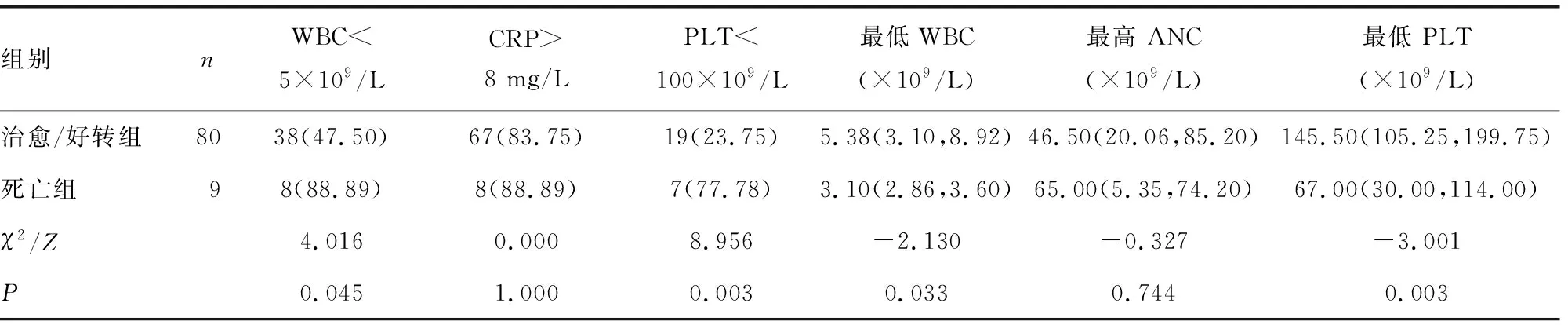
表4 两组7 d内血液检查指标比较[n(%),M(P25,P75)]
2.4血培养情况与预后的关系 死亡组病原菌包括大肠埃希菌5例及GBS 4例,GBS及大肠埃希菌占比与治愈/好转组比较,差异均无统计学意义(P>0.05)。死亡组血培养阳性报警时间明显短于治愈/好转组(P<0.05),见表5。

表5 两组血培养结果比较
3 讨 论
EOS是导致新生儿早期死亡的常见原因之一,虽然EOS发病率低,但其病死率高,需要通过积极防治提高EOS新生儿救治成功率。EOS症状常常不典型,结合血液检查指标辅助判断预后,有助于提高临床的警惕性,降低EOS患者病死率。
新生儿败血症诊断常用的非特异性指标包括WBC、不成熟中性粒细胞/总中性粒细胞比值、CRP、降钙素原等。虽然非特异性指标已广泛应用于EOS的诊断中,但其与EOS预后的相关性尚无定论。本研究发现,死亡组患者发病后12 h内WBC<5×109/L的比例近80%,是治愈/好转组的2.2倍,提示发病早期WBC减少可能与疾病的严重程度相关,与FUNKE等[9]的报道结果一致。通常情况下,当宿主受到细菌感染时,骨髓粒细胞贮备池释放粒细胞入血以抵抗感染,外周血WBC增高。但部分病例血WBC及ANC减少,原因与感染后骨髓粒细胞贮备池耗竭、粒细胞生成不足,宿主抵抗细菌侵袭能力下降所致,与仅表现为WBC增高的病例相比,具有更高的病死率[10]。但新生儿WBC也受到母亲合并症如高血压或子痫[11]、免疫系统疾病、药物等因素的影响,临床中应注意鉴别。CRP是重要的炎症指标,在感染后6~8 h升高,24 h达到顶峰。本研究中发病12 h内死亡和治愈/好转组间CRP水平无明显差异,但12~36 h复查CRP结果显示死亡组患儿CRP水平明显高于治愈/好转组。该结果与CRP在患者感染后升高的规律一致,也反映了病情严重的患者炎症反应更重,CRP上升速度更快。
虽然PLT并未纳入非特异性诊断指标,但PLT减少有助于判断EOS患者预后[8]。本研究中,EOS死亡组发病后12~36 h PLT<100×109/L的比例高于治愈/好转组,而发病后7 d内PLT<100×109/L的比例是治愈/好转组的3.3倍,最低PLT值也低于治愈/好转组。PLT通常在败血症发生后24~48 h下降至最低值[12],PLT<150×109/L发生率约为50%,PLT减少的EOS患者病死率是PLT正常者的4倍[13],与本文结果类似。但也有学者提出,新生儿败血症的病死率与PLT减少程度无相关性,而与输注PLT次数相关,持续难以纠正的PLT减少可能与新生儿败血症死亡相关[14]。败血症导致PLT减少的机制主要包括PLT生成和消耗两方面,新生儿发生败血症时PLT生成速度增快(PLT生成素浓度以及网织PLT比例增高),但感染引发的弥漫性血管内凝血、细菌毒素对PLT的破坏等导致PLT的消耗速度大于其生成速度,从而发生PLT减少[15],严重感染者PLT减少发生率更高[16]。
本研究结果显示,EOS最常见的病原菌为GBS和大肠埃希菌,与部分发达国家或地区的报道一致[17-19]。本研究死亡病例的病原菌均为GBS或大肠埃希菌,约80%死亡病例是在发病3 d内死亡。对血液培养阳性报警时间的比较发现,死亡组血液培养阳性报警时间较治愈/好转组短,可能与细菌种类及送检标本的细菌初始浓度有关。研究表明,细菌浓度与临床严重程度及预后密切相关[20]。临床上,对于培养阳性报警时间短及病原菌为大肠埃希菌的患者,需高度警惕其病情恶化乃至死亡的可能。本院2011-2020年总分娩量超过12万例,但所收集到的EOS病例数仅89例,反映了真实世界EOS研究的难度。本研究结果提示血液检查结果对预后的评估有一定参考价值,但仍存在一定的局限性。第一,本研究是回顾性研究,临床数据为回顾性收集,并未进行前瞻性设计,部分患者无法在相应时间段采集标本进行检验,导致存在数据的缺失。第二,由于诊疗手段的进步,近几年败血症的救治成功率较前增高,可能对研究结果产生影响。第三,本研究仅为单中心研究,样本量小,尚需通过多中心研究扩大样本量,提高结果的可靠性。
综上所述,疑似EOS的患者,尤其是胎龄小、出生体重低的早产儿,若血液检查出现WBC减少、PLT减少、CRP持续增高、血培养短时间内报告阳性时,应高度警惕患者的不良临床转归,及时采取更高级别的支持措施来进行救治,避免患者死亡。
