LASS2通过AMPKα/mTORC1信号通路诱导HepG2肝癌细胞自噬和凋亡*
2022-10-24向加林杨小理
黎 兵,何 维,向加林,杨 艳,杨小理△
1.遵义医科大学附属医院医学检验科,贵州遵义 563000;2.遵义医科大学检验医学院,贵州遵义 563000
原发性肝癌是全球最常见的恶性肿瘤之一,每年新确诊的肝癌病例数位居恶性肿瘤第6位[1]。在我国,肝癌患者的5年生存率仅为14.1%[1],是仅次于胰腺癌的第2大致死癌症。尽管近年来肝癌的治疗取得了很大进展,但其治疗的选择和临床结局仍很有限。由于肝癌在遗传、代谢、分子机制及临床症状方面存在极大的异质性,使得其早期诊断和癌基因靶向治疗的设计极具挑战性。一些研究试图阐明肝癌细胞产生和存活的潜在机制,因为这些研究可以为肝癌的治疗提供新的干预措施或靶点。细胞生存和死亡之间的平衡对体内稳态至关重要,其中自噬起重要作用[2]。自噬是一个高度保守的分解代谢过程,它可以循环利用胞内成分来保护细胞,同时也可以在一定条件下杀死细胞[3]。研究表明,自噬在肝癌的发生和进展中可能发挥双刃剑的作用,靶向自噬或与其他化疗药物联合阻断自噬可能是治疗肝癌的潜在策略[4]。
LAG1长寿保证基因2(LASS2),又被称为肿瘤转移抑制基因1(TMSG-1)、神经酰胺合酶2(CERS2),在肝癌[5]、乳腺癌[6]、膀胱癌[7]等恶性肿瘤的浸润和生长发挥抑癌作用。LASS2能通过促进神经酰胺的合成诱导肺上皮细胞保护性自噬[8]。本课题组前期研究发现LASS2过表达增加了HepG2胞内活性氧(ROS)[9],最新的研究表明ROS可作为第二信使直接参与细胞存活的调节,并能诱导自噬的发生[10]。然而LASS2过表达是否激活HepG2肝癌细胞的自噬并影响其存活,目前未见相关报道。本研究以HepG2肝癌细胞株为研究模型,检测LASS2过表达对HepG2细胞自噬、凋亡的影响及探讨其可能的信号通路。
1 材料与方法
1.1实验材料与仪器 HepG2购自中科院上海细胞库;Adv-GFP、Adv-LASS2-GFP重组腺病毒由北京百奥川生物科技有限责任公司合成;DMEM培养基、胎牛血清(FBS)购自Gibco公司;单磷酸腺苷活化蛋白激酶(AMPK)α、p-AMPKα、Raptor、p-Raptor、Beclin-1、LC3A/B一抗购自CST公司;GAPDH、SQSTM1、BCL2、Bax一抗购自华安生物技术有限公司;Trizol(总RNA抽取试剂盒)、实时荧光定量反转录PCR(qRT-PCR)试剂购自TAKARA宝日医生物技术有限公司;全蛋白提取试剂盒购自凯基生物技术有限公司;BCA蛋白定量试剂盒购自上海雅酶生物科技公司;LASS2抗体购自Abcam公司;Annexin Ⅴ-APC/7AAD凋亡检测试剂盒购自江苏凯基生物技术股份有限公司;FACSA Ⅱ流式细胞仪(FACS Calibur型,BD公司);Chemi-DocTM凝胶成像系统购自Bio-Rad公司。
1.2实验方法
1.2.1细胞培养与转染 HepG2肝癌细胞采用含10%FBS的DMEM培养基、置于37 ℃、5%CO2培养箱中培养。将HepG2细胞分为3组:空白对照组(n=3)、空载组(n=3,重组腺病毒Adv-GFP感染细胞)和实验组(n=3,重组腺病毒Adv-LASS2-GFP感染细胞),转染48 h后根据各实验目的进行收集样品。所有实验重复3次。
1.2.2qRT-PCR检测LASS2 mRNA表达情况 感染48 h后,提取各组细胞总RNA,测定RNA浓度与纯度,并逆转录合成cDNA,储存于-80 ℃冰箱中待用。以β-actin作为内参,qRT-PCR检测分析LASS2 mRNA相对表达水平(反应条件:95 ℃、30 s;95 ℃、5 s;60 ℃、34 s,40个循环;融解曲线:95 ℃、15 s;60 ℃、60 s;95 ℃、15 s),以2-ΔΔCt计算基因相对表达量。目的基因引物序列:β-actin上游5′-TCCTGTGGCATCCACGAAACT-3′,下游5′-GAAGCATTTGCGGTGGACGAT-3′;LASS2上游5′-ATCGTCTTCGCCATTGTT-3′,下游5′-CGGTCACTGCGTTCATCT-3′。
1.2.3CCK-8法检测细胞增殖能力 将呈对数生长的HepG2细胞接种至96孔板中,次日感染Adv-GFP、Adv-LASS2-GFP,分别在感染0、24、48、72 h,加入100 μL DMEM以及10 μL CCK-8试剂,37 ℃孵育2 h后,于酶标仪450 nm处测定各吸光度(A)值并制作生长曲线。
1.2.4Annexin V-APC/7 AAD双染色检测细胞凋亡 感染48 h后,采用不含EDTA的0.25%胰蛋白酶消化并收集各组HepG2细胞,严格按试剂说明书操作,用冷PBS洗涤2次,收集细胞、加入500 μL的Binding Buffer重悬细胞,依次添加5 μL Annexin V-APC和5 μL 7-AAD,充分混匀并在室温下避光孵育15 min后,置于流式细胞仪检测并采用Cell Quest软件分析各组细胞凋亡率。
1.2.5Western blot法检测各组细胞LASS2、自噬、凋亡相关蛋白及AMPKα/哺乳动物雷帕霉素靶蛋白复合物1(mTORC1)信号通路相关蛋白的相对表达水平 转染48 h后,按照全蛋白提取试剂盒说明书提取各组细胞总蛋白,BCA法定量蛋白浓度,经蛋白变性、分装并暂存于-80 ℃。每个泳道上样量为20 μg,10%或12.5%SDS-PAGE分离各组细胞蛋白并电转至PVDF膜。5%脱脂牛奶在室温下封闭2 h,4 ℃一抗(参照各一抗厂家推荐稀释比)孵育过夜。二抗(羊抗鼠、羊抗兔二抗稀释倍数均为1:5 000)室温孵育2 h,洗膜、成像,测量条带灰度值并统计数据,计算LASS2、BCL2、Bax、SQSTM1、Beclin-1、LC3A/B、t-AMPKα、p-AMPKα、t-Raptor、p-Raptor蛋白相对表达量。

2 结 果
2.1LASS2在HepG2肝癌细胞过表达的验证 实验组LASS2 mRNA、蛋白相对表达水平较空白对照组、空载组明显上调(P<0.001),LASS2 mRNA相对表达水平较空白对照组上调51.6倍,其蛋白表达水平上调40倍,而空白对照组和空载组比较差异无统计学意义(P>0.05)。
2.2过表达LASS2对HepG2肝癌细胞增殖的抑制作用 与空白对照组、空载组比较,实验组细胞活力在24 h差异无统计学意义(P>0.05),而48 h、72 h的细胞活力分别为空白对照组的(57.6±3.0)%和(23.8±0.3)%,差异均有统计学意义(P<0.001);空白对照组和空载组细胞活力比较差异无统计学意义(P>0.05)。这表明过表达LASS2抑制了HepG2肝癌细胞增殖的,见图1。

注:与对照组及空载组比较,***P<0.001。
2.3过表达LASS2对HepG2肝癌细胞凋亡的影响 实验组细胞凋亡率明显高于对照组,差异有统计学意义(均P<0.001),空白对照组和空载组未见明显统计学差异(P>0.05)。
表1 流式细胞术检测HepG2各组细胞的凋亡率
2.4过表达LASS2对HepG2细胞中凋亡相关蛋白的影响 与空白对照组、空载组相比,实验组凋亡相关蛋白BCL2相对表达水平明显下调(P<0.001),同时Bax蛋白相对表达水平明显上调(P<0.001),空白对照组与空载组比较差异无统计学意义(P>0.05),这表明过表达的LASS2促进HepG2肝癌细胞凋亡,见图2。
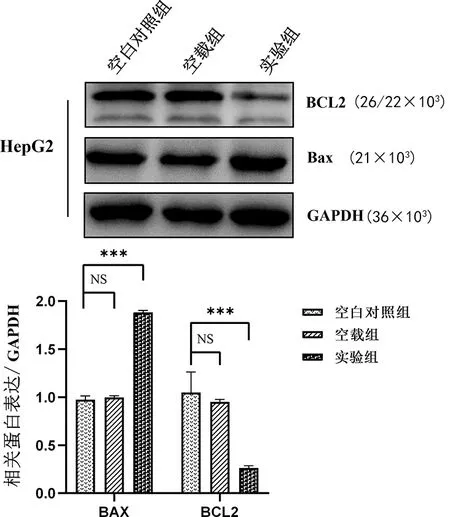
注:与空白对照组及空载组比较,***P<0.001;NS表示差异无统计学意义。
2.5过表达 LASS2对HepG2细胞自噬相关蛋白Beclin-1、LC3A/B 、SQSTM1的影响 与空白对照组、空载组相比,实验组SQSTM1蛋白相对表达水平明显较低(P<0.001),而Beclin-1、LC3A/B蛋白表达水平均明显上调(P<0.001);空白对照组和空载组比较差异无统计学意义(P>0.05)。见图3。
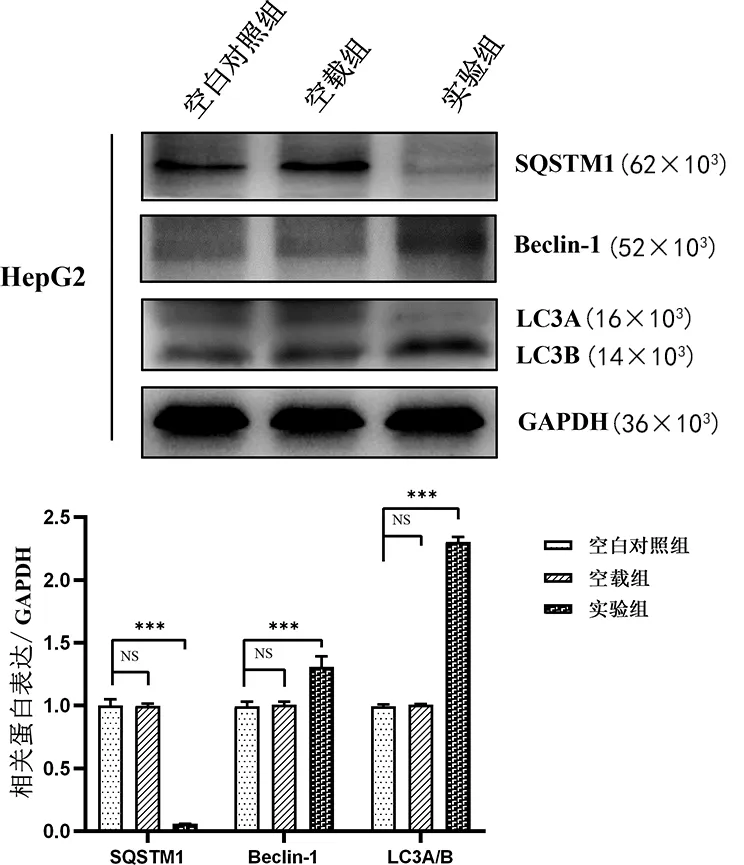
注:与空白对照组及空载组比较,***P<0.001;NS表示差异无统计学意义。
2.6LASS2诱导HepG2细胞自噬和凋亡与AMPKα/mTORC1信号通路的关系 与空白对照组、空载组相比,实验组p-AMPKα/t-AMPKα的比值和p-Raptor/t-Raptor比值均明显上调(P<0.001),空白对照组和空载组比较差异无统计学意义(P>0.05),见图4。

注:与空白对照组及空载组比较,***P<0.001;NS表示差异无统计学意义。
3 讨 论
多数研究认为LASS2是一个抑癌基因,在肿瘤细胞增殖、侵袭和迁移起抑制作用并可促其凋亡。SU等[11]研究提出TMSG1/LASS2可能通过caspase依赖的线粒体途径抑制HEK293和293T细胞增殖,诱导细胞凋亡。本课题组前期研究发现,LASS2过表达可促HepG2肝癌细胞、Hepa1-6肝癌细胞ROS生成增多[9,12]。然而,内源性ROS主要在线粒体或由还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶产生,线粒体是否存在LASS2的作用靶点本课题组对此进行了深入研究,并率先揭示LASS2可能与线粒体复合物Ⅰ活性主要调节因子——NDUFS2相互作用介导了线粒体活性氧(mtROS)的生成[12]。而mtROS的积累可使线粒体膜通道开放并影响线粒体的功能,研究认为线粒体功能的严重损害可引起自噬、凋亡[13]。
在本课题前期研究中证实了LASS2过表达使HepG2肝癌细胞线粒体膜电位下降,且胞内Ca2+超载,线粒体功能受损,但是否激活细胞凋亡信号通路和自噬需进一步研究证实。在本研究中,流式细胞术分析及Western blot结果表明,过表达的LASS2显著促进HepG2肝癌细胞凋亡并上调其Bax蛋白、降低BCL2蛋白的表达,提示LASS2通过调控线粒体相关内源性凋亡途径介导肝癌细胞程序性死亡。有研究表明,下调LASS2导致神经母细胞瘤细胞系SMS-KCNR细胞发生自噬和未折叠蛋白反应[14]。不同的是,在关于心肌细胞损伤的研究中,LASS2的过度表达导致VLC神经酰胺升高,导致胰岛素抵抗、氧化应激、线粒体功能障碍和线粒体自噬[15]。然而,自噬在癌症中的作用仍不清楚,因为它可以作为肿瘤的启动子或抑制剂。QU等[16]研究发现Beclin-1杂合子小鼠和肝脏特异性Atg5 KO小鼠在衰老时发生自发性肝肿瘤,提供了支持自噬在肝肿瘤中抑制作用的证据。本研究结果提示:LASS2过表达促使HepG2肝癌细胞中Beclin-1、LC3A/B蛋白相对表达水平增加,自噬底物蛋白SQSTM1表达降低,激活HepG2肝癌细胞自噬。这与LAW等[15]研究报道相同,与STEFKA等[14]的研究不符,这可能与不同癌症类型和遗传背景有关。越来越多的研究揭示,细胞凋亡调节与自噬诱导之间存在深层联系,在每个过程的不同阶段都发生串扰[17],而这种串扰是癌症发病机制的基础,也是肝癌治疗有希望的靶点之一。笔者推测LASS2促HepG2肝癌细胞凋亡并激活自噬,两者相互促进癌细胞程序性死亡,这将为肝癌的临床前治疗选择提供参考资料。
基于本课题前期研究基础“LASS2过表达促ROS生成增加”,本研究进一步探讨过表达LASS2激活自噬、凋亡的可能信号通路。自噬的激活受营养/能量传感器的两个关键组成部分AMPK和mTORC1的调节。mTORC1是mTOR激酶与mTOR调节相关蛋白、MLST8、PRAS40和DEPTOR等亚基形成的复合物,是自噬的主要调节因子,还直接调节自噬过程的后续步骤[18]。激活的AMPK也可以通过Raptor磷酸化抑制mTORC1的活性,进而启动自噬,且两者之间存在一个必不可少的双重负反馈机制,对自噬的适当动态特性至关重要[19]。本研究结果表明LASS2过表达激活AMPKα,促使Raptor磷酸化抑制mTORC1的活性,结合本课题前期研究结果[12], NDUFS2作为氧感知器及线粒体复合物I产生ROS的主要靶点之一,LASS2与其互相作用介导了mtROS的生成,而mtROS作为第二信使通过AMPKα亚基直接激活AMPK及下游级联信号如mTORC1信号通路,这可能是LASS2激活HepG2自噬的机制,这一结果的发现是不同于既往研究的。最近的研究表明,AMPK通过刺激不同的细胞过程,如凋亡、自噬、细胞生长和增殖,通过各种信号分子发挥肿瘤抑制活性[20],mTOR(尤其是mTORC1)信号的过度激活与致癌细胞过程有关[18]。因此,本研究推测AMPKα/mTORC1(Raptor)信号通路是LASS2激活HepG2肝癌细胞自噬和凋亡的关键信号通路,也是LASS2抑制肝癌进程的可能机制,将会在后续研究中证实这一科学假设。
综上所述,LASS2可能通过AMPKα/mTORC1信号通路诱导HepG2肝癌细胞自噬和凋亡,但具体作用机制有待后续深入研究,这可能为肝癌的治疗提供新的理论基础或新的策略。
