鸭星状病毒3型TaqMan探针荧光定量PCR检测方法的建立与应用
2022-10-24傅秋玲傅光华程龙飞施少华陈红梅万春和刘荣昌
傅秋玲,傅光华*,程龙飞,施少华,陈红梅,万春和,刘荣昌,黄 瑜*
(1.福建省农业科学院 畜牧兽医研究所,福建 福州 350013;2.福建省禽病防治重点实验室,福建 福州 350013)
鸭星状病毒(duck astrovirus,DAstV)是引起鸭病毒性肝炎的重要病原之一,为星状病毒科(Astroviridae)禽星状病毒属(Avastrovirus)的成员,该病毒具备星状病毒的典型特征,即为无囊膜、表面呈特征性六角或五角“星”样状结构的单股正链小RNA病毒。病毒粒子直径为28~30 nm,其基因组全长约7.4 kb,包含3个主要的开放阅读框(ORFs)(ORF1a、ORF1b和ORF2),编码非结构蛋白nsp1a、非结构蛋白nsp1b、RNA依赖的RNA聚合酶(RDRP)及衣壳蛋白等;病毒基因组5′端非编码区长为19 bp,含有CCGAA基序,3′端非编码区为219 bp,含有星状病毒共有序列s2m基序且其末端带有poly(A)尾[1-3]。目前已报道的鸭星状病毒分为鸭星状病毒1型(DAstV-1)、鸭星状病毒2型(DAstV-2)、鸭星状病毒3型(DAstV-3)和鸭星状病毒4型(DAstV-4)。DAstV-1最早于1985年在英国的鸭肝炎病例中被发现,当时被命名为血清2型鸭肝炎病毒,随后于2005年被更名为DAstV-1[1,4]。2009年,TODD等[5]报道传统的血清3型鸭肝炎病毒归为星状病毒属的成员,有学者鉴于其与DAstV-1 M52株的序列同源性仅为64%~69%,建议将其命名为DAstV-2。DAstV-3和DAstV-4是近年来在鸭群中发现的新型星状病毒,其确切的分类地位尚不明确,因其基因序列与DAstV-1及DAstV-2同源性均较低,学者建议另外设立为DAstV-3和DAstV-4[6-7]。4种DAstV间的抗原性和基因组序列同源性差异较明显。
DAstV感染可引起鸭发生病毒性肝炎,病雏鸭常呈现角弓反张、肝脏出血充血、肾脏肿大,鸭群病死率可达50%以上[8]。近年来,尽管养鸭产业不断升级,集约化、规模化程度越来越高,鸭病毒性肝炎依然是严重威胁养鸭业健康发展的重要传染病之一。LIU等[6]对我国江西、广东、山西等多地的鸭群开展DAstV-3流行病学调查发现,不同品种、日龄的鸭粪样均可检测到该病毒核酸,阳性率30%~83.9%,在孵化过程中死亡的胚蛋及新生雏鸭也可检测到不同程度的DAstV-3感染;本研究团队也自入孵后死亡的樱桃谷种鸭胚中检测并分离到DAstV[9]。由此可见,DAstV-3不仅可通过消化道途径向外排毒,还可经鸭胚垂直传播,是导致孵化场鸭胚孵化率降低、弱雏率和死淘率增加的主要危害因素[7,10]。DAstV-3在我国鸭群中的广泛流行对鸭群健康养殖造成严重威胁,急需对鸭场、活禽市场,尤其是孵化场,建立常态化的DAstV-3监测机制,为实时了解该病的流行动态及制定有效的防控策略提供技术支撑。目前,尚未见对临床样品开展实时定量检测DAstV-3方法的相关报道。鉴于此,本试验基于DAstV-3nsp1a基因序列建立了检测该病毒的TaqMan实时荧光定量PCR方法,为开展鸭群中DAstV-3的临床诊断及流行病学调查提供可靠技术支撑。
1 材料与方法
1.1 主要试剂与仪器病毒基因组DNA/RNA提取试剂盒(EasyPure 病毒DNA/RNA Kit)、琼脂糖凝胶回收试剂盒和质粒快速提取试剂盒均购自北京全式金生物技术公司;HiScript第1链cDNA合成试剂盒购自Vazyme公司;qRT-PCR试剂盒Premix Ex TaqTM(Probe qPCR)和DL2000 DNA Marker均购自宝生物工程(TaKaRa)有限公司;Phanta Max Super-Fidelity DNA聚合酶和dNTP购自Vazyme公司;其他常规化学试剂和耗材均购自生工生物工程(上海)股份有限公司。ND8000紫外分光光度计美国Thermo Scientific公司、TP600PCR仪日本TaKaRa公司、Mastercycler ep realplex荧光定量PCR扩增仪为德国Eppendorf公司产品。
1.2 试验毒株H9亚型禽流感病毒、禽坦布苏病毒、鸭瘟病毒、鸭呼肠孤病毒、番鸭细小病毒、鸭甲肝病毒和DAstV-3 GX1806毒株[9],均由福建省农业科学院畜牧兽医研究所分离鉴定并保存。
1.3 引物与探针设计参考GenBank中公布的DAstV-3nsp1a基因特征,利用引物设计软件Oligo(版本v7.37)设计引物(nsp1a-F1/nsp1a-R1)用于构建阳性质粒标准品,预计扩增产物大小为278 bp;设计引物Distnsp1a-F2/Distnsp1a-R2/DAstV-3-P为TaqMan荧光定量PCR方法的上、下游特异性引物和探针,预计扩增大产物小为148 bp(表1);用于常规RT-PCR方法检测DAstV-3的引物序列参见文献[9],预计扩增大小为372 bp。这些引物和探针均由铂尚生物技术(福州)有限公司合成。
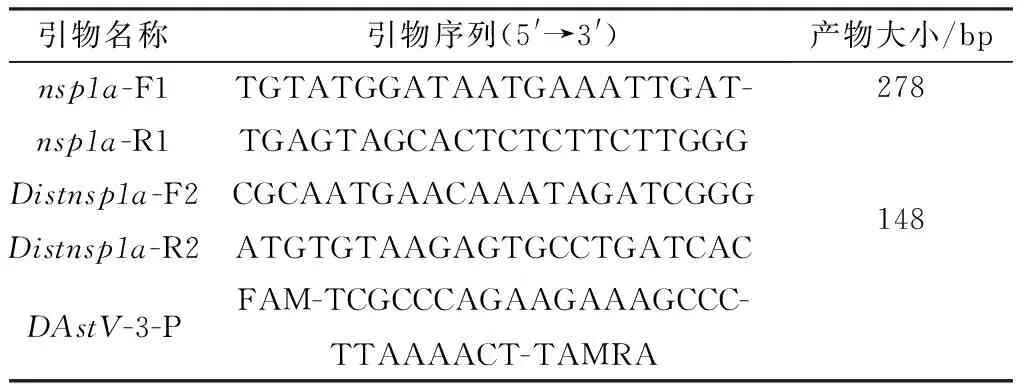
表1 本试验所需的引物
1.4 重组阳性质粒标准品的制备以DNA/RNA提取试剂盒所提取的DAstV-3 GX1806株RNA、用反转录试剂盒进行反转录合成的cDNA为模板,使用扩增nsp1a基因片段的引物(nsp1a-F1/nsp1a-R1)进行PCR扩增。PCR反应体系为2×PCR混合物25 μL,Phanta Max Super-Fidelity DNA聚合酶1 μL,10 μmol/L高纯度dNTPs 1 μL,10 μmol/L的上、下游引物各1 μL,15 mg/L模板cDNA 2 μL,最后用去离子水补充至总体积50 μL。PCR扩增程序为95℃预变性3 min,随后进入PCR循环(95℃ 30 s,53℃ 30 s,72℃ 35 s),35个循环,72℃延伸10 min。反应结束后,取5 μL扩增产物进行琼脂凝胶电泳检测,回收目的条带克隆至pMD18-T载体构建重组质粒,送铂尚生物技术(福州)有限公司测序验证。将验证正确的重组质粒作为反应模板及阳性标准品质粒,用微量核酸测定仪测定阳性标准品质粒的浓度,根据公式即拷贝数=质粒浓度×6.02×1023/(660×质粒总长度)计算其拷贝数。
1.5 TaqMan探针实时荧光定量PCR方法反应条件的优化按照Premix Ex TaqTM(Probe qPCR)试剂盒说明书配置25 μL实时荧光定量PCR方法的反应体系,以同一浓度标准品为模板,在不同引物(Distnsp1a-F2、R2)浓度(0.125,0.250,0.500,1.000 μmol/L)、探针(DAstV-3-P)浓度(0.250,0.500,1.000 μmol/L)和不同退火温度(53,55,57,61℃)下进行实时荧光定量PCR方法,对反应程序进行优化。
1.6 TaqMan探针实时荧光定量PCR方法标准曲线的建立对阳性重组质粒依次进行10倍倍比稀释后,选取2.13×101~2.13×107拷贝/μL的7个浓度作为标准品模板,并根据已建立的实时荧光定量PCR方法进行扩增,获得不同浓度标准品的扩增曲线。以标准品起始浓度的常用对数作为横坐标,以出现荧光的循环阈值(Ct值)为纵坐标,获得该方法的扩增曲线。
1.7 灵敏度检测将重组质粒进行10倍倍比系列稀释后作为模板,利用已建立的实时荧光定量PCR进行扩增,根据扩增曲线确定质粒的最低拷贝数。
1.8 特异性检测利用病毒基因组DNA/RNA提取试剂盒提取H9亚型禽流感病毒、禽坦布苏病毒、鸭瘟病毒、鸭呼肠孤病毒、番鸭细小病毒、鸭甲肝病毒和DAstV-3 GX1806毒株的DNA或RNA,将病毒RNA反转成cDNA,并以病毒的DNA或cDNA作为模板且按优化后的反应程序进行实时荧光定量PCR方法检测,以验证所建立方法的特异性。
1.9 重复性检测选取10倍稀释标准品的7个浓度(设3个重复进行组内试验并计算组内变异系数。同时,将这些标注品于-20℃保存,分别每隔7 d重检1次,连续检测3次,并计算组间变异系数,以验证该方法的重复性。
1.10 临床样品的检测利用已建立的实时荧光定量PCR方法和常规RT-PCR方法对来自福建、江西、广西和广东等4个省区的231份疑似DAstV-3样品进行检测;同时,比较分析这2种方法的检测结果。
2 结果
2.1 TaqMan探针实时荧光定量PCR方法检测条件的优化经优化后的实时荧光定量PCR反应体系为Premix Ex TaqTM混合液12.5 μL,10 μmol/L正向引物 0.5 μL,10 μmol/L反向引物 0.5 μL,5 μmol/L 探针1 μL,质粒标准品1 μL,补足去离子水至25 μL。最终确定的反应程序为95℃预变性30 s;95℃ 5 s,55℃ 10 s,72℃ 20 s,40个循环。
2.2 TaqMan探针实时荧光定量PCR方法的标准曲线根据拷贝数计算公式得出重组质粒浓度为2.13×107拷贝/μL。系列浓度标准品扩增动力学曲线显示,已优化的实时荧光定量PCR方法在标准品浓度为2.13×101~2.13×107拷贝/μL范围内具有良好的线性关系,其线性方程为y=-3.13x+33.09,相关系数为0.997,扩增效率为1.09(图1)。
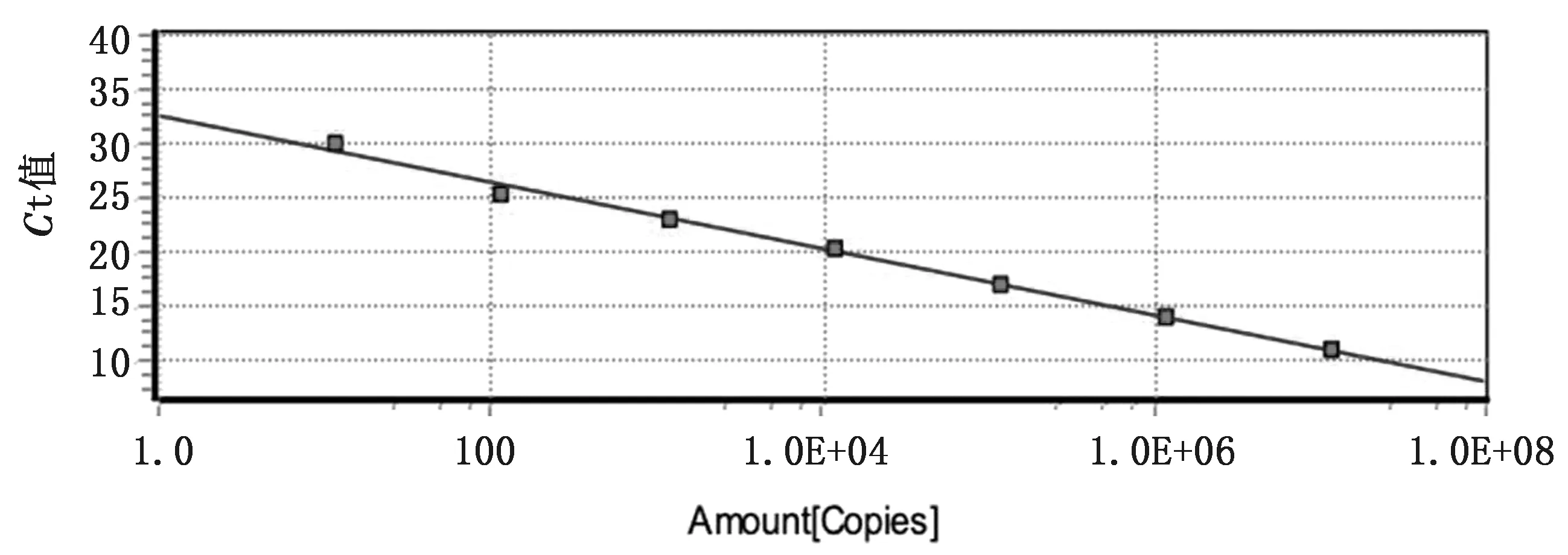
图1 TaqMan探针实时荧光定量PCR方法的标准曲线
2.3 TaqMan探针实时荧光定量PCR方法的灵敏性试验用建立的实时荧光定量PCR方法对不同浓度标准品进行检测,结果显示该方法最低检测限为21.3拷贝/μL(图2)。
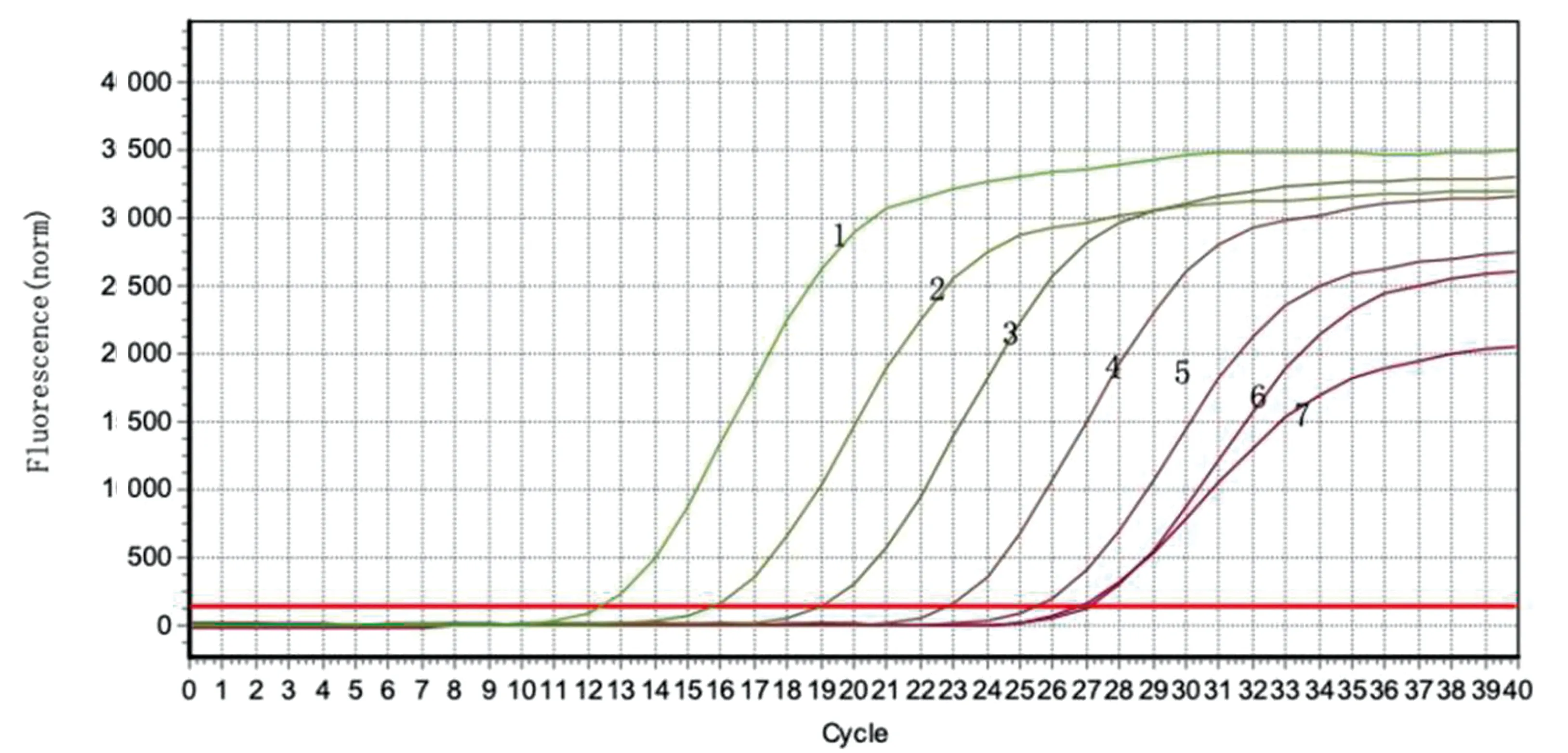
M.DL2000 DNA Marker;1~7.标准品质粒浓度分别为2.13×107~2.13×101拷贝/μL
2.4 TaqMan探针实时荧光定量PCR方法的特异性分析本试验建立的实时荧光定量PCR检测方法仅对DAstV-3 GX1806株有阳性扩增信号,对H9亚型禽流感病毒、禽坦布苏病毒、鸭瘟病毒、鸭呼肠孤病毒、番鸭细小病毒和鸭甲肝病毒等均未检测到信号,表明建立的实时荧光定量PCR方法特异性强(图3)。
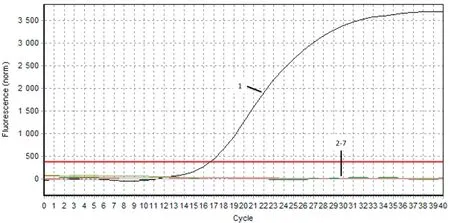
1.DAstV-3 GX1806株;2.H9亚型禽流感病毒;3.禽坦布苏病毒;4.鸭瘟病毒;5.鸭呼肠孤病毒;6.番鸭细小病毒;7.鸭甲肝病毒
2.5 TaqMan探针实时荧光定量PCR方法的重复性分析选取3个浓度的标准品分别进行批内和批间重复性试验,结果显示,组内变异系数在0.58%~2.19%之间;组间变异系数在0.68%~2.53%之间,均在5.00%以下,表明本方法具有良好的重复性(表2)。
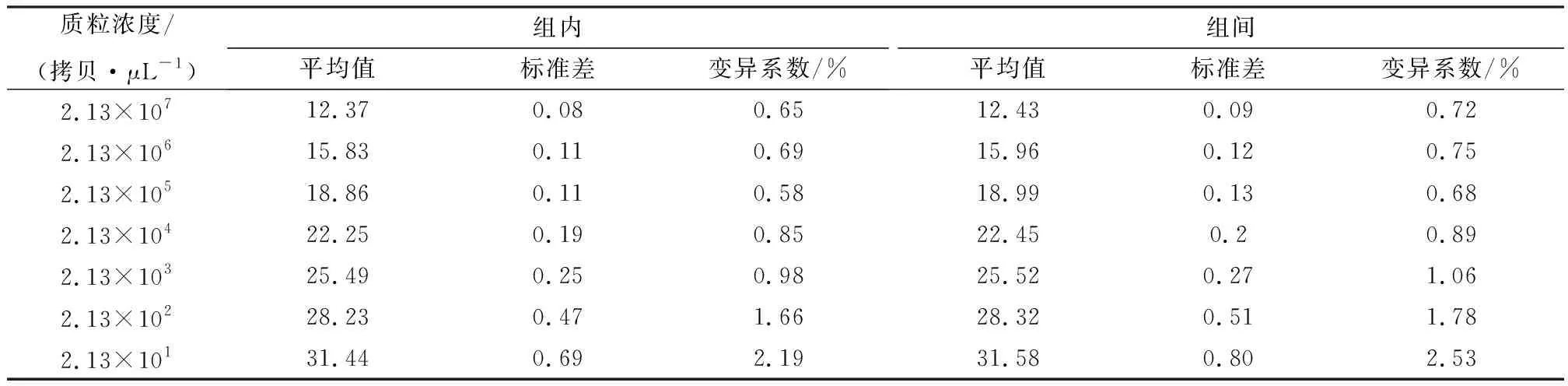
表2 TaqMan探针实时荧光定量PCR方法的组内和组间重复性试验
2.6 TaqMan探针实时荧光定量PCR方法对临床样品的检测利用所建的DAstV-3实时荧光定量PCR方法和常规RT-PCR方法对231份疑似DAstV-3样品进行检测,结果如表3所示。实时荧光定量PCR方法检测福建、江西、广西和广东等4省区的DAstV-3阳性样品分别为48,37,30,17份,共计132份,总的检出率为57.1%(132/231);常规RT-PCR方法只检出DAstV-3阳性样品共105份,总的检出率为45.5%。结果表明,实时荧光定量PCR方法的检测灵敏度比常规RT-PCR方法提高了11.6%。
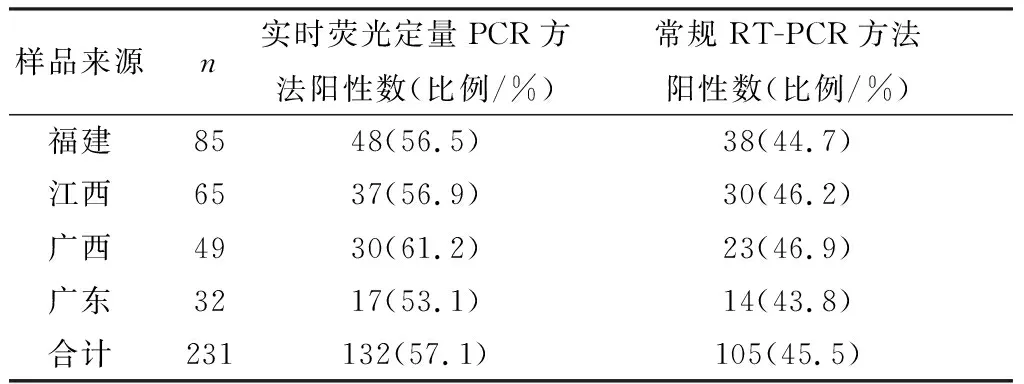
表3 实时荧光定量PCR与常规RT-PCR方法对临床样品的检测结果
3 讨论
鸭病毒性肝炎是临床上一种可引起雏鸭死亡的常见病毒病,给养鸭业带来巨大的经济损失。由于其病原复杂,及时作出准确诊断,采取相应的防治措施是有效控制鸭病毒肝炎的关键。鸭病毒性肝炎病原称为鸭病毒性肝炎病毒(duck hepatitis viral,DHV),分为3个血清型:Ⅰ型、Ⅱ型和Ⅲ型,起初将所有的DHV归为小RNA病毒科,但后来经学者研究发现DHV-Ⅱ和DHV-Ⅲ属于星状病毒[1,11-12]。并且,国际病毒分类委员会在2009年第10次病毒分类报告中最终将DHV-Ⅰ定为小RNA病毒科禽肝病毒属的鸭甲肝病毒(DHAV),DHV-Ⅱ和DHV-Ⅲ被认定为星状病毒科星状病毒属鸭星状病毒的DAstV-1和DAstV-2;而DAstV-3和DAstV-4是我国近年来新发现的,其分类地位暂未正式确定[6-7]。同时,鸭甲肝病毒又包括3个亚型(DHAV-1、DHAV-2和DHAV-3)[13-14],其中DHAV-1和DHAV-3近年来在我国流行的报道越来越多,涉及的地区也越来越广,特别是越来越多基因型鸭星状病毒(DAstV-1、DAstV-2、DAstV-3和DAstV-4)在我国的出现又加大了鸭病毒性肝炎的防治难度[15-18]。
近年来,随着养鸭业的的规模日益增大,鸭肝炎等病症也突显出来,难以控制,成为制约养鸭业健康发展的难题。然而,DAstV-3的存在及在我国的流行情况尚不明确,国内有关DAstV-3的报道也极其缺乏。据报道,采用RT-PCR方法检测了山东、江西和广东等6省市出壳前死亡的北京鸭、绍兴鸭和临武鸭胚样品130份及种鸭地面粪便50份和种蛋60份,其中分别检出DAstV-3阳性样品36份(27.7%)、23份(46%)和39份(65%)[7,10]。本研究通过对我国福建、江西、广西和广东等4省区共231份疑似DAstV-3样品进行检测,TaqMan探针实时荧光定量PCR方法检测到这4省区的DAstV-3阳性率分别56.5%,56.9%,61.2%和53.1%,这表明该病毒已在我国鸭群中大面积流行,其中以广西的感染率最高。这一结果对我国DAstV-3感染的防控提供了重要参考依据。
由于DAstV-3是近年来新发项的病原,有关该病的研究尚处于起步阶段,初步研究集中在病的流行病学、病毒基因组特征和诊断方法等方面,其中已报道DAstV-3的临床诊断方法主要为刘宁等[19]建立的常规RT-PCR方法,但目前尚未建立一种既快速简便又可定量的检测方法。因此,本研究基于DAstV-3nsp1a基因建立了检测该病毒的TaqMan探针实时荧光定量PCR方法,经对该方法反应条件优化后,该方法的标准曲线循环域值与标准品浓度在2.13×101~2.13×107拷贝/μL范围内呈现良好的线性关系。同时,该方法具备3个特点:(1)特异性强,可准确区分DAstV-3与鸭群其他常见传染病病原(H9亚型禽流感病毒、禽坦布苏病毒、鸭瘟病毒、鸭呼肠孤病毒、番鸭细小病毒和鸭甲肝病毒);(2)灵敏度高,检测下限为21.30 拷贝/μL;(3)重复性好,组内和组间重复性试验变异系数均低于5.00%。采用该方法测定我国4省区的临床疑似DAstV-3样品的阳性数为132份,阳性率为57.10%,而常规RT-PCR方法仅检测到105份阳性,表明该实时荧光定量PCR方法比常规RT-PCR方法的灵敏度高(11.60%)。因此,该实时荧光定量PCR方法可应用于DAstV-3临床诊断和流行病学调查,该方法的推广应用,将为及时了解DAstV-3在鸭群中的流行动态,为鸭场(尤其是孵化场)有效防控该病,提升鸭胚孵化率,降低弱雏率和死淘率提供坚实的技术支撑。
