猪圆环病毒-Ⅱ型、猪瘟病毒和猪繁殖与呼吸综合征病毒三重RT-qPCR检测方法的建立及初步应用
2022-10-24赵翠青刘立明沙万里董文龙刘嘉琳李国江
刘 斌,赵翠青,刘立明,沙万里,董文龙,刘嘉琳,李国江*
(1.吉林农业大学 动物科学技术学院,吉林 长春 130118;2.吉林农业科技学院 动物科技学院,吉林 吉林市 132109;3.吉林省预防兽医学重点实验室,吉林 吉林市 132109)
免疫抑制性疾病损伤机体的免疫系统,免疫细胞递呈抗原的能力降低,免疫细胞的免疫应答功能减弱,机体出现免疫麻痹和免疫耐受的状态、淋巴细胞凋亡等情况发生。机体免疫力降低,减弱机体抗病能力,机体长时间的表现为亚临床状态,以致疫苗接种失败,机体缺乏特异性的免疫力。随着当前规模化生猪养殖产业的不断发展,生产中因免疫抑制性因素而导致的多种疾病共发的情况不断上升,养殖场中因多种疾病共存而产生的综合征急剧增多,临床上频繁发生混和、并发或继发感染的情况。猪常见的免疫抑制病毒包括猪圆环病毒-Ⅱ型(porcine circovirus typeⅡ,PCV-Ⅱ)、猪瘟病毒(swine fever virus,CSFV)和猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)、猪细小病毒、猪伪狂犬病病毒等,其中PCV-Ⅱ会引起病猪出现包括体质量减轻、孕猪繁殖障碍、先天性震颤、肾病等症状,CSFV可引起怀孕母猪一系列的繁殖障碍,PRRSV可以引起怀孕母猪出现呼吸道症状、体质量减轻、生长性能差以及繁殖失败。
动物感染了PCV-Ⅱ、PRRSV和CSFV这3种免疫抑制性病毒后,临床症状较为相似且极易发生混合感染或继发感染,也极易与其他病原体发生并发和继发感染,给生猪养殖业造成巨大的损失。仅凭临床症状、病理变化及常规病原学检测手段难以作出准确的诊断,尤其是出现多种病原混合感染时,难以进行早期快速检测,容易造成误诊。本试验拟在建立一种能够在单管内同时对多种病原进行且精确高效的检测方法,便于对此类疾病的诊断和防制。
1 材料与方法
1.1 病毒与主要试剂PCV-Ⅱ、CSFV和PRRSV感染病料均由吉林农业科技学院猪生态养殖及疫病防控中心保存。病毒提取试剂盒、反转录试剂盒、PCR预混酶、RT-qPCR预混酶均购自TaKaRa(大连)公司;凝胶回收试剂盒、质粒提取试剂盒购自AXYGEN公司。
1.2 引物的设计与合成从GenBank上下载PCV-Ⅱ(登录号NC_005148)、CSFV(登录号AY805221)和PRRSV(登录号NC_001961)的全基因组序列,针对各病毒的保守区域,即PCV-Ⅱ(ORF2)、CSFV(ORF1)、PRRSV(ORF6),分别设计用于构建PCV-Ⅱ、CSFV和PRRSV重组质粒标准品的普通PCR引物(表1)和用于荧光定量PCR不同荧光基团标记的探针(表2)。

表1 常规PCR引物
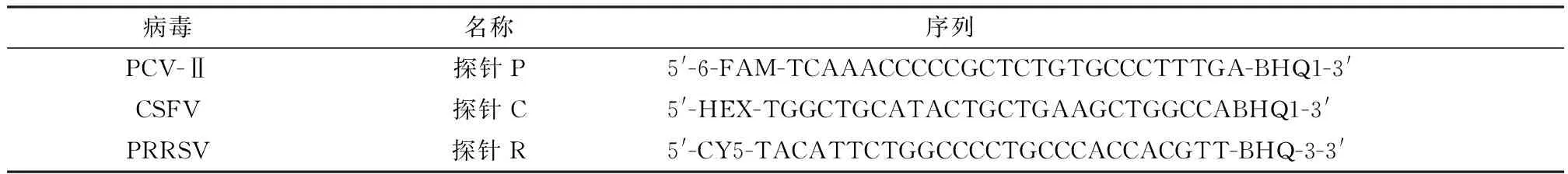
表2 荧光定量PCR探针
1.3 标准质粒的构建自病料中提取PCV-Ⅱ、CSFV和PRRSV的基因组,以其为模板进行PCR扩增,确定为目的片段后,将其回收纯化,连入pMD18-T载体,转化感受态细胞。对构建的重组质粒pMD18-T-PCV-Ⅱ、pMD18-T-CSFV和pMD18-T-PRRSV进行PCR验证,验证成功的质粒送由生物公司测序。测序结果与相对应GenBank上的序列进行比对,测定质粒浓度,按公式转换为拷贝数。
1.4 三重荧光定量PCR反应体系的优化对PCV-Ⅱ、CSFV和PRRSV三重荧光定量PCR体系进行退火温度、引物浓度、探针浓度的优化。退火温度分别设置为50.3,50.9,51.8,52.8,53.8,54.8,55.8,56.8,57.7,58.3℃;将引物和探针浓度分别设置为0.1,0.2,0.3,0.4 μmol/L。以确定3种病毒单重荧光定量PCR最佳反应条件。
1.5 三重荧光定量PCR特异性试验依照优化后的三重荧光定量PCR体系,分别加入PCV-Ⅱ、CSFV、PRRSV、猪伪狂犬病病毒(PRV)、猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)和猪乙型脑炎病毒(JEV)病毒基因组作为反应模板,pMD18-PCV-Ⅱ、pMD18-CSFV和pMD18-PRRSV为阳性对照,灭菌水为阴性对照进行检测,验证其特异性。
1.6 三重荧光定量PCR重复性试验以PCV-Ⅱ、CSFV和PRRSV浓度梯度1×107,1×105,1×103拷贝/μL的标准质粒为模板,按照所建立的单重荧光定量PCR体系,分别进行组内、组间重复试验。运用SPSS软件分析整理组内、组间的Ct值,评价单重荧光定量PCR体系的重复性。
1.7 三重荧光定量PCR灵敏性试验将PCV-Ⅱ、CSFV和PRRSV重组质粒标准品1.0×101~10×107拷贝/μL 7个浓度分别作为反应模板,进行三重荧光定量PCR反应。能够扩增出曲线的标准质粒最低拷贝数即为三重荧光定量PCR体系的灵敏度。
1.8 三重荧光定量PCR标准曲线的建立分别取PCV-Ⅱ、CSFV和PRRSV重组质粒标准品5个浓度梯度1.0×103~1.0×107拷贝/μL进行三重荧光定量PCR反应。在仪器上设置对应反应孔重组质粒标准品拷贝数,PCR反应结束后,运用软件制作标准曲线。
1.9 临床样品检测利用构建的三重荧光定量PCR检测方法和普通PCR检测方法对由吉林农业科技学院猪生态养殖及疫病防控中心保存的106份病料分别进行检测,对2种方法进行比较。
2 结果
2.1 标准质粒的构建以PCV-Ⅱ、CSFV和PRRSV构建的重组质粒为模板,在特异性引物下进行普通PCR扩增,经凝胶电泳结果显示,PCV-Ⅱ、CSFV和PRRSV扩增产物分别为417,763,452 bp,与目的片段大小一致(图1)。重组质粒测序后,经BLAST在线比对分析后,3种病毒的重组质粒分别与PCV-Ⅱ(登录号NC_005148)、CSFV(登录号AY805221)和PRRSV(登录号NC_001961)的序列同源性均大于98%。

M.DL2000 DNA Marker;1.PCV-Ⅱ阳性质粒;2.CSFV阳性质粒;3.PRRSV阳性质粒
2.2 三重荧光定量PCR的反应体系优化经过对三重荧光定量PCR的反应体系的优化,确定的最佳反应体系如下:引物浓度分别为PCV-Ⅱ 0.3 μmol/L,CSFV 0.3 μmol/L,PRRSV 0.2 μmol/L;探针浓度分别为PCV-Ⅱ 0.2 μmol/L,CSFV 0.4 μmol/L,PRRSV 0.1 μmol/L;反应条件为95℃ 30 s、95℃ 10 s、55.8℃ 30 s,40个循环。
2.3 三重荧光定量PCR特异性应用三重荧光定量PCR体系对PCV-Ⅱ、CSFV和PRRSV进行特异性检测,PCV-Ⅱ、CSFV和PRRSV只能扩增相应的目的基因,而其他的非目的基因及ddH2O均不能扩增(图2),表明所构建的单重荧光定量PCR体系特异性良好。
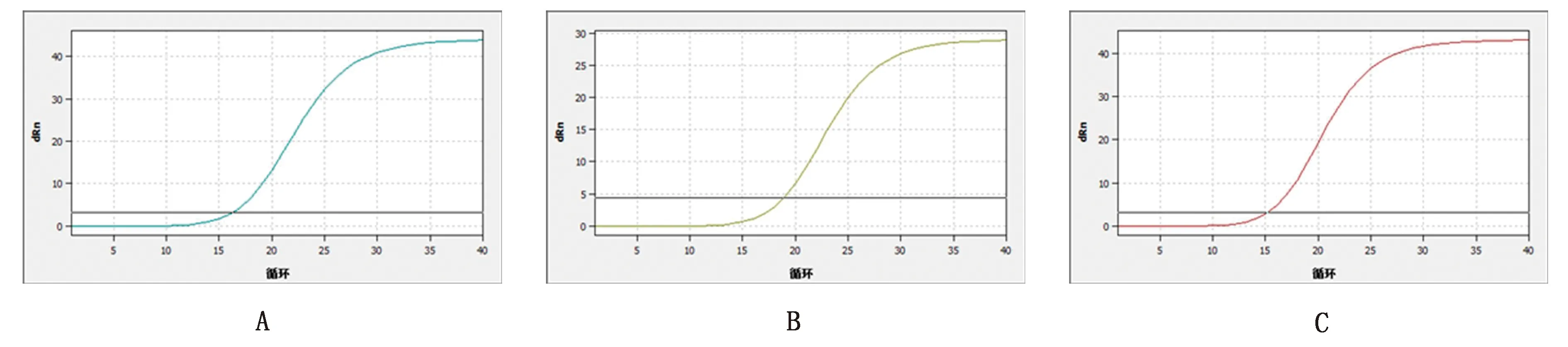
A.PCV-Ⅱ特异性扩增曲线;B.CSFV特异性扩增曲线;C.PRRSV特异性扩增曲线
2.4 三重荧光定量PCR重复性PCV-Ⅱ、CSFV和PRRSV分别在3个浓度梯度(1×107,1×105,1×103拷贝/μL)进行三重荧光定量PCR重复性检测,3种病毒的3个浓度梯度在2种重复试验中的CV均小于5%(表3),表明所构建的三重荧光定量PCR体系重复性良好。
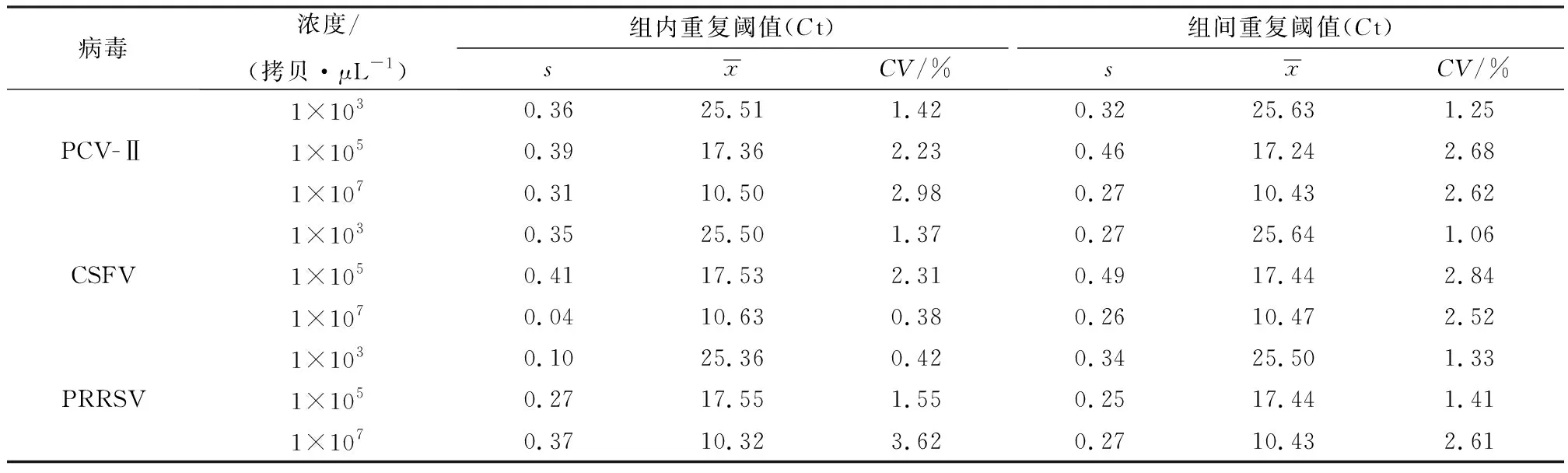
表3 荧光定量PCR重复性试验
2.5 三重荧光定量PCR灵敏性当利用PCV-Ⅱ、CSFV和PRRSV 3种病毒的重组质粒标准品(1×107~1×101拷贝/μL)为模板进行三重荧光定量PCR检测时,7个浓度梯度均有扩增曲线,1×100拷贝/μL时没有曲线(图3),表明PCV-Ⅱ、CSFV和PRRSV 3种病毒单重荧光荧光定量PCR体系检测的灵敏度可达10 拷贝/μL。
2.6 三重荧光定量PCR标准曲线制作以PCV-Ⅱ、CSFV和PRRSV的5个浓度(1×107~1×103拷贝/μL)的重组质粒标准品,应用优化后的三重荧光定量PCR体系,进行PCR反应。3种病毒的标准曲线R2均大于0.99(图4),表明所构建的单重荧光定量PCR体系在重组质粒标准品稀释度范围内呈现良好的线性关系。
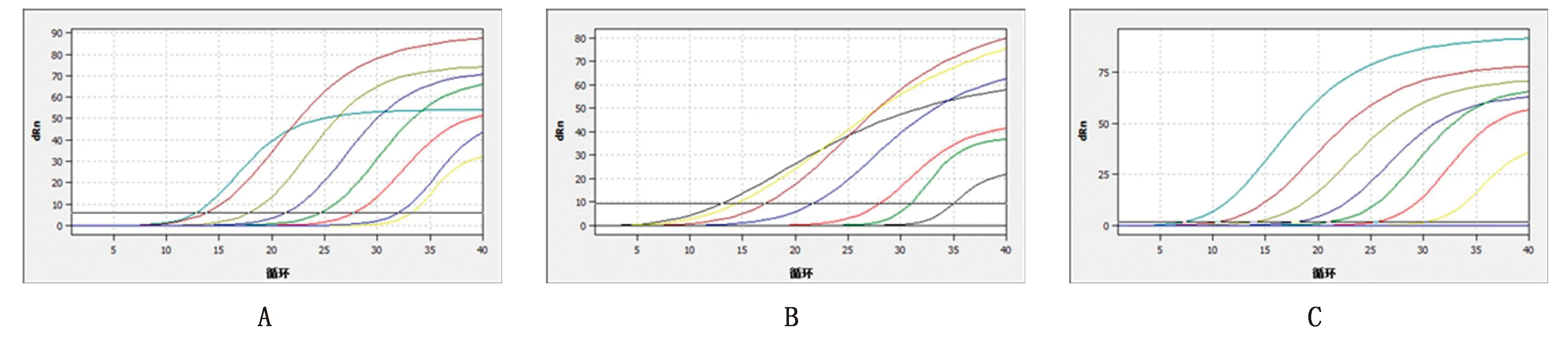
A.PCV-Ⅱ敏感性扩增曲线;B.CSFV敏感性扩增曲线;C.PRRSV敏感性扩增曲线

A.PCV-Ⅱ标准曲线;B.CSFV标准曲线;C.PRRSV标准曲线
2.7 临床样品检测以本试验建立的PCV-Ⅱ、CSFV和PRRSV三重荧光定量PCR检测方法与普通PCR检测方法对收集自吉林省的106份临床样品进行同步检测。结果显示:三重荧光定量PCR中PCV-Ⅱ阳性检出率为74.5%,CSFV阳性检出率为34.9%,PRRSV阳性检出率为18.9%;其中PCV-Ⅱ、CSFV混合感染阳性检出率为22.6%,PCV-Ⅱ、PRRSV混合感染阳性检出率为17.9%,CSFV、PRRSV混合感染阳性检出率为6.6%;PCV-Ⅱ、CSFV和PRRSV三者混合感染阳性检出率6.6%。普通PCR检测中PCV-Ⅱ阳性检出率为37.7%,CSFV阳性检出率为16.9%,PRRSV阳性检出率为7.5%;其中PCV-Ⅱ、CSFV混合感染阳性检出率为7.5%,PCV-Ⅱ、PRRSV混合感染阳性检出率为3.8%,CSFV、PRRSV混合感染阳性检出率为1.9%;PCV-Ⅱ、CSFV和PRRSV三者混合感染阳性检出率1.9%。
3 讨论
特异性引物和探针是构建TaqMan探针法荧光定量PCR体系成功的关键,本试验结合以往的文献报道,针对病毒的保守区PCV-Ⅱ(ORF2)、CSFV(ORF1)、PRRSV(ORF6),应用Primer Premier 5.0软件设计出特异性引物以及特异性探针。引物和探针的质量直接影响着反应的特异性和灵敏性[1]。因为要在单管内同时对3种病毒进行检测,单管则需要加入3对引物和3个探针,引物与引物之间、引物与探针之间,引物自身都容易产生引物二聚体,造成非特异性扩增,影响三重体系的构建[2-3]。退火温度的优化也至关重要,会直接影响最终的扩增效果[4-6]。本试验首先进行了单重实时荧光定量PCR体系的构建及优化,通过多次重复试验对退火温度、引物浓度、探针浓度不断优化,从而确定单重荧光定量PCR体系的最佳反应条件,在此基础上建立三重荧光定量PCR体系并进行优化。对于三重荧光定量PCR体系来说,引物和探针浓度的选择对其的影响更大[7-9]。引物的浓度过低,会造成扩增产物太少;引物浓度过高,容易出现非特异性扩增。探针浓度太高或太低都对反应过程产生干扰,从而影响扩增曲线的平滑与否等[10]。经过对退火温度、引物和探针浓度的不断优化,本试验最终确定的三重荧光定量PCR体系最佳退火温度为53.8℃,引物的最佳浓度分别为PCV-Ⅱ 0.3 μmol/L、CSFV 0.3 μmol/L、PRRSV 0.2 μmol/L,探针的最佳浓度分别为PCV-Ⅱ 0.2 μmol/L、CSFV 0.4 μmol/L、PRRSV 0.1 μmol/L。
本试验结果表明,建立的三重荧光定量PCR检测方法在特异性、敏感性、重复性等方面都有着较为优秀的表现;在灵敏性上的表现尤为突出,PCV-Ⅱ、PRRSV和CSFV的灵敏性均可达到10 拷贝/μL。胡斌等[10]利用多重实时荧光定量PCR体系同时检测PPV、PCV-Ⅱ和Hps,灵敏度达到91~153 拷贝/μL;袁秀芳等[11]利用双重荧光定量体系同时检测CSFV、PRRSV,灵敏度达到20 拷贝/μL;韩志涛等[12]利用多重荧光定量体系同时检测CSFV、PRRSV、PCV-Ⅱ、SIV-H9,灵敏性可达173~211 拷贝/μL;本试验在灵敏性上相较上述研究最多可高出20倍。本试验结果表明,构建的三重荧光定量PCR在做到3种病原在单管内即可完成检测的同时,依然能保持较高灵敏度。大大节约了时间成本,并且还保证了检测的准确性。
利用本试验建立的三重荧光定量PCR体系和普通PCR对收集自吉林地区的106份临床样品进行检测,结果显示当两者同时检测相同的单一病原时,本试验建立的三重体系阳性检出率比普通PCR的阳性检出率最多高出50.6%;当出现多种病原混合感染的情况时,本试验建立的三重体系阳性检出率比普通PCR的阳性检出率最多高出471%。本试验结果表明,建立的PCV-Ⅱ、CSFV和PRRSV三重荧光定量PCR检测方法比普通PCR方法更敏感、更特异。
本试验究针对PCV-Ⅱ、CSFV和PRRSV分别建立了单重实时荧光定量PCR体系,在此基础上建立了这3种病毒的三重荧光定量PCR体系,在特异性、重复性及灵敏性等各方面都符合临床检测要求,可用于临床样品的检测。本试验建立的方法解决了现阶段检测免疫抑制性病毒多种检测方法的弊端,并同时可检测PCV-Ⅱ、CSFV和PRRSV,大大节约了试验成本,为生产实践中PCV-Ⅱ、CSFV和PRRSV的检测提供技术帮助,并为免疫抑制性疾病的分子生物学病原检测、流行病学调查和开发快速诊断试剂盒进一步奠定了基础。
