抑制周细胞铁死亡对脓毒症大鼠肺血管屏障功能的保护作用
2022-10-24刘奕言张紫森包代琴王洪晨刘良明
刘奕言,张紫森,包代琴,王洪晨,李 涛,刘良明
400042 重庆,陆军特色医学中心:野战外科研究部战伤休克与输血研究室,创伤、烧伤与复合伤国家重点实验室1,麻醉科2
脓毒症是感染引起的全身炎症反应综合征,由机体过度炎症所致,其本质是宿主对感染反应的失调,可导致多器官、多系统损伤。据统计,全球每年有脓毒症患者逾3 100万,死亡人数更是高达600万,由于部分中、低收入国家脓毒症流行病学数据缺失,因此,全球脓毒症发病率还可能更高。目前针对脓毒症虽有大量的研究,但其发病机制仍不十分明确,脓毒症发生时机体存在剧烈的炎症反应,但临床应用炎症因子抑制剂后脓毒症患者病死率仍居高不下。近年来有学者发现脓毒症除炎症风暴外还有大量氧化产物堆积的特点,脓毒症时病原体及其毒素激活的炎症反应以及宿主本身不断释放的炎症介质,可影响线粒体氧化呼吸链的偶联过程,造成ROS生成增多,最终损伤组织细胞及多个器官。因此,针对氧化还原失衡的治疗可能有助于更好地救治脓毒症患者。
铁死亡是一种被新发现的细胞死亡方式,其主要机制是在二价铁或酯氧合酶的作用下,催化细胞膜上高表达的不饱和脂肪酸,发生脂质过氧化,从而诱导细胞死亡。此外,还表现在抗氧化体系(谷胱甘肽系统)的调控核心酶GPX4的表达降低。铁死亡抑制剂(ferrostatin-1,Fer-1)可以减轻脂多糖(lipopolys-accharide, LPS)诱导的脓毒症大鼠急性肺损伤。
周细胞是血管周围的一群具有多能干性的壁细胞,在调节多种微血管功能中起关键作用,如血管屏障、血脑屏障、血管生成等,周细胞的丢失会导致血管屏障功能的破坏。脓毒症后周细胞是否会发生铁死亡,周细胞铁死亡是否在脓毒症后血管渗漏中起重要作用,目前尚不清楚。因此,本研究拟采用脓毒症大鼠模型和LPS处理周细胞,探讨周细胞铁死亡在脓毒症肺血管屏障功能中的作用及铁死亡抑制剂Fer-1对肺血管屏障功能的保护作用。
1 材料与方法
1.1 主要试剂
肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)酶联免疫吸附实验(ELISA)试剂盒购自中国Elabscience公司;脂质过氧化物(LPO)ELISA试剂盒购自中国南京建成生物工程研究所;活性氧检测试剂盒购自中国碧云天公司;脂多糖、伊文思蓝(Evens blue,EB)、Ⅰ型胶原酶购自美国sigma公司;Fer-1购自美国MedChem Express公司;山羊抗兔一抗、山羊抗兔二抗购自美国LI-COR公司;周细胞专用培养基购自美国Science cell公司;F12培养基、胰蛋白酶购自美国Hyclone公司;GPX4、 COX2抗体、PFGFR-β抗体、神经胶质抗原2(neuron-glia antigen 2, NG2)抗体购自英国Abcam公司;流式抗体染色液、CD146抗体、血小板衍生生长因子β(platelet-derived growth factor receptor beta, PDGFR-β)抗体购自BD公司;二价铁离子检测探针购自日本同仁化学公司,BODIPY581/591 C11购自美国赛默飞世尔科技公司。
1.2 实验动物及模型建立
健康成年SD大鼠,雌雄各半,体质量(200±220)g,由陆军特色医学中心实验动物中心提供,自由饮食,实验前禁食12 h。本研究经陆军特色医学中心实验动物管理委员会批准,动物处置过程符合伦理要求。
将156只SD大鼠按随机数字表法分为3组:假手术组(Sham组)、盲肠结扎穿孔术组(CLP组)和铁死亡抑制剂组(Fer-1组)。CLP组、Fer-1组通过盲肠结扎穿孔(cecal ligation and puncture,CLP) 术制备大鼠脓毒症模型, Fer-1组在CLP术前1 h经腹腔注射Fer-1(10 mg/kg),Sham组只进行探查操作,不进行盲肠结扎和穿孔。各组术后均按5 mL/200 g剂量腹腔注射无菌生理盐水。流式细胞学实验取假手术组大鼠肺单细胞悬液增设空白未染色组(Blank组)。
1.3 大鼠原代周细胞的提取、培养及模型建立
取初断乳大鼠视网膜,剪碎,转入2 g/L的Ⅰ型胶原酶中,置于37 ℃水浴锅消化30 min后,立即加入含有10%FBS的周细胞培养基终止消化。参照本实验室之前的方法进行过滤、收集、离心。获取的周细胞,加入适量周细胞培养基,将沉淀吹散重悬,转入25 cm的细胞培养瓶中。待细胞长至80%~90%时消化传代。实验分为正常对照组(Normal组)、脂多糖刺激组(LPS组)和Fer-1组,LPS组用10 μg/mL LPS处理周细胞12 h,Fer-1组用2 μmol/L Fer-1预处理周细胞12 h后,再用10 μg/mL LPS处理周细胞12 h。
1.4 样本采集与指标测定
1.4.1 HE染色 CLP术后12 h,将大鼠麻醉固定,在大鼠吸气末夹闭并结扎气管,使肺充盈,打开胸腔,经心脏灌注等渗生理盐水直至肺组织几乎不见血色,而后用4%多聚甲醛继续灌注。取下肺组织,用4%多聚甲醛固定后,用石蜡包埋并切片。将肺组织石蜡切片于60℃烘烤,于二甲苯和梯度酒精中脱蜡并水化。苏木精染细胞核,伊红染细胞质,脱水封片后在光学显微镜下观察各组肺组织形态。
1.4.2 肺伊文思蓝(Evans blue, EB)测定 CLP术后12 h,将大鼠麻醉固定,经颈静脉插管注射EB 60 mg/kg,30 min后用生理盐水灌肺直至肺组织基本不见血色,处死大鼠,取完整肺组织。用冷PBS漂洗表面血液,滤纸吸干组织表面水分,拍照后取左肺上叶称量,加入PBS(组织质量∶PBS体积=0.07 mg/mL)在冰上利用匀浆器匀浆,匀浆液移至离心机离心(4 ℃、8 000×g
、10 min),取上清液再次离心(4 ℃、16 000×g
、10 min),取上清液利用全波长酶标测定仪在590 nm测定光密度值[D
(590)],根据EB标准曲线获得上清液EB浓度。另取上清液利用BCA蛋白测定试剂盒测定蛋白浓度,最终用EB质量与蛋白质量的比值作为肺血管通透性指标。1.4.3 肺湿干质量比测定 CLP术后12 h,将大鼠麻醉固定并处死,打开胸腔,取左肺上叶,用滤纸吸干肺组织表面血液,并称量,而后放置在锡箔纸上。50 ℃烤箱烘干72 h后再次称量,以湿干质量比作为评价肺水肿情况的指标。
1.4.4 TNF-α和IL-6测定 CLP术后12 h,取各组静脉血2 mL,室温静置2 h后,离心取上层血清(4 ℃、1 000×g
、10 min)。ELISA试剂盒测定血清TNF-α和IL-6水平。1.4.5 肺组织细胞流式细胞术分析 CLP术后12 h,将大鼠麻醉固定并处死,打开胸腔,取右肺上叶,生理盐水清洗后置于无血清1640培养基中。将肺置于3~5 mL肺组织消化液Ⅰ中,用眼科剪将肺组织剪碎,置于37 ℃水浴锅中30 min,1 mL移液器每隔10分钟吹打数次后过滤,剩余组织用消化液Ⅱ 37 ℃消化30 min后过滤。取过滤液体400×g
离心5 min,收集沉淀,加入红细胞裂解液3~5 mL,吹打混匀后室温放置10 min,400×g
离心5 min。将细胞按100 μL每管分装到1.5 mL EP管用于后续流式抗体染色。周细胞标志性抗体染色:PDGFR-β(APC),按照1∶20稀释,CD146(PE),按照1∶20稀释,室温避光放置30 min后,流式抗体染色液洗涤细胞,400×g
离心5 min,重悬细胞沉淀后上机检测。脂质过氧化物探针:用Liperfluo(1 μmol/L,37 ℃)孵育细胞1 h后洗涤,400×g
离心5 min,重悬细胞沉淀后上机检测。1.4.6 Western blot检测相关蛋白表达 CLP术后12 h,显微镜下取肺微小静脉组织,提取组织总蛋白,Western blot 检测GPX4、COX2、NG2和PDGFR-β。经电泳分离蛋白,转膜,脱脂牛奶封闭,孵育GPX4一抗(稀释度1∶1 000)、COX2一抗(稀释度1∶1 000)、NG2一抗(稀释度1∶1 000)、PDGFR-β一抗(稀释度1∶1 000)、β-actin一抗(稀释度1∶6 000),4 ℃冰箱过夜。次日TBST洗膜3次,5 min/次,室温孵育二抗(稀释度1∶20 000)。Odyssey红外激光扫描成像系统(LI-COR公司,美国)曝片。采用Image J软件分析条带灰度值,以目的条带灰度值与β-actin条带灰度值的比值反应目的蛋白的表达。
3.2.1 低碳绿色材料的应用 在绿道规划设计中,采用多种绿色手段与生态建设方法,尽可能实现绿道的低碳减排,将废弃材料以新的设计语言呈现,使之得以在绿道景观中重生。如利用绿道内废弃构筑物为基础建造景观建筑、利用场地废弃枕木、山崖剥落的岩石等作为场地铺装,以及利用湖中枯木造景、废弃轮胎等打造景观小品等。
1.4.7 周细胞内ROS检测 接种周细胞于共聚焦培养皿中,根据实验设计处理细胞。按照1∶1 000用无血清F12培养基稀释DCFH-DA,使终浓度为10 μmol/L。去除培养基,加入1 mL稀释好的DCFH-DA。在37 ℃,5%CO细胞培养箱内孵育20 min。用无血清F12培养基洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。在FITC通道用激光共聚焦显微镜观察。
1.4.8 周细胞内Lipid ROS检测 周细胞处理同上。去除培养基后,用无血清F12培养基洗涤细胞1次。加入1 mL浓度为10 μmol/L的BODIPY工作液,在37 ℃,5%CO细胞培养箱内孵育30 min。去除上清,无血清F12培养基清洗3次后用激光共聚焦显微镜观察[Nonoxidized (595 nm), Oxidized (520 nm)]。
1.4.9 周细胞内Fe检测 周细胞处理同上。弃去培养基,用无血清F12培养基洗涤细胞3次。加入1 mL浓度为1 μmol/L的FerroOrange工作液,在37 ℃,5%CO细胞培养箱内孵育30 min。无需清洗,直接在激光共聚焦显微镜下观察(Ex543 nm,Em580 nm)。
1.4.10 动物存活情况 每组按随机数表法随机取16只SD大鼠,CLP术后12 h开始算起,记录动物的72 h存活时间和计算72 h存活率。
1.5 统计学分析
应用 SPSS 13.0 统计软件进行统计学处理,计量资料以表示,多组比较采用单因素方差分析,组内两两比较采用t
检验,存活率和存活时间单独采用Kaplan-Meier生存分析。检验水准 α=0.05。2 结果
2.1 脓毒症后肺血管周细胞大量丢失及Fer-1的保护作用
Western blot检测结果显示,CLP组脓毒症后肺微小静脉周细胞标志物(PDGFR-β和NG2)表达显著降低, PDGFR-β和NG2表达分别较假手术组降低了78.73%和72.42%,见图1A、B;表明肺微小静脉周细胞大量丢失。Fer-1能显著减少脓毒症后肺血管周细胞丢失,表现为Fer-1预处理后,周细胞标志物PDGFR-β和NG2表达分别较CLP组分别增加了146.33%和163.71%。肺组织细胞流式结果显示:假手术组大鼠肺周细胞占比约3.11%,CLP组脓毒症后肺血管周细胞大量丢失,周细胞占比下降至0.86%,Fer-1预处理组肺血管周细胞占比几乎恢复至正常水平,见图1C。结果表明,脓毒症可导致肺血管周细胞铁死亡和丢失,铁死亡抑制剂Fer-1可减少脓毒症后肺血管周细胞铁死亡,减少周细胞丢失。

A、B:Western blot检测结果及定量分析与Sham组比较; b:P<0.01,与CLP组比较;C:肺单细胞悬液流式细胞术分析 Blank:空白未染色组
2.2 脓毒症急性肺损伤、肺血管通透性变化及Fer-1的保护作用
HE染色结果显示(图2A):假手术组大鼠肺组织结构完整,肺泡腔清晰可见,肺泡壁厚度正常,肺泡间隔无水肿,无炎性细胞浸润。CLP组大鼠出现明显的肺损伤改变:肺泡出现大范围破裂伴局灶性肺不张,肺泡壁水肿、增厚,间质和肺泡腔内有明显的炎性细胞浸润。与CLP组相比,Fer-1组大鼠肺损伤减轻,肺泡破裂情况明显减少,肺泡壁水肿减轻,厚度降低。肺湿干质量比结果显示(图2D):与假手术组大鼠相比,脓毒症大鼠肺湿干质量比增加了22.50% (P
<0.01)。Fer-1组大鼠肺湿干质量比较CLP组降低了9.10% (P
<0.01)。EB结果显示(图2B、C):正常组大鼠肺表面光滑,几乎无蓝色斑点。脓毒症大鼠肺表面颜色暗淡, EB大量外渗,全肺呈明显深蓝色,左肺上叶每毫克蛋白内EB含量为(13.36±3.01)ng,是假手术组的3.94倍。 Fer-1组大鼠肺表面色泽明显改善,蓝色斑点大幅减少,左肺上叶单位蛋白EB含量相较于CLP组降低了50.39%(P
<0.01) 。表明脓毒症可导致明显的肺组织损伤,肺血管通透性升高,铁死亡抑制剂Fer-1能减轻脓毒症后急性肺损伤,对脓毒症后肺血管通透性具有保护作用。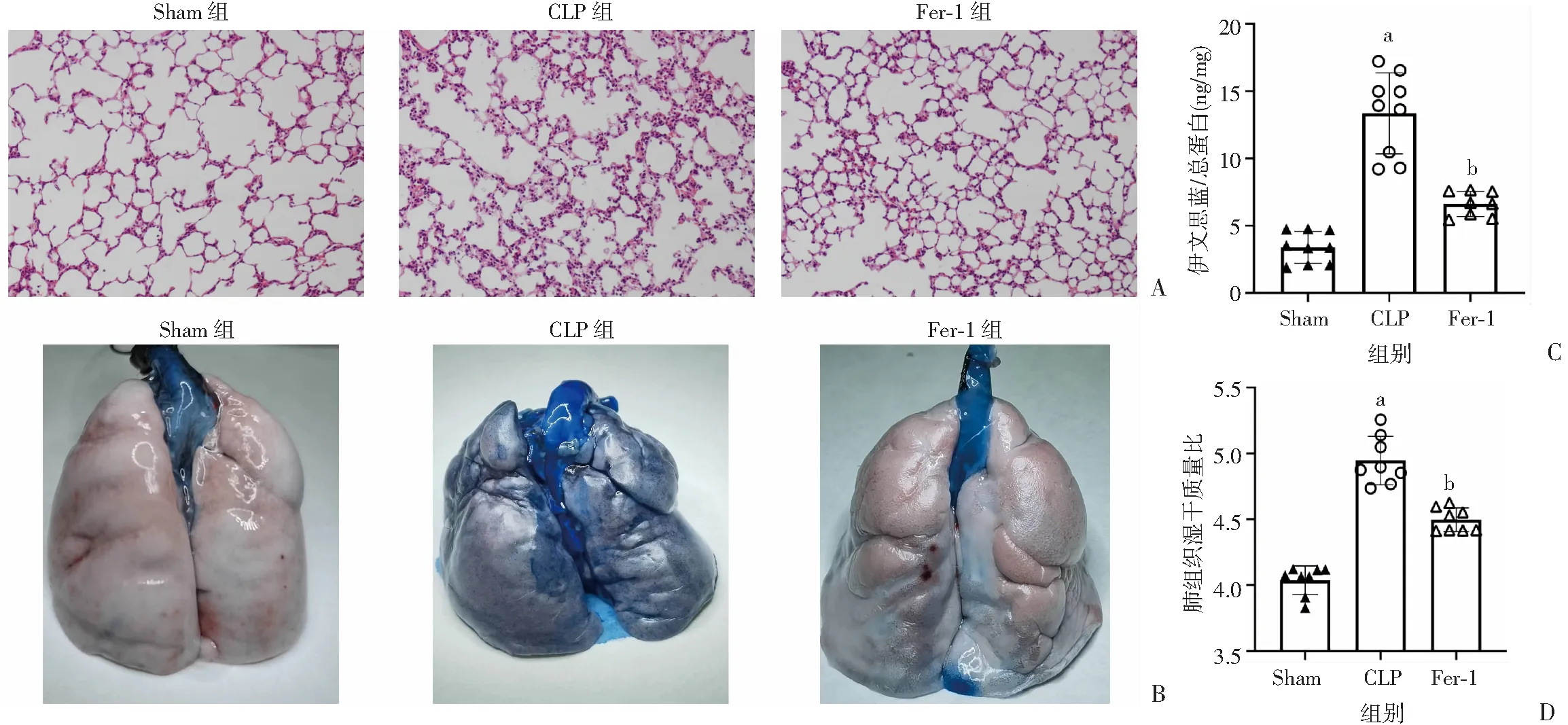
A:各组大鼠肺病理结构变化(HE ×200);B、C:肺EB染色;D:肺湿干质量比 a:P<0.01,与Sham组比较;b:P<0.01,与CLP组比较
2.3 脓毒症肺血管周细胞铁死亡及Fer-1的保护作用
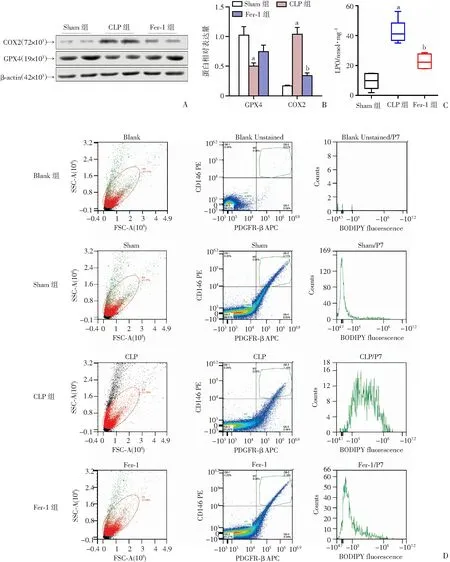
A:Western blot检测结果;B:A图灰度值定量分析结果(n=3);C:肺小静脉脂质过氧化物(LPO)含量测定(n=8);D:肺单细胞选择流式细胞术分析 a:P<0.01,与Sham组比较;b:P<0.01,与CLP组比较
2.4 Fer-1减轻脓毒症后炎症反应,提高脓毒症大鼠存活率
大鼠血浆炎症因子检测结果显示(图4):脓毒症大鼠血浆TNF-α和IL-6水平显著升高,分别是Sham组的5.32倍和5.88倍,Fer-1组和CLP组相比,血浆TNF-α和IL-6水平分别降低了58.92%和68.39%。脓毒症大鼠在24 h内大量死亡,存活时间为(34.8±4.26)h,仅1只存活超过72 h;铁死亡抑制剂Fer-1组大鼠仅2只在24 h内死亡,平均存活时间为(57.7±4.66)h,72 h存活率为43.75%(7/16),动物存活情况显著改善。表明Fer-1可显著抑制脓毒症后炎症因子水平的增加,抑制脓毒症后炎症反应,明显改善动物存活。

A:血清IL-6水平(n=8);B:血清TNF-α水平(n=8);C:存活时间 (n=16);D:72 h存活率 (n=16) a:P<0.01,与Sham组比较; b:P<0.01,与CLP组比较
2.5 周细胞的鉴定
使用细胞免疫荧光技术进行周细胞的鉴定,结果显示:周细胞标志性蛋白,血小板衍生生长因子β(PDGFR-β),alpha-平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA),神经胶质抗原2(NG2)呈阳性表达;内皮细胞标志性蛋白血小板-内皮细胞黏附分子(platelet endothelial cell adhesion molecule-1,PECAM-1/CD31)表达呈阴性。见图5。
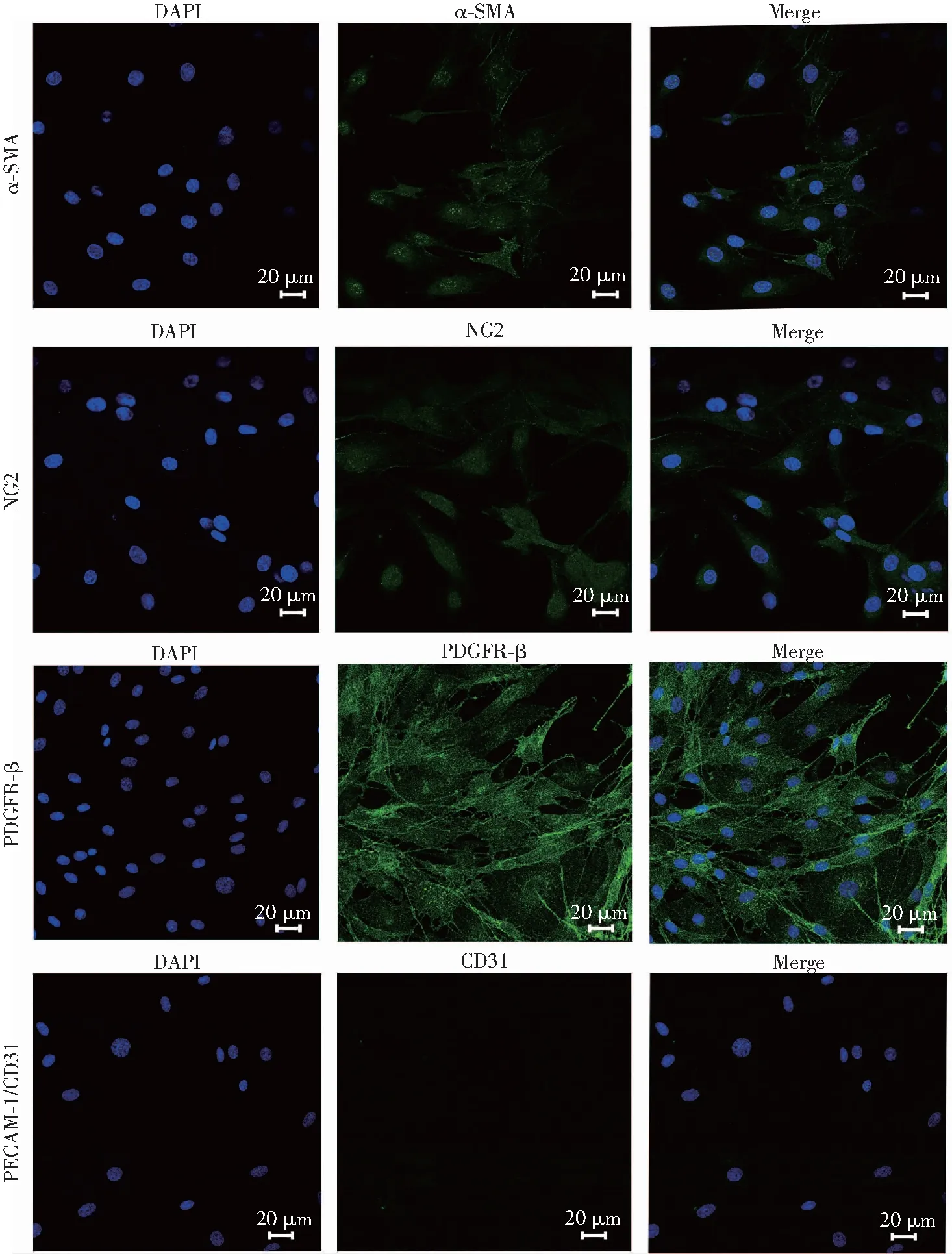
图5 共聚焦显微镜检测周细胞表面标志物表达
2.6 LPS诱导的周细胞铁死亡及Fer-1的保护作用
LPS处理周细胞12 h后周细胞活性显著降低(图6A),细胞内ROS和Lipid ROS显著升高,周细胞内Fe大量蓄积,周细胞发生铁死亡; Fer-1可拮抗LPS诱导的周细胞铁死亡(图6B、C),表现为周细胞活性恢复,胞内ROS、Lipid ROS和Fe含量均显著下降(图6)。表明LPS能诱导周细胞发生铁死亡,Fer-1能显著减轻LPS诱导的铁死亡。

A:CCK-8测定周细胞细胞活性 (n=8) a:P<0.01,与Normal组比较;b:P<0.01,与LPS组比较;B:共聚焦显微镜观察周细胞内ROS和Fe2+含量;C:共聚焦显微镜观察周细胞内Lipid ROS含量
3 讨论
血管渗漏是严重创伤休克、脓毒症等临床重症致多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)甚至死亡的关键因素,血管渗漏主要是通过细胞旁途径和跨细胞(也称穿细胞)途径发生,具体表现为进行性水肿、低血容量性及分布性休克、非蛋白尿性低蛋白血症以及血液浓缩。目前针对血管渗漏的救治措施效果有限,研究血管渗漏的调控机制,寻找有效的防治措施,对提高脓毒症等临床重症的治疗效果有重要意义。
周细胞是在19世纪70年代被发现的一群新的独特的细胞类型,周细胞包裹着毛细血管,可以影响血管的发育和结构稳定。毛细血管壁由内皮细胞和周细胞共同构成,内皮细胞形成血管腔,周细胞则像“爪子”一样环绕着内皮细胞,内皮细胞和周细胞之间由基底膜隔开。周细胞在内皮细胞表面的覆盖率在不同组织中有所不同,两者的比例在1∶1~1∶100之间,血管周细胞密度以大脑和视网膜最高,骨骼肌最低。NEES等发现左心室每单位体积的周细胞数量超过心肌细胞数量。周细胞的数量及周细胞在内皮细胞上的覆盖率对血管的屏障功能至关重要。我们之前的研究发现,脓毒症时周细胞结构受到严重破坏且数量急剧减少,可引起微血管发生严重渗漏。同时,还发现外源性输注周细胞可以通过直接覆盖和旁分泌机制显著改善脓毒症大鼠血管屏障功能,提高动物存活率和延长存活时间。
铁死亡是近年来新发现的一种调节性细胞死亡形式,其特征是铁依赖性脂质过氧物积累到致死水平。铁死亡在细胞形态上主要表现为明显的线粒体皱缩,膜密度增加和嵴减少,这与其他细胞死亡形式明显不同。和自噬对比,铁死亡不会形成典型的封闭双层膜结构(自噬小泡)。
铁死亡有三大生化特征:①活性铁池(labile iron pool )内游离铁蓄积和依赖铁的过氧化物酶激活;②具有多不饱和脂肪酸酰基尾部和易发生过氧化反应的双烯丙基碳的磷脂发生脂质过氧化;③脂质过氧化还原、修复系统受损,包括GSH-GPX4, GCH1-BH4, NADPH-FSPQ-CoQ10。铁死亡的调控途径非常复杂,包括铁、脂质和氨基酸等在内的多代谢途径共同控制着细胞对铁死亡的敏感性。脓毒症时铁代谢发生严重紊乱,包括铁的转运、吸收以及外排,这可导致细胞内大量铁的蓄积;铁大量蓄积一方面可以激活含铁脂氧合酶,另一方面又可以催化芬顿反应(Fenton reaction)产生大量活性氧簇。大量研究表明铁蓄积不仅可以作为脓毒症患者病情严重程度的有效评价指标还可以预测脓毒症病人的预后情况。近年来有研究指出,脓毒症后机体存在严重铁死亡,抑制铁死亡有望成为脓毒症治疗的新靶点。LI等指出脓毒症后NCOA4介导铁蛋白自噬可参与诱导心肌细胞铁死亡,造成心肌损伤,XIAO等实验发现铁死亡抑制剂Fer-1通过TLR4/NF-κB通路显著改善脂多糖诱导的SD大鼠心肌损伤,靶向心肌细胞铁死亡有望成为治疗脓毒症后心脏损伤的重要方法。WEI等报道外源性补给鸢尾素可通过抑制铁死亡保护脓毒症后肝脏功能;衣康酸可通过Nrf2通路抑制巨噬细胞铁死亡拮抗脓毒症急性肺损伤。本研究结果发现,脓毒症后肺微小静脉周细胞铁死亡增加,周细胞大量丢失;EB实验发现肺血管发生严重渗漏,通透性升高,肺组织严重受损。铁死亡抑制剂Fer-1能减轻脓毒症后肺血管周细胞铁死亡,拮抗周细胞丢失,减轻肺血管渗漏,保护肺血管屏障功能,显著改善动物存活。研究结果表明,周细胞铁死亡在脓毒症肺血管屏障功能损伤中起重要作用, 铁死亡抑制剂对脓毒症肺血管屏障功能有重要保护作用。
本实验进一步通过原代分离周细胞,观察LPS处理对周细胞铁死亡的影响及铁死亡抑制剂Fer-1对LPS诱导周细胞铁死亡的拮抗作用。结果发现,LPS处理周细胞后,周细胞内ROS、Lipid ROS和Fe含量显著增加,铁死亡标志性蛋白GPX4表达显著降低,COX2表达显著增加,结果表明LPS可诱导周细胞铁死亡,铁死亡抑制剂Fer-1能拮抗LPS诱导的铁死亡,但脓毒症后周细胞发生铁死亡的具体机制还需进一步的研究。
微循环血管通透性的维护,依赖于血管内皮细胞和周细胞的完整性,除了以往认为的“毛细血管渗漏”外,小静脉和细小静脉在此过程中也发挥重要作用。组胺、缓激肽等其他半衰期较短炎症介质造成的速发短暂效应仅累及口径20~60μm的细静脉,此时细动脉和毛细血管不受累。创伤、烧伤、休克、细菌毒素等刺激造成的直接血管损伤,则可累及细静脉及毛细血管。因此,本研究采用在体视镜下显微分离肺小静脉和细小静脉的方法研究铁死亡与血管屏障功能的关系。
