生孢噬纤维菌β-葡萄糖苷酶的异源表达与酶学性质表征
2022-10-21赵鑫,费嵩禹,宋祥和,陈晓艺
赵 鑫, 费 嵩 禹, 宋 祥 和, 陈 晓 艺
(大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
β-葡萄糖苷酶(β-glucosidases),EC 3.2.1.21,是一种水解酶。1837年Liebig和Wohler首次在苦杏仁汁中发现,随后的研究证明它广泛分布于自然界,特别是在植物种子和微生物中普遍存在[1]。β-葡萄糖苷酶可以水解烷基-β-葡萄糖苷或芳香基-β-葡萄糖苷的非还原性末端的β-D-糖苷键,释放出葡萄糖和相应的配基[2-3]。目前已报道的β-葡萄糖苷酶通常还具有催化转糖基反应的功能[4]。β-葡萄糖苷酶根据结构不同进行分类,主要分布在糖苷水解酶GH1、3、5、9、30和116等6个家族[5],其中尤其以GH1和GH3两个家族比较常见。细菌来源的β-葡萄糖苷酶主要分布在GH1和GH3家族,大部分真菌来源的β-葡萄糖苷酶分布在GH3家族[6]。
β-葡萄糖苷酶广泛存在于各种动物、植物与微生物体内,能参与生物体的糖代谢,对维持生物体正常生理功能起着重要作用[2]。另外,因为β-葡萄糖苷酶能够将果、蔬、茶中的风味前体物质β-葡萄糖苷水解为萜烯醇类化合物以及芳香醇氧化物等香气物质[7],能增加酒类和果汁产品中的风味物质含量,能使杏仁、青梅果等食品脱苦[8],所以β-葡萄糖苷酶被广泛应用于食品和饮料加工行业。再者,在纤维素降解过程中,β-葡萄糖苷酶主要水解纤维二糖和可溶性纤维寡糖,将纤维素转化为可利用的葡萄糖,是关键限速酶[9]。在纤维素酶制剂中加入β-葡萄糖苷酶可以协同提高其他纤维素酶的水解效率。随着β-葡萄糖苷酶在生物技术领域中得到越来越多的应用,研究人员也在不断挖掘和开发新型β-葡萄糖苷酶,以满足工业化应用的需要。
生孢噬纤维菌是土壤中常见的好氧性纤维素分解细菌,可以在纤维素底物上吸附生长并快速滑动[10-12],对纤维素有很强的降解能力。关于生孢噬纤维菌降解纤维素的机理还没有被阐明[13],也从未报道过来源于生孢噬纤维菌的β-葡萄糖苷酶。本实验室分离保存了一株生孢噬纤维菌,命名为CX11。为研究生孢噬纤维菌来源的β-葡萄糖苷酶的催化效率和酶学性质,本实验将4个β-葡萄糖苷酶基因分别在大肠杆菌中进行了异源表达,并对重组蛋白进行纯化及酶学性质表征,构建生孢噬纤维菌的β-葡萄糖苷酶库,以期为挖掘新型β-葡萄糖苷酶及其功能应用奠定基础。
1 材料与方法
1.1 材 料
生孢噬纤维菌Sporocytophagasp. CX11,大连工业大学微生物资源与生物催化实验室保藏。大肠杆菌EscherichiacoliDH5α,大连宝生物有限公司;大肠杆菌EscherichiacoliBL21(DE3)、质粒pET-28a(+)均获赠于大连化学物理研究所赵宗保研究员课题组。
葡萄糖液体培养基:葡萄糖0.5%,NaNO30.05%,MgSO4·7H2O 0.05%,KCl 0.05%,K2HPO4·3H2O 0.1%,FeSO4·3H2O 0.001%。纤维二糖液体培养基:纤维二糖0.5%,NaNO30.05%,MgSO4·7H2O 0.05%,KCl 0.05%,K2HPO4·3H2O 0.1%,FeSO4·3H2O 0.001%。LB液体培养基:蛋白胨1%,酵母浸粉0.5%,NaCl 1%,pH调至7.0。LB固体培养基:蛋白胨1%,酵母浸粉0.5%,NaCl 1%,pH 7.0,琼脂粉1.5%。LB低盐液体发酵培养基:蛋白胨1%,酵母浸粉0.5%,NaCl 0.5%,pH 7.0。
1.2 方 法
1.2.1 引物设计
实验中所用到的克隆及荧光定量PCR引物均由Primer 5软件设计,并由上海生工生物有限公司合成,如表1所示。
1.2.2 β-葡萄糖苷酶基因的克隆
以CX11基因组为模板进行扩增。反应体系:模板12 μL,10 μmol/L引物8 μL,Prime STAR酶2 μL,5×PS Buffer 40 μL,dNTPmix16 μL,200 μL体系。反应条件:95 ℃ 5 min,94 ℃ 30 s,延伸时间45 s,退火温度72 ℃,30个循环,72 ℃ 10 min,4 ℃结束反应。将PCR产物进行1%琼脂糖凝胶电泳,试剂盒回收目的基因片段。

表1 所用引物Tab.1 Primers used in the experiment
1.2.2 β-葡萄糖苷酶表达载体的构建
利用RF-clone策略构建重组表达载体,以扩增出来的β-葡萄糖苷酶基因片段为引物,采用RF克隆技术将目的片段克隆至pET28a载体上。反应体系:模板pET28a质粒1 μL;引物3 μL,模板与引物比例100∶280;Prime STAR酶0.25 μL;5×PS Buffer 5 μL;dNTPmix2 μL;无菌水补充体系到25 μL。为降解DNA甲基化的母本质粒,将RF Ⅱ产物进行消化,1.5 μL DpnⅠ消化酶加入8.5 μL RF Ⅱ产物,置于37 ℃消化10 h以上,随后将消化产物电击转化至感受态细胞DH5α中,并涂布于30 μg/mL卡那霉素的LB平板上。挑选阳性克隆并提质粒进行双酶切验证。
1.2.3 β-葡萄糖苷酶的表达与纯化
将表达质粒热激转化至BL21(DE3)感受态细胞中,挑取转化子进行菌落PCR鉴定,正确的转化子进行目的蛋白表达。将转化子接种于10 mL 带有Kan抗性的LB液体培养基中,放入摇床中37 ℃、200 r/min培养12 h。按照1∶50的接种量将种子液接种于LB低盐液体发酵培养基中,37 ℃、200 r/min培养至OD600在0.6~0.8,向菌液中加入终浓度1.0 mmol/L IPTG,16 ℃、200 r/min诱导16~20 h。用适量的Native Binding Buffer重悬菌体并采用超声破碎细胞得到粗酶液。利用Ni-NTA填料进行纯化,将粗酶液浓缩上样,在4 ℃结合1 h,Binding Buffer洗脱未结合的蛋白,30 mmol/L咪唑Washing buffer洗脱杂蛋白;250 mmol/L咪唑Elution buffer洗脱目的蛋白并收集。蛋白质样品采用SDS-PAGE进行成分分析。
1.2.4 β-葡萄糖苷酶的酶活测定
体系:250 μL 1.25 mmol/L对硝基苯基-β-D-吡喃葡萄糖苷(pNPG)和250 μL 酶液在45 ℃反应30 min,立即加入1 mL 1 mol/L Na2CO3终止反应,以灭活蛋白作空白对照,每组设置3个平行样。在405 nm处检测吸光度,根据pNP标准曲线计算pNP的生成量,进而计算酶活力。
酶活力单位定义:在pH 7.5、45 ℃条件下,每分钟水解pNPG释放出1 μmolpNP所需要的酶量为1 U。
1.2.5 β-葡萄糖苷酶的最适反应温度测定
250 μLpNPG与250 μL酶液混合,分别置于不同温度下(温度范围25~80 ℃,间隔5 ℃)反应30 min,加入1 mL 1 mol/L Na2CO3终止反应,以灭活酶液为空白对照,每组设置3个平行样。测量波长405 nm处的吸光度,计算酶活力。
1.2.6 β-葡萄糖苷酶的最适反应pH测定
配制不同pH的缓冲液,柠檬酸-柠檬酸钠体系,pH 4.0、4.5、5.0、5.5、6.0;NaH2PO4-Na2HPO4(PB)体系,pH 6.0、6.5、7.0、7.5、8.0;NaH2PO4-K2HPO4体系,pH 8.0、8.5、9.0。
用不同pH的缓冲液将酶液稀释20倍,取250 μL加入等体积底物,在最适温度下反应30 min,加入1 mL 1 mol/L的Na2CO3终止反应,以灭活酶液为空白对照,每组设置3个平行样。测量波长405 nm处的吸光度,计算酶活力。
1.2.7 生孢噬纤维菌总RNA的提取
将固体培养基上生长的生孢噬纤维菌CX11接种至10 mL葡萄糖或纤维二糖液体培养基。种子液以1∶50接种量分别接种至葡萄糖或纤维二糖液体发酵培养基中,30 ℃、200 r/min培养,收集菌体。采用SteadyPure通用型RNA提取试剂盒对生孢噬纤维菌CX11总RNA进行提取。
1.2.8 反转录反应
对提取的RNA进行反转录,反转录体系:RNA 200 ng;TransScript 酶混合物1 μL,5×TransScript Buffer 4 μL,Randommers 1 μL,RNase free水补充体系至20 μL。反转录条件:37 ℃ 15 min,85 ℃ 5 s。
1.2.9 实时荧光定量PCR
反应体系:TB GreenPremixExTaq GC(2倍)终浓度1倍;PCR引物(10 μmol/L)终浓度0.2 μmol/L;RNA模板100 ng;无菌水补充体系至20 μL。
2 结果与讨论
2.1 生孢噬纤维菌β-葡萄糖苷酶的系统发育分析
根据全基因组测序的注释结果,生孢噬纤维菌CX11基因组中共有4个基因被明确注释为β-葡萄糖苷酶,分别命名为Sm_0268、Sm_0864、Sm_3000 和Sm_5379。对它们进行系统发育分析,结果如图1所示。4个β-葡萄糖苷酶均为GH3家族的蛋白质,其中Sm_0268、Sm_3000和Sm_5379的二级结构较为相似,而Sm_0864只具有GH3催化结构域,不具有信号肽以及FnⅢ结构域。从系统发育树上可以看出,Sm_0864与其他3个蛋白的亲缘关系较远,而Sm_0268和Sm_5379 的亲缘关系相对较近,序列比对结果显示二者的序列相似性为40.2%。

图1 来源于生孢噬纤维菌CX11的β-葡萄糖苷酶的系统发育分析Fig.1 Phylogenetic analysis of the β-glucosidases from Sporocytophaga sp. CX11
2.2 β-葡萄糖苷酶基因的PCR扩增与重组表达载体的构建
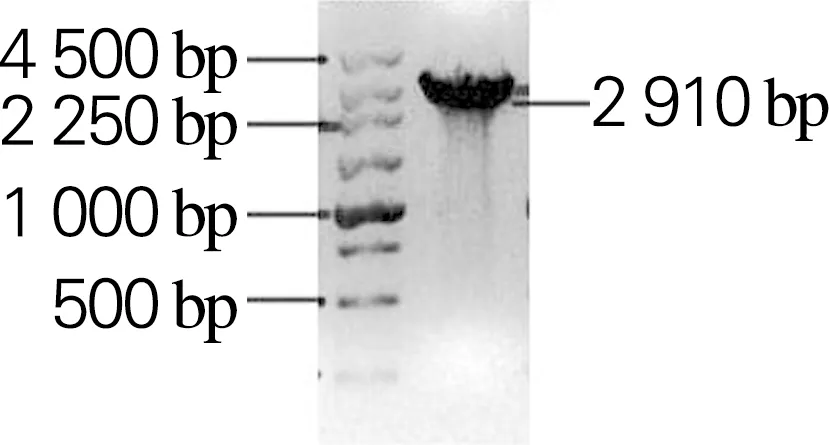
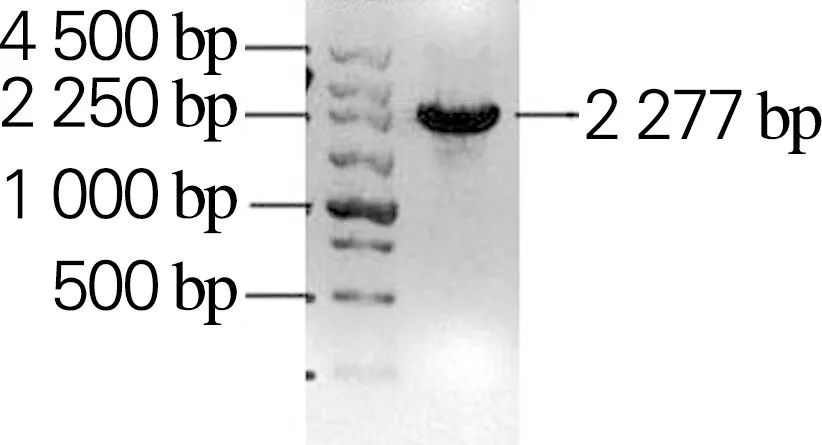
以生孢噬纤维菌CX11基因组为模板,分别扩增Sm_0268、Sm_0864、Sm_3000和Sm_5379基因,获得大小分别为2 172、2 910、2 277和2 199 bp的目的片段,与理论大小一致,如图2所示。利用RF克隆技术分别将扩增的基因片段与克隆载体pET28a(+)连接,构成重组表达载体Sm_0268-pET28a、Sm_0864-pET28a、Sm_3000-pET28a和Sm_5379-pET28a。将重组表达载体进行双酶切鉴定,如图3所示。将鉴定正确的重组表达载体送吉林库美有限公司测序,结果表明重组表达载体构建成功。
2.3 重组β-葡萄糖苷酶的异源表达与纯化
将重组表达载体Sm_0268-pET28a、Sm_0864-pET28a、Sm_3000-pET28a和Sm_5379-pET28a分别热激转化至表达菌株大肠杆菌BL21(DE3)中进行异源表达。利用Ni Sepharose 6 Fast Flow填料对重组蛋白进行纯化,SDS-PAGE如图4所示。4个β-葡萄糖苷酶在大肠杆菌BL21(DE3)中均为可溶性表达,经纯化后,杂蛋白可以有效去除,得到纯度高于90%的目的蛋白,其分子大小与理论值一致。
2.4 重组β-葡萄糖苷酶的酶学性质表征
按“1.2.4”方法,对重组蛋白进行酶活力测定,Sm_0268、Sm_0864、Sm_3000和Sm_5379的酶活力分别为(24.2±0.4) U/g、(125.9±0.6) U/g、(32.4±0.6) U/g和(76.1±0.5) U/g。已报道的β-葡萄糖苷酶活力差异较大,如来源于真菌Actinomaduraamylolytica的AaBGL2酶活力为(1.3±0.1) U/mg[14]。来源于Bacillussp. CGMCC 1.16541的BsBgl1A酶活力为(11±1) U/mg[15]。本实验得到的生孢噬纤维菌CX11的这4个β-葡萄糖苷酶活力偏低,后续可以通过工程化改造提高其催化活性。

(a) Sm_0268
(b) Sm_0864
(c) Sm_3000

(d) Sm_5379图2 PCR扩增基因胶回收片段的琼脂糖凝胶电泳Fig.2 Agarose gel electrophoresis results of recovery fragment of genes amplified by PCR
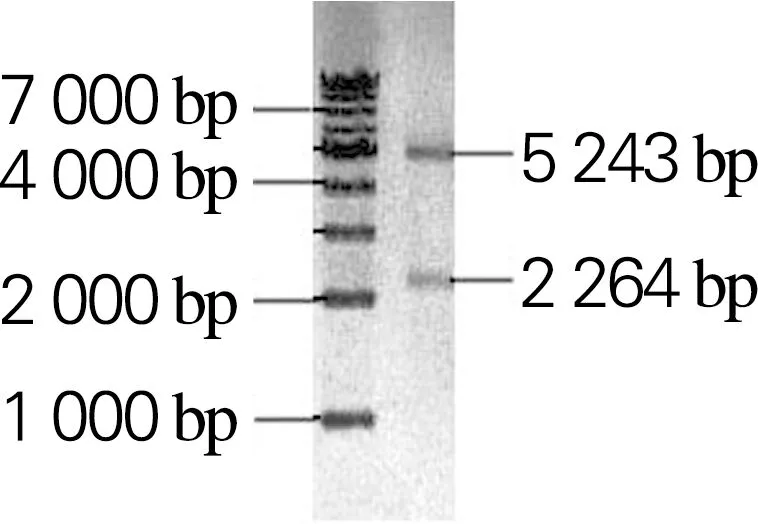
(a) Sm_0268-pET28a

(b) Sm_0864-pET28a
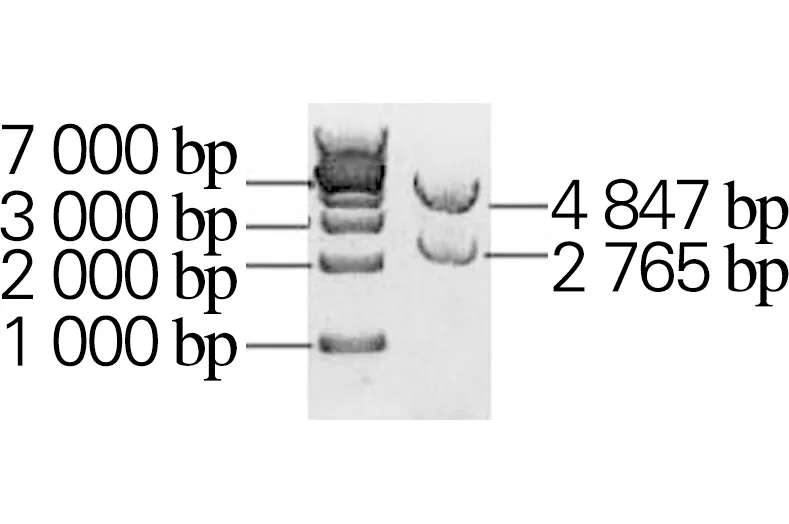
(c) Sm_3000-pET28a
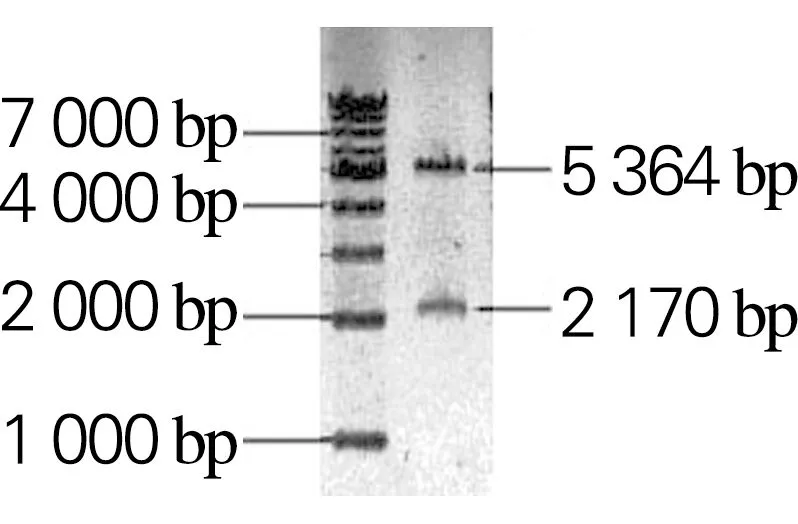
(d) Sm_5379-pET28a图3 重组表达载体双酶切产物的1%琼脂糖凝胶电泳Fig.3 Agarose gel (1%) electrophoresis results of double digestion product of recombinant expression vector
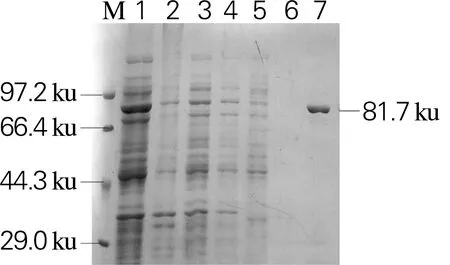
1,细胞破碎上清;2,细胞破碎沉淀;3,穿刺液;4,未结合的蛋白;5,杂蛋白;6,空白对照;7,目的蛋白 (a)Sm_0268
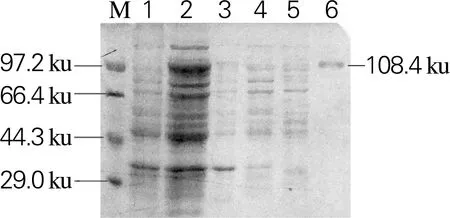
1.pET28a空载;2,细胞破碎上清;3,细胞破碎沉淀;4,未结合的蛋白;5,杂蛋白;6,目的蛋白 (b)Sm_0864
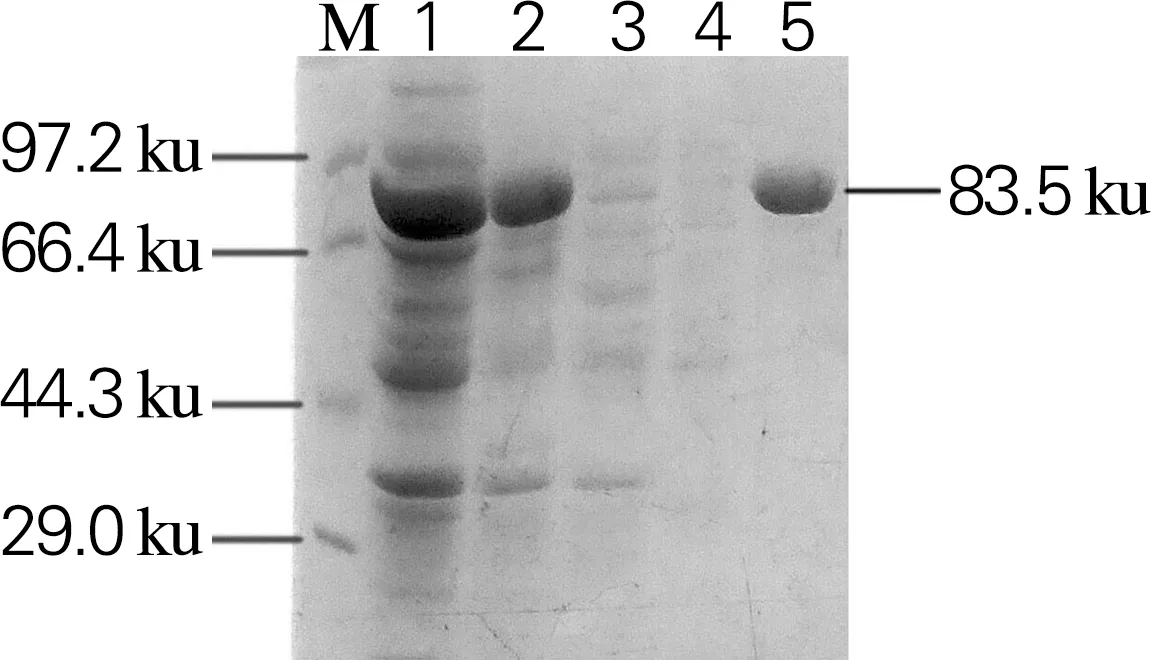
1,细胞破碎上清;2,细胞破碎沉淀;3,未结合的蛋白;4,杂蛋白;5,目的蛋白(c)Sm_3000
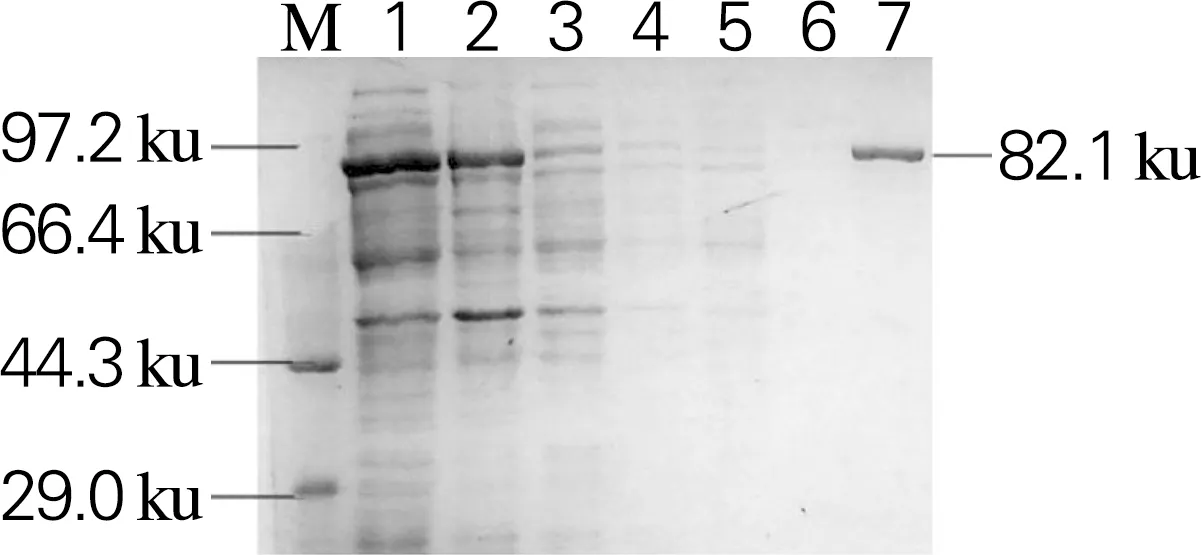
1,细胞破碎上清;2,细胞破碎沉淀;3,穿刺液;4,未结合的蛋白;5,杂蛋白;6,空白对照;7,目的蛋白(d)Sm_5379
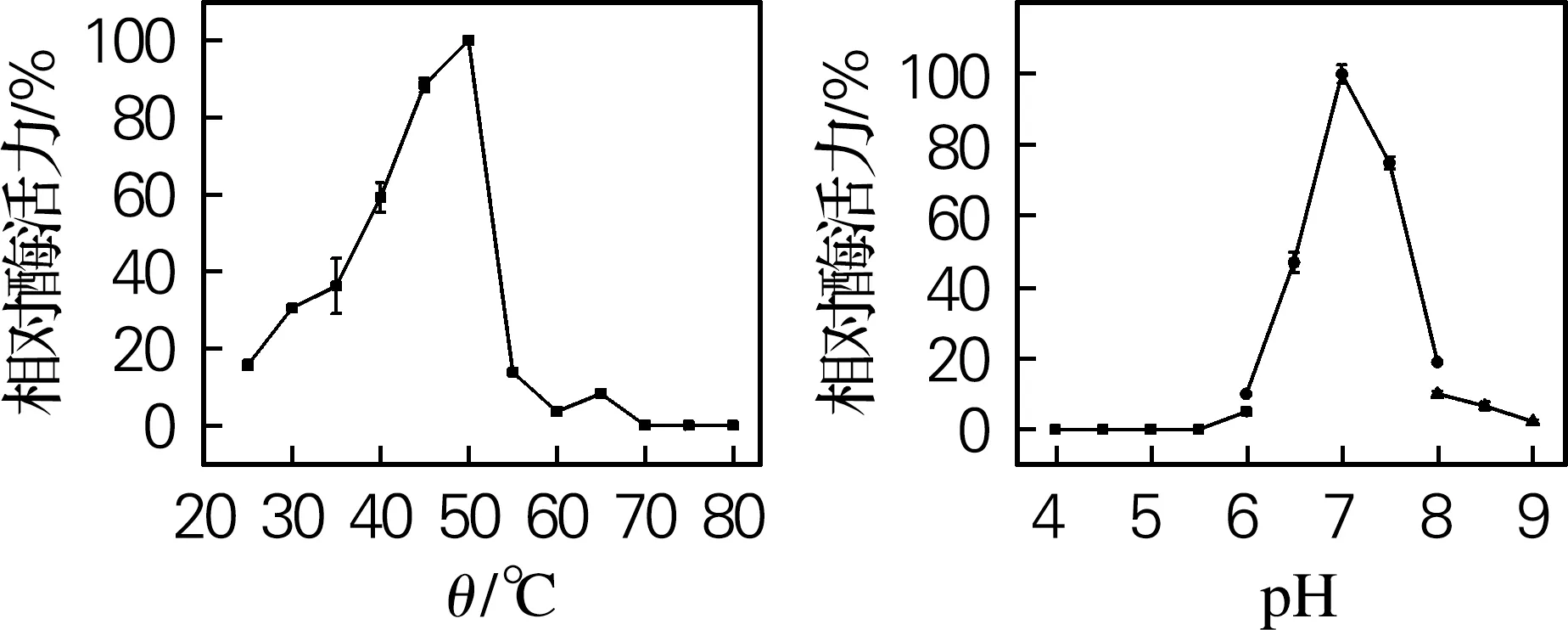
对4个β-葡萄糖苷酶进行最适反应温度和pH测定,结果如图5所示。Sm_0268、Sm_3000和Sm_5379的最适反应温度为50 ℃,Sm_864的最适反应温度为45 ℃,与许多细菌来源的β-葡萄糖苷酶一致[16-17]。当温度高于50 ℃时,Sm_0268、Sm_0864和Sm_5379的酶活力迅速下降,而Sm_3000在温度达到60 ℃时仍能保留40%以上的活性,具有一定的高温催化能力。
Sm_0268、Sm_0864和Sm_3000的最适反应pH均为7.5,而Sm_5379的最适反应pH为7.0。其中,Sm_0864和Sm_3000具有一定的碱耐受性,当反应pH升高到9时,Sm_3000的酶活力约为最大酶活力的50%。而当pH大于8或小于6时,Sm_0268和Sm_5379几乎完全失去催化活性。目前已有文献报道的β-葡萄糖苷酶最适反应pH一般都在4.5~6.0[18-19],而本实验中所研究的4个β-葡萄糖苷酶均在略偏碱性条件下表现出最高催化活力,在废纸脱墨、棉织品生物整理等领域具有很好的应用潜力[20-22]。
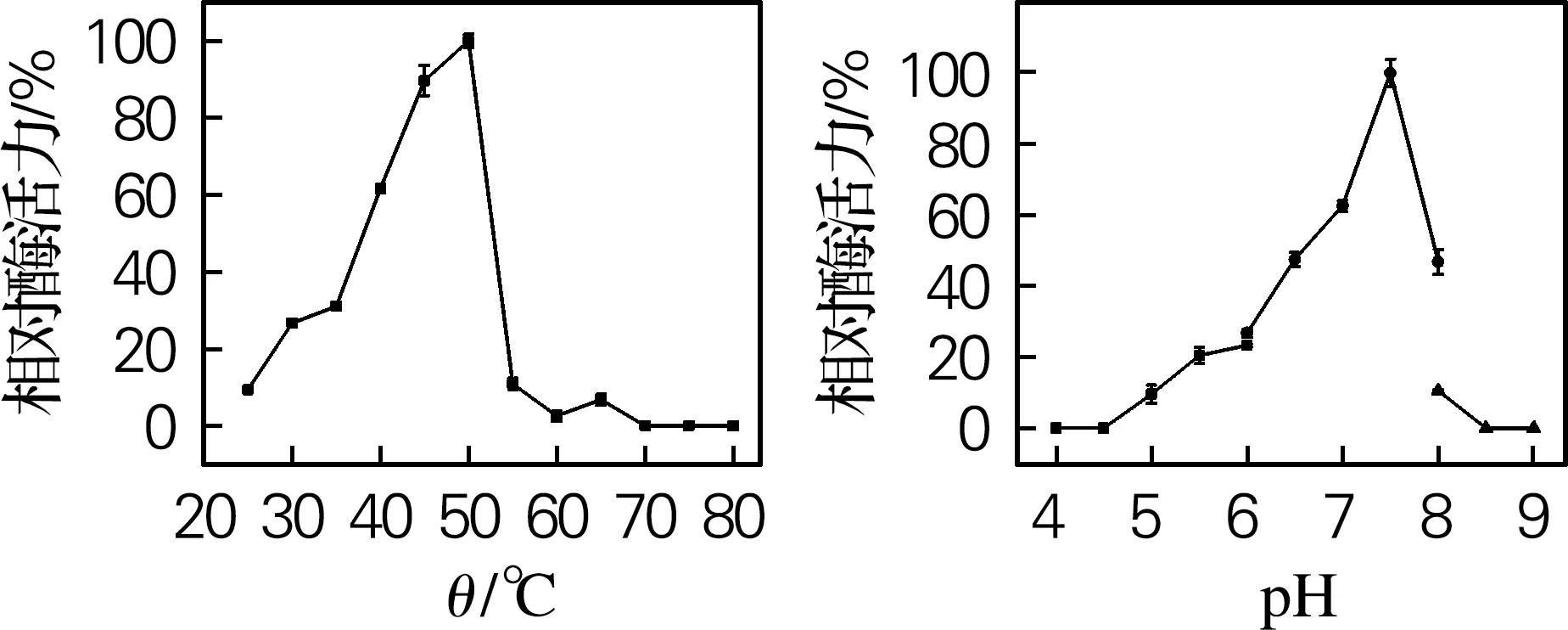
(a) Sm_0268
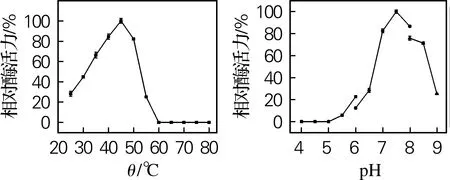
(b) Sm_0864
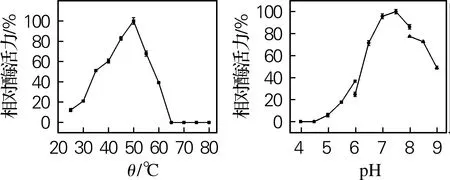
(c) Sm_3000
(d) Sm_5379
2.5 生孢噬纤维菌CX11中β-葡萄糖苷酶的表达水平分析
如图6所示,4个β-葡萄糖苷酶基因在纤维二糖培养基中的表达水平均显著高于其在葡萄糖基础培养基中的表达水平,其中Sm_3000在纤维二糖培养基中的表达水平是在葡萄糖培养基中表达水平的7.2倍,上调最为显著。纤维二糖是β-葡萄糖苷酶的直接作用底物,生孢噬纤维菌CX11在以纤维二糖为唯一碳源生长时,4个β-葡萄糖苷酶基因的表达水平较之在葡萄糖为碳源培养时均为上调,推测它们均不同程度参与了CX11降解纤维素的过程。后续可利用基因敲除和回补技术,筛选和验证在菌株降解纤维素过程中起关键作用的β-葡萄糖苷酶。
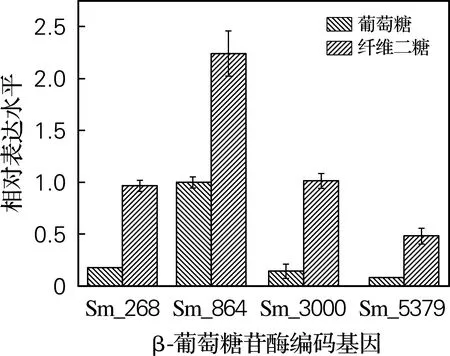
图6 生孢噬纤维菌CX11中β-葡萄糖苷酶基因 的相对表达量(q-RT PCR)Fig.6 Relative expression of the β-glucosidase gene fromSporocytophaga sp.CX11 (q-RT PCR)
3 结 论
本实验成功将来源于生孢噬纤维菌CX11的4个β-葡萄糖苷酶基因Sm_0268、Sm_0864、Sm_3000和Sm_5379在大肠杆菌中进行异源表达,纯化得到了4个电泳纯的重组蛋白,构建了CX11的β-葡萄糖苷酶库。对4个重组β-葡萄糖苷酶的酶活力及最适反应条件进行了测定,为进一步研究它们的酶学性质并进行工程化改造奠定了基础。其中,Sm_3000表现出一定的高温催化能力和碱耐受性,具有潜在的工业化应用价值。对4个β-葡萄糖苷酶基因在生孢噬纤维菌CX11中的相对表达水平进行了分析,结果表明它们均不同程度参与了CX11降解纤维素的过程。
