Rasal2在肺动脉平滑肌细胞增殖及迁移中的作用机制
2022-10-21王芳何思毅陈杰
王芳,何思毅,陈杰*
(西部战区总医院:1烧伤科,2心脏外科,成都610083)
肺动脉高压(pulmonary arterial hypertension,PAH)是一种病因多变、病理机制复杂、死亡率较高的综合征,发生机制包括异常的肺动脉收缩、肺血管重塑,从而引起肺动脉阻力增高、最终导致右心衰竭及终末死亡[1,2],而低氧是引起PAH的关键因素[3]。肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells, PASMCs)在生理状况下保持着增殖和凋亡的动态平衡。然而在慢性低氧刺激下,PASMCs增殖和迁移能力过度增强,造成血管狭窄甚至闭锁,最终导致PAH[4]。目前基于传统机制的药物仍不能完全有效地降低PAH的致死率、致残率,因此,探索新的调控PASMCs增殖、迁移的分子机制势在必行。
Ras家族蛋白在调控平滑肌细胞增殖和迁移中发挥重要作用[3,5]。Ras蛋白激活类似物2(Ras protein activator like 2, Rasal2)属于Ras GTP酶活化蛋白家族[6],最初被认为是一种抑制肿瘤的蛋白[7]。然而,近期研究发现Rasal2还可以促进多种肿瘤的生长[6,8]。此外,Rasal2还可以抑制肾癌组织的血管新生过程[9],提示其在血管生理病理中发挥潜在作用。然而,Rasal2在肺动脉高压中的作用目前尚不清楚。本研究利用缺氧条件干预细胞模型,探讨Rasal2是否能调控PASMCs增殖与迁移并探讨其可能的机制。本研究拓宽了肺动脉高压发病机制的研究思路,为肺动脉高压的防治提供新思路。
1 材料与方法
1.1 实验动物和主要材料
C57BL/6J小鼠购自成都达硕实验动物有限公司,共30只,8~10周龄,体质量22 g左右。小鼠饲养在12 h光暗交替、温度24 ℃的无特定病原体(specific pathogen free,SPF)级动物房中。小鼠肺动脉高压模型造模方法:低氧组的小鼠皮下注射SU5416,浓度20 mg/kg,每周注射1次;与此同时,小鼠饲养在恒温培养箱的低氧(10%氧气)环境中,饲养21 d。而常氧组的小鼠每周1次注射等量的溶剂。
SU5416(美国Sigma公司),DMEM细胞培养基(美国HyClone公司),10%胎牛血清(美国Invitrogen公司),雷帕霉素(中国皓元生物),siRasal2试剂(中国锐博生物公司), Lip2000(美国Invitrogen公司), 二脒基苯基吲哚(4′,6-diamidino-2-phenylindole, DAPI)胞核荧光染料(美国Roche公司),增殖细胞相关抗原(Ki-67)抗体(中国博奥森生物公司),Rasal2、p-S6Ser235/236、S6、p-4EBP1Thr37/46、4EBP1抗体(美国CST公司),甘油醛-3-磷酸脱氢酶(Gapdh)抗体(美国CST公司),siRasal2试剂(中国锐博生物公司),Transwell试剂盒(德国默克公司)。
1.2 方法
1.2.1 细胞分组及干预 从野生型小鼠的肺动脉中获得PASMCs,并分为6组:常氧对照组(常氧+siCon)、常氧转染组(常氧+siRasal2)、低氧对照组(低氧+siCon)、低氧转染组(低氧+siRasal2)、常氧干预组(常氧+siRasal2+胰岛素)、低氧干预组(低氧+siRasal2+胰岛素)。每组约1×106~2×106个细胞,待细胞长到40%左右时,予以siCon和siRasal2转染并培养24 h,其中,常氧组细胞在21%氧气环境中培养,低氧组细胞在3%氧气环境中培养。为进一步研究Rasal2通过mTOR蛋白复合体1(mammalian target of rapamycin complex 1, mTORC1)调控细胞增殖和迁移,同时加入胰岛素(5 mg/L)继续孵育24 h。
1.2.2 细胞siRasal2的转染 使用小干扰RNA(small interfering RNA, siRNA)沉默PASMCs中Rasal2的表达水平。在细胞生长至40%时,使用Lip2000与siRNA在细胞中共培养48 h。siRasal2序列是5′-CTGCATCAGATGCCATCTA-3′。
1.2.3 实时定量PCR 使用Trizol法提取总RNA,使用Bestar qPCR逆转录试剂盒逆转录cDNA,使用ABI Prism 7700完成实时定量PCR反应。引物:Rasal2(F: 5′-TGTTCTGTCCTTGAGCCAGT-3′; R: 5′-TCCACCTCAGACATCACCAA-3′);Gapdh(F: 5′-GAAGGTGAAGGTCGGAGTC-3′;R: 5′-GAAGATGGTGATGGGATTTC-3′)[10]。
1.2.4 CCK-8试验 细胞与10 μl CCK-8染色剂在37 ℃共培养2 h,使用分光光度计测量A450 nm,取其相对值表示细胞活力。
1.2.5 Ki-67免疫荧光染色 在6孔板中放入小玻片,倒入细胞悬液,按上述分组干预完成后倒掉培养液固定细胞,磷酸盐缓冲液(phosphate buffer saline, PBS)清洗3次,用0.3%~0.5% TritonX-100处理穿透15 min,PBS清洗3遍,血清室温封闭30 min。Ki-67抗体以1∶1 000在4℃湿盒孵育过夜,PBS清洗3遍,二抗室温暗室孵育1 h,PBS清洗3遍,DAPI复染核,使用荧光显微镜拍片,Ki-67染色呈绿色,DAPI染色呈蓝色,计算Ki-67阳性细胞率。
1.2.6 Transwell实验 将上述分组的各组PASMCs接种在8 μm孔的transwell上层小室中,小室置于含无血清培养基的24孔板中,分别置于常氧和低氧环境中继续孵育8 h。将未迁移的小室内膜一面细胞擦除,而留有迁移细胞的外膜使用多聚甲醛固定,并用PBS冲洗3次,之后将膜剪下置于玻璃片并使用1%结晶紫染液染色,迁移的细胞数目比例通过光镜进行图像采集和计算。
1.2.7 免疫印迹实验 提取各组小鼠肺动脉组织和PASMCs蛋白,通过8%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,将蛋白电转到聚偏二氟乙烯膜上。5%胎牛血清封闭1 h,使用相应一抗4 ℃过夜孵育。充分洗膜后,常温下二抗孵育1 h。继续洗膜,通过化学发光液显色,并用凝胶图像分析系统对条带进行定量分析。
1.3 统计学处理

2 结 果
2.1 Rasal2蛋白在慢性低氧小鼠肺动脉组织和缺氧处理的PASMCs中的表达水平变化
为探索Rasal2在肺动脉高压中的作用,我们利用慢性低氧小鼠构建肺动脉高压模型,发现与常氧组小鼠相比,慢性低氧组小鼠肺动脉组织中Rasal2mRNA[(2.57±0.15)和(1.02±0.09),P<0.001;图1A]和蛋白[(2.18±0.36)和(0.97±0.14),P<0.001;图1B]水平明显增高。缺氧所致的PASMCs异常增殖和迁移在PAH中发挥重要作用,我们也检测了Rasal2在缺氧处理PASMCs中的表达变化,发现与常氧组相比,低氧处理12 h与24 h的mRNA[(2.41±0.20),(2.86±0.24)和(1.03±0.12),P<0.001;图1C]和蛋白表达明显升高[(2.50±0.32),(2.79±0.38)和(1.13±0.1),P<0.01;图1D]。
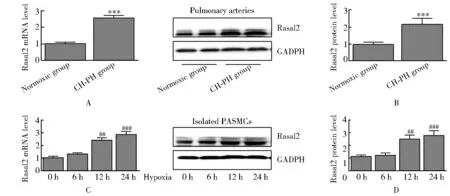
图1 各组Rasal2 mRNA与蛋白表达情况比较Figure 1 mRNA and protein expression of Rasal2 in different groupsCompared with Normoxic group, ***P<0.001; compared with 0 h group, ##P<0.01, ###P<0.001. CH-PH: chronic hypoxia-pulmonary hypertension; PASMCs: pulmonary arterial smooth muscle cells.
2.2 Rasal2沉默对低氧所致PASMCs增殖的影响
我们利用Rasal2 siRNA(siRasal2)沉默Rasal2的表达。转染siRasal2后,Rasal2表达明显下降[(1.09±0.09)和(0.33±0.04),P<0.001,图2]。与常氧组相比,低氧组Ki-67阳性细胞百分比明显升高[(62.75±7.54)%和(13.90±2.35)%,P<0.001];在低氧处理的PASMCs中,转染siRasal2后Ki-67阳性细胞百分比显著下降[(19.25±5.34)%和(62.75±7.54)%,P<0.001;图3]。
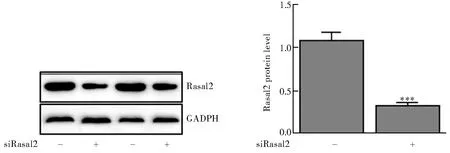
图2 各组Rasal2表达情况比较Figure 2 Rasal2 protein expression in different groupsCompared with siCon group,***P<0.001. siRasal2: Rasal2 siRNA; siCon: control siRNA.

图3 各组PASMCs Ki-67免疫荧光染色比较Figure 3 Immunofluorescence staining of Ki-67 in different groups (×400)Compared with Normoxic+siCon group,***P<0.001; compared with Hypoxic+siCon group, ###P<0.001. PASMCs: pulmonary arterial smooth muscle cells; siRasal2: Rasal2 siRNA; siCon: control siRNA; DAPI: 4′,6-diamidino-2-phenylindole.
2.3 沉默Rasal2对低氧所致PASMCs迁移的影响
我们利用transwell实验评估PASMCs迁移能力。与常氧组相比,低氧组迁移细胞百分比明显升高[(305.25±58.28)%和(88.90±13.67)%,P<0.05];在低氧处理的PASMCs中,转染siRasal2后迁移细胞百分比显著下降[(115.25±19.00)%和(305.25±58.28)%,P<0.05;图4]。
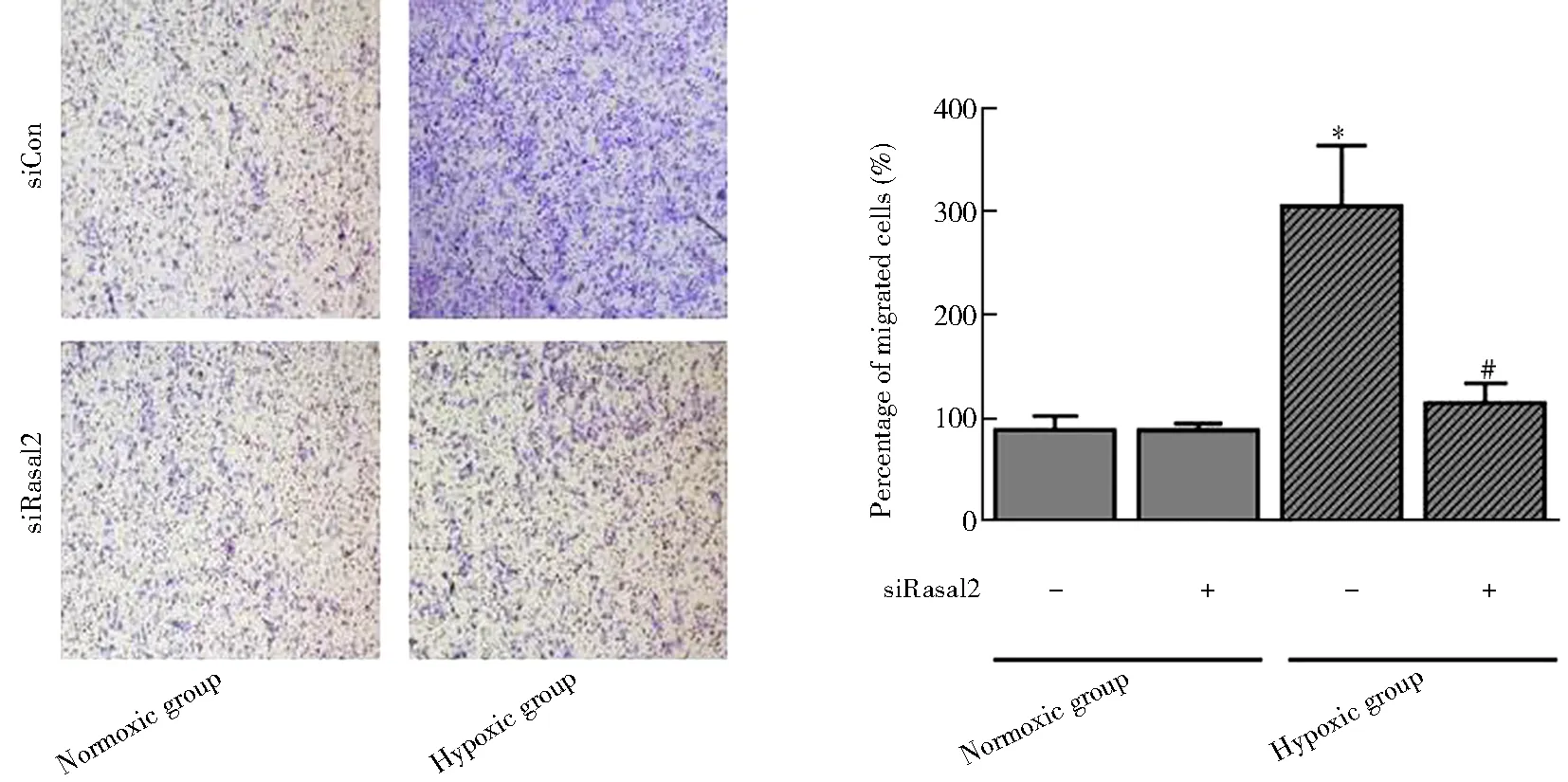
图4 各组PASMCs Transwell分析Figure 4 Transwell assay of PASMCs in different groups (×100)Compared with Normoxic+siCon group,*P<0.05; compared with Hypoxic+siCon group, #P<0.05. PASMCs: pulmonary arterial smooth muscle cells; siRasal2: Rasal2 siRNA; siCon: control siRNA.
2.4 沉默Rasal2对PASMCs中mTORC1下游效应蛋白表达的影响
mTORC1可被Ras蛋白激活,从而通过下游效应分子S6和4EBP1诱导SMC增殖、迁移[11,12]。我们发现与常氧组相比,低氧组PASMCs中S6、4EBP1磷酸化水平明显增强[(3.27±0.24)和(1.06±0.14),(2.95±0.15)和(1.07±0.06),均P<0.001];在低氧处理的PASMCs中,转染siRasal2后S6、4EBP1磷酸化水平显著减弱[(1.90±0.06)和(3.27±0.24),(1.70±0.13)和(2.95±0.15),均P<0.001;图5]。

图5 各组mTORC1下游通路蛋白表达情况Figure 5 Expression of mTORC1-associated proteins in different groupsCompared with Normoxic+siCon group, ***P<0.001; compared with Hypoxic+siCon group, ###P<0.001. mTORC1: mammalian target of rapamycin complex 1; siRasal2: Rasal2 siRNA; siCon: control siRNA.
2.5 恢复mTORC1活性对PASMCs增殖的影响
我们利用胰岛素处理细胞恢复mTORC1活性从而探索其在Rasal2调控PASMCs功能中的作用。沉默了Rasal2表达的基础上,使用胰岛素恢复mTORC1活性后S6[(0.94±0.16)和(0.36±0.11),P<0.01;图6]、4EBP1[(0.99±0.09)和(0.61±0.03),P<0.01;图6]磷酸化水平显著回升、细胞活力明显升高[(1.24±0.06)和(1.61±0.10),P<0.001;图7A]、Ki-67阳性细胞百分比增多[(61.25±3.10)%和(27.00±3.46)%,P<0.001;图7B]。

图6 各组mTORC1下游通路蛋白表达情况Figure 6 Expression of mTORC1-associated proteins in different groupsCompared with Vehicle+siCon group, **P<0.01; compared with Vehicle+siRasal2 group, ##P<0.01. mTORC1: mammalian target of rapamycin complex 1; siRasal2: Rasal2 siRNA; siCon: control siRNA.
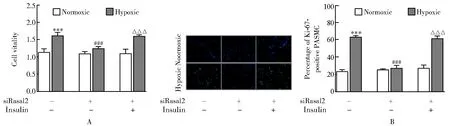
图7 各组PASMC CCK-8活性及Ki-67免疫荧光染色Figure 7 CCK-8 assay and immunofluorescence staining of Ki-67 in different groups (×400)Compared with Normoxic+siCon group, ***P<0.001; compared with Hypoxic+siCon group, ###P<0.001; compared with Hypoxic+siRasal2 group, △△△P<0.001. PASMCs: pulmonary arterial smooth muscle cells; siCon: control siRNA.
2.6 恢复mTORC1活性对PASMCs迁移的影响
为了探索mTORC1在Rasal2调控PASMCs迁移中的作用,我们利用胰岛素处理细胞恢复mTORC1活性。在沉默了Rasal2表达的基础上,使用胰岛素恢复mTORC1活性后迁移细胞百分比明显升高[(315.00±21.49)%和(141.00±15.30)%P<0.001];而在胰岛素恢复mTORC1活性的基础上,siRasal2对低氧所致PASMCs迁移的抑制作用消失了[(315.00±21.49)%和(111.25±16.09)%,P<0.001;图8]。

图8 各组PASMCs Transwell分析Figure 8 Transwell assay of PASMCs in different groups (×100)Compared with Normoxic+siCon group,***P<0.001; compared with Hypoxic+siCon group, ###P<0.001; compared with Hypoxic+siRasal2 group, △△△P<0.001. PASMCs: pulmonary arterial smooth muscle cells; siRasal2: Rasal2 siRNA; siCon: control siRNA.
3 讨 论
本研究旨在探索Rasal2在低氧所致PASMCs增殖和迁移中的作用机制研究,主要发现总结如下:(1)Rasal2蛋白表达水平在慢性低氧小鼠的肺动脉组织和低氧处理的PASMCs中均明显增高;(2)沉默Rasal2表达抑制低氧所致PASMCs过度增殖和迁移;(3)沉默Rasal2表达抑制低氧所致PASMCs中mTORC1过度活化,主要体现在下游效应分子S6和4EBP1的去磷酸化;(4)胰岛素恢复mTORC1活性后,Rasal2沉默对低氧所致PASMCs增殖和迁移的抑制作用消失。这些发现表明Rasal2可能成为防治PAH的新的关键靶分子。
Rasal2是属于RAS GTP酶活化蛋白家族的一员,参与调控细胞增殖、糖脂代谢活动等[7]。有文献报道Rasal2参与血管生理病理方面的调控,例如血管新生过程[9]。另有研究发现受Rasal2调控的包含撕裂元活化蛋白激酶在内的多种蛋白也在PAH发生发展中发挥重要作用[13]。我们当前研究也发现Rasal2在血管组织中表达丰富。然而,Rasal2在PAH中的作用鲜有研究。在PAH的发生发展中,PASMCs的表型转换作用十分关键,主要表现为过度的异常迁移和增殖。我们当前的研究中,使用低氧的条件刺激PASMCs,Rasal2的表达水平显著提升。低氧明显促进了PASMCs的增殖和迁移,而通过siRNA外源性沉默了Rasal2的表达后,低氧对增殖、迁移的促进效应消失了。本实验中Rasal2对PASMCs增殖、迁移的促进效应也与文献报道中对多种肿瘤细胞增殖、迁移的促进作用相似[6,8]。以上研究结果表明,Rasal2升高是低氧所致PASMCs异常增殖、迁移的分子机制之一。然而,Rasal2如何调控PASMCs的增殖和迁移尚不清楚。
mTORC1是一种丝氨酸/苏氨酸激酶,其可以调控包括增殖、生长、存活及迁移等多种生物过程[14,15]。既往研究已经明确mTORC1是PAH发生发展中的核心调控因子之一[16]。也有研究报道了mTORC1可诱导PASMCs表型转换,从而参与PAH发生发展。例如,慢性缺氧诱导mTOR和S6(mTORC1下游核心效应分子)磷酸化增强,并促进大鼠PASMCs增殖过程[17]。此外,另有研究报道mTOR信号参与血管内膜增生过程中的SMC迁移调控[18]。然而,mTORC1信号在PASMCs中是否受Rasal2调控并不清楚。在本研究中,我们同样发现低氧可以激活mTORC1信号,而沉默Rasal2表达后则显著抑制了mTORC1活性。因此,我们猜测mTORC1可能是Rasal2调控PASMCs增殖、迁移的重要分子机制。进一步研究发现,使用胰岛素恢复mTORC1活性后,siRasal2对PASMCs增殖、迁移的抑制作用消失了。该结果提示Rasal2调控的PASMCs表型转换是mTORC1依赖型的。
综上,本研究表明,Rasal2可能通过mTORC1途径加重肺血管重构。本研究尚有以下不足:一是mTORC1的机制在体外得到证实,但在体内是否能复制尚需进一步研究;二是Rasal2调节mTORC1活性的上游机制尚未明确。我们的发现也许能够为研发改善肺动脉高压患者的临床预后情况的药物提供借鉴和参考。
