盐胁迫下丛枝菌根真菌对疏叶骆驼刺幼苗生长和生理的影响
2022-10-21陈晓楠伊力努尔艾力高文礼马晓东
陈晓楠,伊力努尔·艾力,高文礼,马晓东
(新疆师范大学生命科学学院 / 新疆特殊环境物种保护与调控生物学实验室, 新疆 乌鲁木齐 830054)
疏叶骆驼刺(Alhagi sparsifolia)是塔里木河下游荒漠河岸林群落中的多年生优势草本植物[1]。该地区生态环境严酷,生态隐患堪忧[2],其下游地表水和地下水中盐分积累多,限制植物吸收养分,加剧土地荒漠化,使生态系统失衡,植被覆盖度及生物多样性减少[3]。土壤中高浓度的盐,破坏植物体内的渗透平衡,产生渗透胁迫、离子胁迫,对水分和营养物质吸收下降。与此同时,植物细胞产生大量的活性氧(reactive oxygen species, ROS),导致膜系统因过氧化而受损,影响植物的正常生理代谢过程[4]。根系是盐胁迫下植物受影响最直接的器官,在植物生长胁迫反应中具有重要作用,盐胁迫会诱导根部的脱落酸(abscisic acid, ABA)合成系统启动,导致根部的生长素(indole acetic acid, IAA)、赤霉素(gibberellic acid, GA)水平下降,从而改变植物的根形态和生理特征,并直接影响到植物的正常生长[5-6]。
植物与丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)共生可有效缓解土壤盐化并促进植物生存[7]。AMF 可以与绝大多数陆生植物共生,与植物根系形成互惠共生体。AMF 成功侵染宿主植物根系后不仅通过根系吸收水分和养分,还可以通过根外菌丝扩大在土壤中的吸收空间[8],增加对土壤养分的吸收,依据互利共生法则,植物也将多达20%的光合产物供给AMF 生长繁殖。AMF 广泛存在于盐渍土根际周围,根外菌丝不但可以扩大植物根系吸收面积,还可以帮助宿主植物改善养分吸收状况,提高水分利用率、维持渗透平衡和激活抗氧化防御系统等[9-10]。AMF 能够加强植物对干旱、盐碱及重金属毒害等多种逆境胁迫的耐受性,修复生态系统。
疏叶骆驼刺不仅是塔里木河下游抗逆性极强的豆科植物,也是重要的菌根共生植物。杨玉海等[11]发现,AMF 对疏叶骆驼刺的侵染率高达92%,侵染强度大于30%,在其根部观察到丛枝、泡囊、孢子等典型菌根结构。疏叶骆驼刺从种子萌发到幼苗发育阶段能否被AMF 侵染并抵御外界胁迫,这一形态建成阶段对幼苗生长十分关键。盐离子的积累会引起干旱胁迫及渗透反应,植物做出生理反应释放根部激素信号促进渗透调节物质的产生及提高抗氧化酶活性。近年来,对疏叶骆驼刺的研究成果主要集中在种子萌发的影响因素[12]、生长条件、功能性状、生物固氮[13-14]等方面,目前关于盐胁迫下接种AMF 对疏叶骆驼刺幼苗生理研究的报道较少,其中内源激素的研究更是鲜有报道。本研究以塔里木河下游优势物种疏叶骆驼刺幼苗为试验材料,研究盐胁迫下接种AMF 对疏叶骆驼刺幼苗光合生长、抗氧化物酶活性、渗透调节物质含量及激素水平的影响,探索AMF 作用下这些生理指标和激素含量变化与疏叶骆驼刺幼苗耐盐性的关系,阐明丛枝菌根真菌对疏叶骆驼刺幼苗耐受盐胁迫的生理作用。
1 材料与方法
1.1 试验材料
供试疏叶骆驼刺种子于2020 年8 月采自塔里木河下游英苏断面天然植被恢复示范区(40°25.918′N, 87°56.458′ E),4 ℃冰箱保存。播种前,供试种子均先用砂纸打磨解除种子休眠后,再用75%酒精消毒10 min,最后无菌水清洗干净后用滤纸吸干水分备用。试验用的AMF 是比例为1 ∶ 1 幼套近明球囊霉(Claroideoglomus etunicatum)和摩西斗管囊霉(Funneliformis mosseae)的混合菌剂,孢子、菌丝和浸染的根段混合物作为接种剂,孢子数为14~20个·g-1(购买自北京农林科学院植物营养与资源研究所)。栽培使用混合基质,将河沙过2 mm筛去除杂质后,按河沙和蛭石体积1 ∶ 1 比例混合均匀后,经110 ℃、0.14 Mpa 下连续高压蒸汽灭菌2 h 后备用。混合前测定供试河沙有机质含量为1.18 g·kg-1,全氮含量为0.073 g·kg-1,全磷含量为0.505 g·kg-1,全钾含量为22.9 g·kg-1,水解性氮含量为12 mg·kg-1,有效磷含量为2.44 mg·kg-1,有效钾含量为82.3 mg·kg-1,pH 8.69。
1.2 试验设计
试验共设4 个处理,分别为:1)对照组(CK),即非盐胁迫与不接种AMF 处理。2)盐胁迫组(S),即盐胁迫与不接种AMF 处理。3)接种AMF 组(A),即非盐胁迫与接种AMF 处理。4)盐胁迫与接种AMF组(SA),即盐胁迫与接种AMF 处理,每个处理设10 个重复。
试验于2021 年3 月至10 月进行。选取大小一致、颗粒饱满的疏叶骆驼刺种子播种在花盆中,待幼苗长至5 cm 左右开始移苗,移苗至用75%乙醇消毒处理的花盆中,每盆移3 株长势一致的疏叶骆驼刺幼苗。每个花盆中装入4 kg 混合基质,按照AMF 的接种方法[15]在距土壤表层10 cm 处均匀平铺20 g AMF 菌剂,对照组加入相同质量灭菌处理的混合基质。移苗后缓苗一个月进行盐胁迫处理,为避免出现盐休克现象,每隔3 d 分3 次加入氯化钠溶液,使氯化钠含量达到混合基质质量的0.6%。在极端干旱的塔里木河下游,土壤盐渍化是限制植被生长的主要因素之一,研究发现当土壤盐分在0.5%~0.8%时,多枝柽柳(Tamarix ramosissima)幼苗先出现叶片变黄的现象,后期随着盐胁迫时间的增加出现死苗现象[16],胡杨(Populus euphratica)幼苗同样出现当土壤含盐量达到0.6%时,对幼苗生长具有显著的抑制作用,而当土壤含盐量高达到1.2%时,幼苗萎蔫停止生长[17]。本试验中设置盐分含量为0.6%时,与对照组相比疏叶骆驼刺幼苗的生长也受到明显抑制,其基径显著降低,叶片出现黄化、萎蔫等现象,但并不致死,说明已产生明显盐胁迫现象。盐胁迫70 d 后收获并测量指标,在整个试验期间,混合基质水分含量保持在田间持水量的70%。
1.3 测定指标及方法
1) 菌根侵染率:疏叶骆驼刺收获后,取部分新鲜植物根系,用自来水冲洗干净选取直径小于2 mm的根系剪成1 cm 左右的根段,进行固定、解离、酸化、染色等的步骤,用十字交叉法[11]测定根系菌根侵染率。
2) 菌根侵染强度:染色完成后随机选取10 条根段,完成制片,3 次重复,采用杨玉海等[11]的检测方法。
3) AMF 孢子分离与计数:从疏叶骆驼刺幼苗根系随机挑取20 g 土壤样品,用湿筛倾析法[15]计算孢子数量。
4) 疏叶骆驼刺幼苗表观生长指标:采用直接测量法,在收获前用卷尺测量幼苗株高,用游标卡尺测量幼苗基径。
5) 盐害指数测定:盐害分级的统计参照赵华等[4]的方法,在获取幼苗前3 d 测定。
6) 叶绿素荧光参数的测定:在盐胁迫后第15、30、45 和60 天分别测定荧光参数,使用Junior-Pam便携式调制叶绿素荧光仪在天气晴朗时每隔3 h测定09:00-18:00 光适应状态下疏叶骆驼刺幼苗叶片的叶绿素荧光反应,测定其初始荧光(Fo)、最大荧光(Fm)和最大光化学效率(Fv/Fm),测定时选取同一株幼苗自下而上不同叶片的不同位点进行数据采集,每个处理重复6 次。
7) 生理指标测定:超氧化物酶(superoxide dismutase, SOD)活性采用氮蓝四唑法测定;过氧化物酶(peroxisome, POD)活性采用愈创木酚法测定;过氧化氢酶(catalase, CAT)活性采用微量法测定;丙二醛(malondialdehyde, MDA)含量采用硫代巴比妥酸法测定;脯氨酸(proline, Pro)含量采用磺基水杨酸法测定;可溶性糖(soluble sugar, SS)采用蒽酮比色法测定。各生理指标检测均重复3 次测定。SOD、POD、CAT、MDA、Pro、SS 试剂盒均购于北京索莱宝科技有限公司。
8) 激素含量测定:激素测定采用酶联免疫吸附测定法(ELISA),各激素指标检测均重复3 次测量。独角金内酯(strigolactones, SLs)、IAA、GA、ABA 试剂盒均购买于酶联生物公司。
1.4 数据处理
用Excel 2010 整理相关数据,SPSS 21.0 软件的单因素方差分析法和Duncan 检验对接种和盐胁迫处理的数据计算平均值和标准误并进行多重比较,以P< 0.05 表示差异显著,用Origin 2019 作图。
2 结果与分析
2.1 盐胁迫下接种AMF 对疏叶骆驼刺幼苗菌根侵染情况及孢子数量的影响
接种AMF 的疏叶骆驼刺幼苗根系均能形成良好的菌根共生关系,而未接种AMF 组均未观察到菌根真菌的侵染(表1)。盐胁迫显著降低了疏叶骆驼刺幼苗根系的侵染率却显著提高了其侵染强度(P< 0.05),侵染率降低了25.36%,侵染强度却增加了1.58 倍。盐胁迫显著减少了孢子数量(P< 0.05)。

表1 盐胁迫下接种AMF 对疏叶骆驼刺幼苗根系侵染的影响Table 1 Effect of AMF inoculation on root infestation of Alhagi sparsifolia seedlings under salt stress
2.2 盐胁迫下接种AMF 对疏叶骆驼刺幼苗生长情况的影响
盐胁迫降低了疏叶骆驼刺幼苗的株高,接种AMF 可以显著促进疏叶骆驼刺幼苗株高的增长(P<0.05),接种AMF 组(A)株高为18.61 cm,盐胁迫组(S)株高为6.17 cm,盐胁迫下接种AMF 组(SA)株高为12.14 cm (图1)。对比CK 组,盐胁迫对疏叶骆驼刺幼苗基径的影响显著大于对株高的影响,盐胁迫显著降低了幼苗基径的增长(P< 0.05),与株高变化规律一致。可见,接种AMF 显著促进盐胁迫下疏叶骆驼刺幼苗的生长。
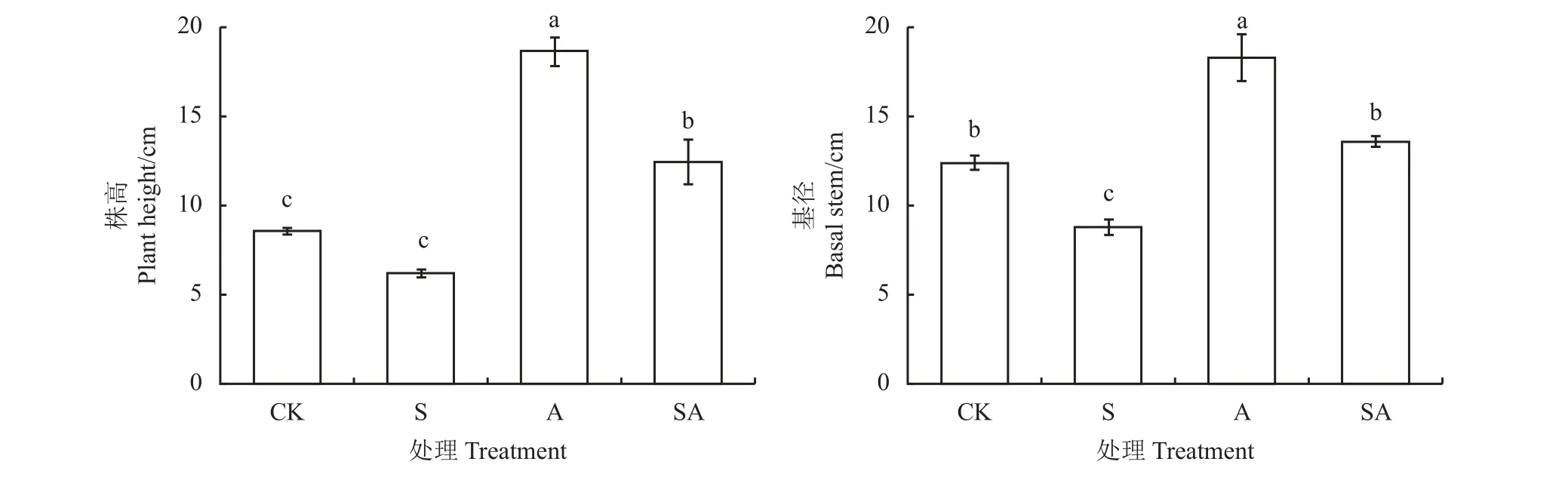
图1 盐胁迫下接种AMF 对疏叶骆驼刺幼苗生长的影响Figure 1 Effect of AMF inoculation on the growth of Alhagi sparsifolia seedlings under salt stress
2.3 盐胁迫下接种AMF 对疏叶骆驼刺幼苗盐害指数情况
盐胁迫组均出现疏叶骆驼刺幼苗叶片黄化、萎蔫,植株生长缓慢等现象,非盐胁迫组幼苗植株生长正常,无盐害症状。盐胁迫下接种AMF 组(SA)和盐胁迫组(S)的盐害指数分别为40.01%和68.89%,两者相差28.88% (图2)。可见,接种AMF可以较好地缓解盐离子对疏叶骆驼刺幼苗的毒害作用。

图2 盐胁迫下接种AMF 对疏叶骆驼刺幼苗盐害指数的影响Figure 2 Effect of AMF inoculation on the salt injury index of Alhagi sparsifolia seedlings under salt stress
2.4 盐胁迫下接种AMF 对疏叶骆驼刺幼苗叶绿素荧光参数的影响
叶绿素荧光参数可反映植物对光能利用的能力。盐胁迫下接种AMF 对疏叶骆驼刺幼苗Fo、Fm和Fv/Fm影响较大(表2),CK 组、盐胁迫组(S)和接种AMF 组(A)的Fo值无显著差异(P> 0.05),但盐胁迫下接种AMF 组(SA) Fo值显著大于其他3 组(P< 0.05);Fm值S 组显著小于CK 组、SA 组和A 组(P< 0.05);最大光化学效率(Fv/Fm)的数值CK 组和A 组显著大于S 组和SA 组(P< 0.05)。
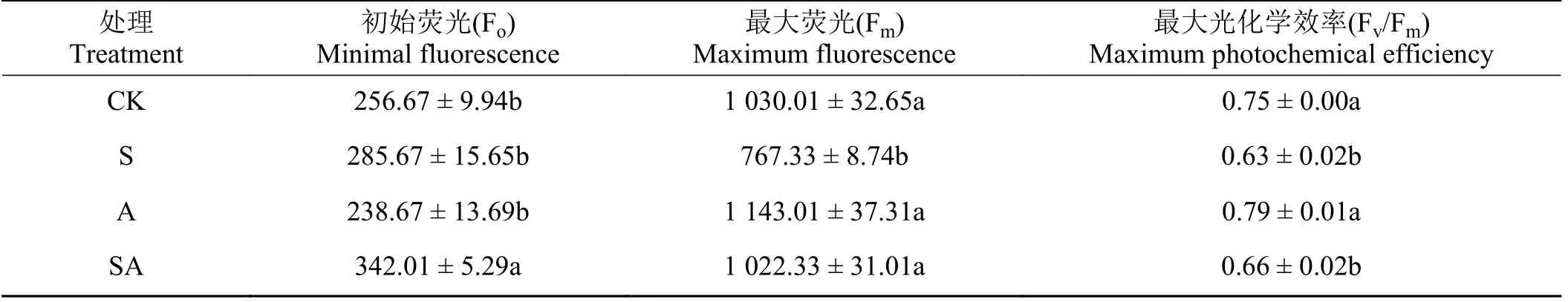
表2 盐胁迫下接种AMF 对疏叶骆驼刺幼苗叶绿素荧光参数的影响Table 2 Effect of AMF inoculation on chlorophyll fluorescence parameters of Alhagi sparsifolia under salt stress
2.5 盐胁迫下接种AMF 对疏叶骆驼刺幼苗抗氧化酶活性的影响
与CK 组相比,盐胁迫和接种AMF 均会影响SOD、POD 和CAT 酶的活性(图3)。盐胁迫下接种AMF 组(SA)的3 种抗氧化酶活性均显著高于其他组(P< 0.05)。SA 组SOD 酶 活 性 是 接 种AMF 组(A)的2.2 倍、盐胁迫组(S)的1.7 倍。接种AMF 可显著提高POD 和CAT 酶的活性,非盐胁迫下接种AMF 后POD 和CAT 酶的活性分别提高2.8 倍和1.6 倍,盐胁迫下接种AMF 后POD 和CAT 酶的活性分别提高1.5 倍和2.1 倍。

图3 盐胁迫下接种AMF 对疏叶骆驼刺幼苗抗氧化酶活性的影响Figure 3 Effect of AMF inoculation on the antioxidant enzyme activity of Alhagi sparsifolia seedlings under salt stress
2.6 盐胁迫下接种AMF 对疏叶骆驼刺幼苗渗透调节物质含量膜损伤程度的影响
接种AMF 组(A)、盐胁迫组(S)和盐胁迫下接种AMF 组(SA)脯氨酸含量分别比CK 组提高66.2、88.3、281.3 μg·g-1(图4)。疏叶骆驼刺幼苗可溶 性 糖 含 量 为4.03~5.15 mg·g-1,SA 组 可 溶 性 糖含 量 显 著 高 于 其 他3 组(P< 0.05)。MDA 是 反 映膜损伤程度的重要指标,S 组MDA 值最大,达到了214.07 nmoL·g-1,分 别 是CK 组 和A 组1.9 倍 和3.4 倍。
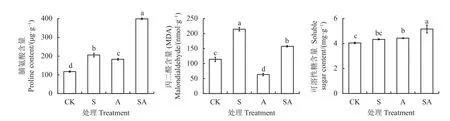
图4 盐胁迫下接种AMF 对疏叶骆驼刺幼苗渗透调节物质和膜损伤程度的影响Figure 4 Effect of AMF inoculation on osmoregulatory substances and degree of membrane damage in Alhagi sparsifolia seedlings under salt stress
2.7 盐胁迫下接种AMF 对疏叶骆驼刺幼苗激素含量的影响
植物激素作为信号分子在调控丛枝菌根形成过程中起到重要作用[18-19]。接种AMF 组独角金内酯含量均显著小于不接种组(P< 0.05) (图5)。生长素IAA含量在接种AMF 后达到最高,为880.52 U·g-1,比CK组高754.83 U·g-1,盐胁迫后接种AMF 生长素含量由328.89 U·g-1提高为618.69 U·g-1。赤霉素GA 的含量在CK 组显著高于盐胁迫组(S)、接种AMF 组(A)和盐胁迫下接种AMF 组(SA) (P< 0.05),非盐胁迫下接种AMF,赤霉素含量降低,而盐胁迫下接种AMF,赤霉素含量反而上升。脱落酸ABA 含量盐胁迫组显著高于非盐胁迫组(P< 0.05),CK 组与A 组相比无显著差异,SA 组脱落酸含量显著低于S 组。

图5 盐胁迫下接种AMF 对疏叶骆驼刺幼苗激素含量的影响Figure 5 Effect of AMF inoculation on the hormone contents of Alhagi sparsifolia seedlings under salt stress
3 讨论与结论
塔里木河下游荒漠河岸林植被结构简单、分布稀疏、物种贫乏且生长缓慢,致使其生态系统脆弱[20-21]。疏叶骆驼刺是荒漠河岸林中仅次于胡杨(Populus euphratica)、多枝柽柳(Tamarix ramosissima)的关键物种[22]。本研究中疏叶骆驼刺幼苗菌根侵染率可达84.24%,属于荒漠河岸林中侵染水平很高的植物之一[11],盐胁迫显著降低了菌根的侵染率,却使菌根侵染强度显著增加,表明盐胁迫危害了植物生长,但AMF 可帮助宿主植物增加入侵点、扩大生长范围,吸收更多的水分和营养物质缓解盐胁迫的危害。盐胁迫下AMF 的孢子数量显著低于非盐胁迫组,表明胁迫环境中AMF 将部分能量和资源用于储存和繁殖[7]。盐胁迫不仅影响AMF 的生长发育和繁殖,还导致宿主植物出现叶片黄化、萎蔫等现象。幼苗期是植物生长过程中的脆弱期,接种AMF 的幼苗受盐害症状减轻,说明AMF 可以提高疏叶骆驼刺幼苗的耐盐性。
叶绿素荧光是一种灵敏、无损的反映植物生理状态和胁迫特征的检测方法。正常环境中Fv/Fm的值介于0.7~0.8,当植物受到胁迫时Fm值降低,Fo值会升高,使Fv/Fm值降低,光合作用减弱[23]。本研究中,盐胁迫下接种AMF 使Fv/Fm值高于未接种组,说明盐胁迫虽然能显著降低了疏叶骆驼刺幼苗叶片的光合作用,但接种AMF 可有效缓解盐胁迫对幼苗光合作用的损伤,通过提高植物叶绿素含量,促进光合电子传递速率,减缓光系统Ⅱ反应中心所受的损害,提高了最大光化学效率,进而提高植物的光合作用,积累更多的有机物,从而提高植物的耐盐性[24]。同时,盐胁迫也能使植物启动抗氧化酶系统[25-26],本研究中接种AMF 可促进抗氧化酶活性的增加,这与很多的研究结果一致[27-29]。不同处理的疏叶骆驼刺幼苗SOD、POD 和CAT 含量有盐胁迫下接种AMF 组 > 盐胁迫组 > 接种AMF组 > CK 组的规律,说明盐胁迫下接种AMF 可更有效地清除特定的ROS,提高宿主植物的抗氧化能力。MDA 含量显著增加会严重损害植物的正常生长,AMF 会诱导宿主植物积累脯氨酸和可溶性糖等物质,维持细胞内环境稳态,进而调节抗氧化反应[7],减小外界环境对植物的损害。对比数据可知,接种AMF 显著提高可溶性糖含量和脯氨酸含量,抑制MDA 含量的升高,减轻细胞膜伤害,改善植物在盐胁迫下的稳定性。疏叶骆驼刺幼苗与AMF 早期共生,加强了植物体抗氧化酶和渗透调节两大系统的调节能力,提高了植物的耐盐性,为幼苗存活提供保障,这有利于塔里木河下游荒漠河岸林中疏叶骆驼刺种群的生长繁衍。
植物体内激素调节非常灵敏[5],本研究发现丛枝菌根真菌可以协助宿主植物积累内源激素独角金内酯SLs、生长素IAA、赤霉素GA 并减少脱落酸ABA。SLs 是近年发现的一种新型分枝调节激素,在AMF 侵染前,植物根系分泌出SLs 能刺激AMF孢子萌发和强烈分枝,以增加菌丝与宿主植物根系的接触机会[5,30-31]。本研究发现,盐胁迫显著降低SLs 的含量,未接种AMF 组疏叶骆驼刺幼苗SLs 含量高于接种组,AMF 成功侵染植物根系后,SLs 含量会下降,减少了对AMF 分枝的抑制,更好地侵染宿主植物。植物根系会积累大量IAA 和GA 以应对生物和非生物胁迫[4,32],盐胁迫不仅显著降低GA 的含量,还显著降低SLs 含量,但接种AMF 后GA 和IAA 含量显著增加。脱落酸ABA 是关键的非生物胁迫信号,研究结果表明,大豆(Glycine max)和玉米(Zea mays)[5,30]在形成丛枝菌根后其脱落酸含量显著增加,但具体机制不清,可能是源于宿主植物也可能源于AMF。本研究中,盐胁迫组ABA 含量显著高于其他对照组,盐胁迫下接种AMF,ABA 含量显著下降,这暗示了在盐胁迫下可通过接种AMF 降低宿主植物根系中ABA 的积累,促进植物生长。因此,疏叶骆驼刺幼苗接种AMF 后可通过积累IAA和GA,减小ABA 含量来有效应对盐胁迫。
综上所述,本研究阐明了AMF 可通过影响疏叶骆驼刺表观生长、光合生理、细胞内含物和激素水平有效增强幼苗的耐盐性,从而有利于幼苗渡过生长脆弱期。具体包括:1)盐胁迫下AMF 对幼苗的侵染率虽然有所降低,但AMF 侵染强度提高2 倍。2) AMF 侵染可显著促进幼苗在盐胁迫下的表观生长,提高最大光化学效率,降低盐害指数。3) AMF可使幼苗抗氧化物酶活性提高1~2 倍,并积累1 倍以上渗透调节物质含量,稳定细胞内环境,提高幼苗耐盐性。4)盐胁迫下,接种AMF 后可使幼苗的生长素和赤霉素含量显著升高,独角金内酯和脱落酸含量显著降低,以此来缓解盐胁迫对幼苗生长的不利影响。本研究仅从表观生长和部分生理指标探讨了接种AMF 对疏叶骆驼刺幼苗耐盐性的影响,今后还可进一步研究不同盐分或水分梯度下丛枝菌根真菌网络(AMN)对疏叶骆驼刺种内和种间关系的影响,解析塔里木河下游土壤环境中AMF 对关键植物种的作用,从而为该区域荒漠河岸林植被恢复提供科学依据。
