原花青素对β羟丁酸致牛子宫内膜细胞氧化损伤的保护作用
2022-10-21王竞晗
王竞晗
(山东省临沂市沂南县动物疫病预防控制中心,山东 临沂 276300)
0 引言
围产期的奶牛因为乳汁分泌和胎儿的发育,全身需要大量能量,但该时期的奶牛饮食减退,能量匮乏。为了补充能量,奶牛的脂肪开始消耗,这使得游离脂肪酸(NEFA)在体内产生,并在一定程度上与血液混合,发生高NEFA血症。肝内的NEFA是酮体的主要来源,主要成分β羟丁酸占78%,乙酰乙酸占20%,丙酮占2%。β羟丁酸是酮体的主要成分,可以对围产期奶牛的健康状况做及时的监测,避免出现能量负平衡、脂肪异常动员而出现的临床酮病或亚临床酮病。先前的研究已经广泛证明了血浆中的游离脂肪酸(NEFA)和β羟丁酸(BHBA)与临床酮症和移位性腹股沟等产后疾病的发病率之间存在密切的关联。因此研究高NEFA血症与高BHBA状态对肝脏细胞的应激响应和致死效果,分析NEFA和BHBA使肝脏细胞死亡的信号通路的机理,对临床酮症的发病原因和治疗方案有借鉴意义。
临床酮症发病时,奶牛的发情时间推后,胚胎成型时间变长,胚胎成活率明显下降,严重影响奶牛的繁殖效果。而β羟丁酸是引发奶牛酮病的主要致病成分之一,约占NEFA的78%,β羟丁酸在血浆中过多会导致奶牛身体细胞氧化凋亡,如果发生大量损害,则影响奶牛的身体正常运转。这种生理适应性的挑战在现代高价值繁殖奶牛中加剧,并且由于营养和环境条件的差异而变得复杂。
所用的牛子宫内膜细胞(BEND)在体外培育,分组加入BHBA和PC,研究牛子宫内膜细胞受BHBA的氧化作用,分析原花青素保护其免受氧化的作用机理,对临床酮病影响奶牛生产的内在原因提供参考数据。
1 材料与方案
1.1 材料
试验试剂采用市面随机采购方式,遵循数理统计随机性[1-2],试剂见表1。
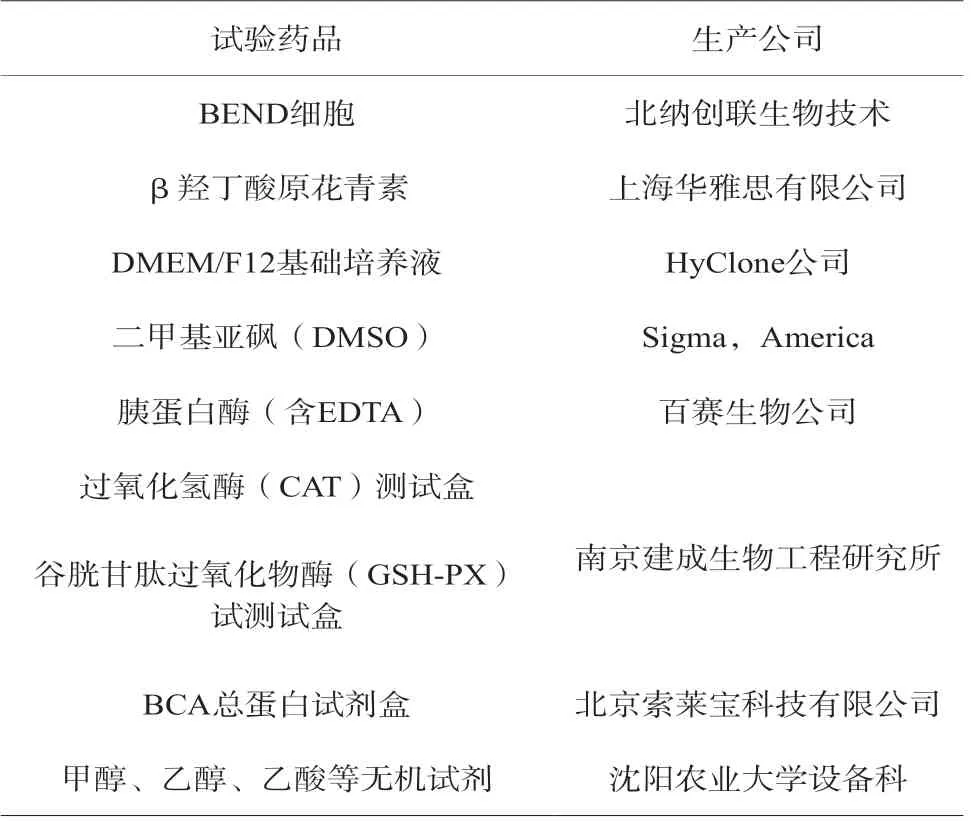
表1 试验试剂
1.2 试验方案
选取β羟丁酸的浓度分别为A1:0.6 mmol/L、A2:1.2 mmol/L、A3:2.4 mmol/L,选取原花青素浓度为10 umol/L,作用时间为24 h。试验环境统一采用DMEM/F12基础培养液配置的完全培养基,试验方案中不再详述[3]。将试验分为8组,各组做3复孔,见表2。
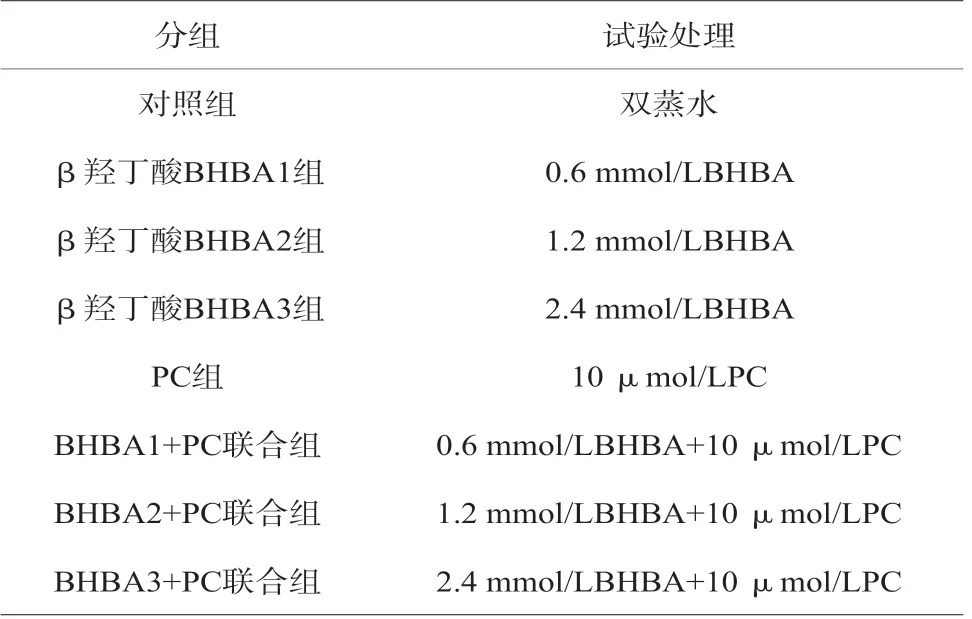
表2 试验方案
将细胞瓶内的细胞传代至6孔板中,待贴壁稳定生长后(约7 h)向6孔板中加入不同浓度的药物,即8组,3个复孔,培养24 h后取上清用于氧化指标的CAT试剂盒测定与GSH-PX试剂盒测定。
2 试验方法
2.1 CAT试剂盒测量
试剂1,100 mL液体;试剂2,10 mL底物液体;试剂3,10 mL液体。试剂统1在4 ℃放置6个月。
BEND细胞经过培养并稀释,1 d后离心得到上清液。首先,做预实验,测量样品的稀释程度。在正式试验中,从8组中取出16个10 mL离心管,分为对照管与测量管。将1.0 mL试剂1和0.1 mL试剂2加入对照管中,然后放入37 ℃的水浴锅中充分浸泡1min,最后分别加入1.0 mL试剂3、试剂4和上清液;将对应管得到的0.1 mL液体加入到测量管中,并加入1.0 mL试剂1,0.1 mL试剂2,放入37 ℃的水浴锅中充分浸泡1 min,再添加1.0 mL的试剂3。充分摇动均匀对照管和测量管,转移到酶标平板上,每孔200 μL,每组重复3次。将试管放置到酶标仪中,将其波长调整为405 nm,并在96孔板中观察OD值。细胞上清中CAT活性的计算[4]:

2.2 GSH-PX试剂盒的测定方法
试剂,2 mL储备液。试剂2,包括甲粉,放入双蒸水溶解,乙液50 mL,使用时将甲、乙两溶液掺混使其产生晶体,后加热溶解。试剂3,粉剂1瓶。试剂4,粉剂1支。试剂5,粉剂4支。试剂6,GSH标准品,12.28 mg。试剂统一在4 ℃放置6个月。
BEND细胞经过培养并稀释,1 d后离心得到上清液。首先,做预实验,测量样品的稀释程度。取8支非酶管,向各管加入0.2 mL 1 mmol/L GSH,在37 ℃条件下保持5 min,加入0.1 mL试剂1,在37 ℃条件下保持5 min,最后加入3 mL试剂2和0.2 mL上清液。取8个酶管,向各管加入0.3 mL 1 mmol/L GSH和0.2 mL上清液,在37 ℃条件下保持5 min,加入0.3 mL试剂1,在37 ℃条件下保持5 min,最后加入3 mL试剂2,取上清液显色。各取8个对照管和标准管。向对照管加入2 mL试剂3、0.5 mL试剂4、2 mL GSH溶液,0.05 mL试剂5。向标准管加入1 mL 20 μmol/L GSH溶液、2 mL试剂3、0.5 mL试剂4。将1 mL上清液分别转移至酶管和非酶管中,并加入2 mL试剂3、0.5 mL试剂4。充分摇动均匀后,转移到酶标平板上,每孔200 μL,每组3~5个复孔。将试管放置到酶标仪中,将其波长调整为412 nm,并在96孔板中观察OD值。细胞上清中GSH-PX活性的计算[4]:

3 结果与分析
3.1 BHBA与PC联合培养对BEND细胞CAT活性的测定结果
与空白组相比,单独加BHBA组的BEND细胞随BHBA浓度的升高CAT活性整体呈下降趋势,其中BHBA浓度为0.6 mmol/L时BEND细胞的CAT活性显著下降(P<0.05),BHBA浓度为1.2 mmol/L和2.4 mmol/L时BEND细胞的CAT活性极显著下降(P<0.01),PC组和BHBA+PC组的CAT活性均上升。见图1。
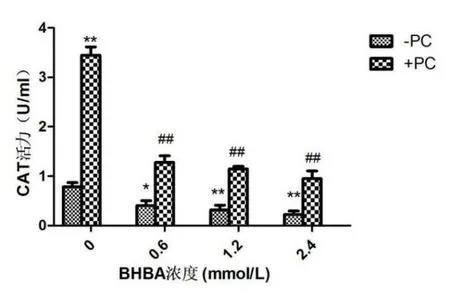
图1 BEND细胞CAT活性
3.2 BHBA与PC联合培养对BEND细胞GSH-PX活性的测定结果
与空白组相比,单独加BHBA组BEND细胞随BHBA浓度的升高GSH-PX含量整体呈下降趋势;单独加PC组BEND细胞的GSH-PX含量则呈现极显著上升(P<0.01)。BHBA+PC组和其与之对应的BHBA组相比,BEND细胞的GSH-PX活性整体呈上升趋势,其中BHBA浓度为0.6mmol/L时加PC呈现极显著上升(P<0.01),见图2。
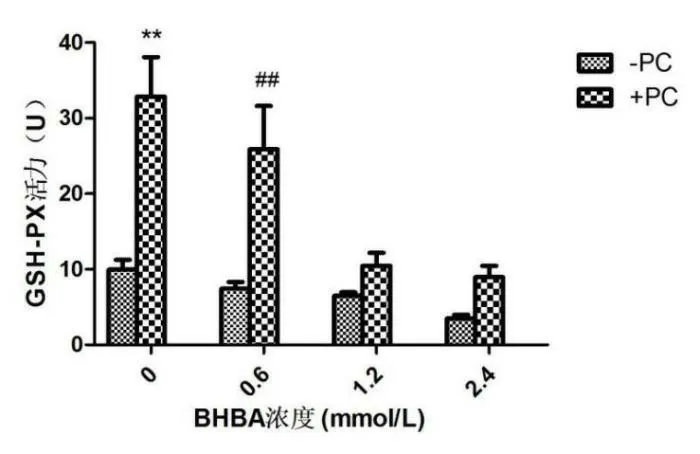
图2 BEND细胞GSH-PX活性
3.3 测定结果分析
通过向牛子宫内膜细胞(BEND)中加入不同浓度的β羟丁酸(BHBA)及原花青素(PC),通过前期实验确定添加药物浓度及作用时间,测定CAT、GSH-PX等各项指标。在BHBA作用下产生的氧化产物和氧化基团使BEND发生一系列的氧化损伤[5],造成细胞的活性丧失和凋亡,PC可消除氧化产物和氧化基团,达到“中和”效果,在关键时刻上避免BEND发生氧化损伤。OH自由基氧化特性极为活泼,它与多种有机物都会发生快速反应,可以破坏糖、氨基酸、磷脂、核苷酸和有机酸等,因此在生物体内有较广的反应面。抗氧化酶CAT能分解OH自由基,从而直接保护生物体细胞不受氧化作用而产生损伤,维持生物体的正常运转和生理机能,测定CAT含量对研究生物体细胞状态有重要意义[6-7]。
谷胱甘肽过氧化物酶(GSH-PX)是生物体内大量存在的可以分解氧化物的抗氧化酶,它特异地催化还原谷胱甘肽(GSH)的还原反应。Se的生物功能通过至少13种硒蛋白介导,作为谷胱甘肽过氧化物酶(GSHPX)的重要组成部分,它对抗氧化剂防御很重要,其补充直接影响酶的活性,测定GSH-PX活性可以作为衡量机体硒水平的一项生化指标。
4 结论
将BHBA与PC加入牛子宫内膜细胞,并测定CAT、GSH-PX等氧化指标,分析氧化指标的变化特征,研究BHBA与PC的作用机理,得出以下结论。
(1)BHBA可使牛子宫内膜细胞的活性下降,使细胞更容易氧化,发生凋亡。
(2)PC可使牛子宫内膜细胞的活性上升,清除细胞内氧化成分,保护细胞免受氧化物的损害。
(3)BHBA和PC的同时加入使牛子宫内膜细胞的活性处于单独添加BHBA和单独添加PC之间,说明原花青素可拮抗β羟丁酸诱发的氧化损伤,对BEND细胞起到保护作用。
