阿托伐他汀改善急性心肌梗死后左室收缩功能实验研究
2022-10-21韩淑芳陈瑞敏
刘 放,谈 红,晋 群,韩淑芳,陈瑞敏,杨 燕
(1.锦州医科大学研究生培养基地 解放军第九六〇医院,山东 济南250031;2.解放军第九六〇医院心内科,山东 济南250031)
急性心肌梗死(Acute myocardial infarction,AMI)是冠状动脉急性闭塞、心肌坏死导致的一系列临床危重情况,即使成功进行早期再灌注治疗,仍存在心肌细胞丢失和心脏重构等因素致使心脏收缩功能减低,诱发严重心力衰竭,是影响患者预后的重要因素。他汀类药物可改善急性心肌梗死患者的心室重构和左室收缩功能[1-2],同时大量的研究发现他汀类药物可显著影响缺血区组织的血管新生,但其作用机制尚未完全阐明。有研究发现循环微小RNA(micro RNA,miRNA)与心肌梗死患者心力衰竭的发生和预后有关[3-4],他汀类药物是否通过调控miRNA的表达、促进梗死心肌组织内血管新生而达到其改善AMI长期预后的作用还有待于进一步研究。本实验旨在通过研究AMI兔接受不同剂量阿托伐他汀治疗后,心肌miR-126、miR-221表达以及血管新生的变化、心功能的改善以及其相关性,进一步深入探讨他汀类药物对心肌梗死后心室重构和心功能改善的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 主要仪器与试剂:Light Cycle 480ⅡPCR扩增仪(Roche公司);Phllip iE33多普勒超声诊断仪;XDH-3型动物用心电图描计议;动物用无菌手术器械;阿托伐他汀钙片(辉瑞制药有限公司);小鼠单克隆CD31一抗(Abcam公司);羊抗鼠IgG二抗(福州迈新生物技术开发有限公司);Trizol、逆转录、PCR试剂盒均购自Takara公司;miR-126、miR-221、U6引物由天根生化科技(北京)有限公司合成。
1.1.2 动物模型建立:雄性新西兰大白兔购自济南西岭角养殖繁育中心[SCK(鲁)20150001],体重3~4 kg。开胸缝扎兔左前降支动脉建立急性心肌梗死模型[5]。方法步骤:10%水合氯醛静脉注射麻醉,仰卧位固定,记录术前心电图。备皮、消毒铺巾,沿胸骨左缘约1 cm处切开皮肤,逐层钝性分离皮下组织、胸大肌、胸小肌及肋间肌,钳夹剪断第2~4肋骨,充分暴露胸腔,切开并悬吊心包,暴露心脏。于左心耳下缘寻找心大静脉,左前降支与之伴行,在左心耳下缘1~1.5 cm处结扎左前降支。有效阻断血流后可见相应心肌节段由鲜红色变为暗红色,室壁运动减弱,同时描记心电图,可见胸前导联ST段弓背型抬高,AMI模型建立成功,然后逐层关闭胸腔。手术中注意避免损伤血管及胸膜而导致大出血及气胸影响动物存活。
1.1.3 实验动物分组:最终成功建立兔心肌梗死模型33只。术后24 h采用随机数字表法分为三组(AMI组、低剂量阿托伐他汀组和高剂量阿托伐他汀组),每组11只。AMI组给予等量助溶剂连续灌胃 4 周,低剂量阿托伐他汀组给予阿托伐他汀钙片1 mg/(kg·d),高剂量阿托伐他汀组给予阿托伐他汀2 mg/(kg·d),连续灌胃 4 周,对照组接受假手术治疗。
1.2 实验方法
1.2.1 超声心动图检查:第28天将兔按照3 ml/kg给予10%水合氯醛耳缘静脉内注射麻醉,M型超声心动图检测各组左室射血分数(LVEF)、每搏输出量(SV)和左心室短轴缩短率(LVFS)。
1.2.2 标本采集:超声心动图检测后处死动物,取梗死部位心肌组织标本均分为两份,一份用4%多聚甲醛固定,石蜡包埋,行免疫组织化学染色;另一份心肌组织液氮快速冷冻后转移至-80 ℃冰箱保存,用于RT-PCR检测。
1.2.3 心肌组织免疫组化染色和微血管密度(MVD)测定:每例样本取同部位切面的5张切片,脱蜡,二甲苯、梯度酒精逐步水化;在0.01 mol/L柠檬酸钠缓冲液中高压抗原修复15 min;玻片置于3%H2O2中,湿盒孵育10 min;滴加小鼠单克隆CD31一抗(1∶100),湿盒孵育;加羊抗鼠IgG二抗,湿盒孵育;DAB染色,观察到切片有颜色改变时,即用自来水洗去染色液;苏木素复染3 min,1%盐酸酒精分化,控制染色程度;将玻片置于二甲苯中透明3 min×2次,中性树胶封片,放入65 ℃烘箱中15 min。每张切片在400倍光镜下选择梗死区5个血管密度最高的区域计数,其平均值为MVD值,相互分离的内皮细胞、内皮细胞簇、内皮细胞条索均按1个微血管计数,管腔大于8个红细胞大小、且带有较厚肌层的血管则不予计数。
1.2.4 miRNA 表达水平的测定:采用RT-PCR法检测miR-126 和miR-221表达水平。使用Trizol常规方法提取组织总RNA,测定OD值在1.7~2.1。采用两步法(解链-退火延伸)进行实时荧光定量PCR反应,扩增条件:预变性:95 ℃ 30 s,退火和延伸:95 ℃ 5 s,60 ℃ 20 s,共40个循环。采用U6作为参照基因,每个实验样本设置3个副孔,以2-△△Ct表示样品中目的基因初始 cDNA 相对表达量。所用引物由天根生化科技(北京)有限公司定制。
1.3 统计学方法 采用SPSS 26.0统计学软件进行分析。数据以均数±标准差表示,采用单因素方差分析,各组之间数据两两比较采用两个独立样本的t检验;检验水准α=0.05。
2 结 果
2.1 建模成功后心电图表现 结扎前降支后心动图胸前导联ST段弓背型抬高0.2 mV以上,表明兔急性心肌梗死建模成功。
2.2 左室收缩功能检测结果 实验动物建模28天后,行心脏M型超声心动图检查,测定各组心脏左室收缩功能的指标,见表1(图1)。结果显示:单因素方差分析显示总体各组兔LVEF(F=14.97,P<0.01)、LVFS(F=25.66,P<0.01)、SV(F=25.36,P<0.01),比较差异均有统计学意义;与对照组比较,其余三组LVFS、SV、LVEF的数值均显著降低,经阿托伐他汀药物干预后,两组各指标均较AMI组明显升高,以高剂量阿托伐他汀组升高更为明显,但仍低于对照组。除LVEF在高剂量和低剂量阿托伐他汀组之间比较差异无统计学意义外(P>0.05),各组之间LVEF、LVFS、SV两两比较有统计学差异(均P<0.05)。
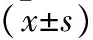
表1 各组兔miR-126、miR-221表达水平、LVFS、SV和LVEF比较
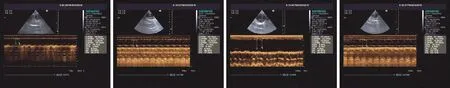
对照组 AMI组 低剂量阿托伐他汀组 高剂量阿托伐他汀组
2.3 梗死心肌组织中MVD检测 结果经免疫组织化学染色后,被CD31抗体标记的新生血管内皮细胞呈棕黄色,细胞浆无棕色或与背景一致为阴性,细胞核呈蓝色。对照组无心肌梗死,故没有新生血管,仅存在一些固有血管。AMI组MVD为(3.45±1.04),经阿托伐他汀干预后,低剂量组MVD增加至(5.73±1.49),高剂量组作用更明显(7.64±1.81),见表1。单因素方差分析显示总体各组之间比较差异有统计学意义(F=50.95,均P<0.01),AMI组、低剂量和高剂量阿托伐他汀组之间比较均有统计学意义(均P<0.01)。
2.4 miR-126和miR-221表达变化 与对照组比较,AMI组miR-126的表达水平(0.63±0.07与1.03±0.06)明显降低,而miR-221表达水平明显升高(1.01±0.04 与 0.38±0.07),表明心肌梗死后心肌组织中miR-126和miR-221的表达有显著变化。经阿托伐他汀干预后,miR-126在低剂量组较AMI组明显升高(1.87±0.09 与0.63±0.07),高剂量组升高更明显(2.44±0.29 与 0.63±0.07),而且miR-221的变化与之相反,在低剂量组比较AMI组明显下降(0.75±0.14与1.01±0.04),高剂量组下降更为显著(0.43±0.11与1.01±0.04)。单因素方差分析显示四组之间miR-126(F=256.58,均P<0.01)和miR-221(F=81.66,P<0.01)均值总体差异有统计学意义,两两比较显示比较差异有统计学意义(均P<0.01),见表1。
2.5 MVD和miR-126、miR-221相关性分析 在高剂量阿托伐他汀组,梗死心肌组织MVD与miR-126表达水平呈显著正相关(r=0.703,P<0.05),与miR-221表达水平呈显著负相关(r=-0.755,P<0.01)。
3 讨 论
AMI是冠心病的急危重症表现,由冠状动脉血流突然减少甚至闭塞导致,进展迅速,病死率高。梗死相关血管的血运重建使梗死心肌得到早期再灌注治疗,可降低AMI患者病死率,改善左室收缩功能。但是,有部分患者由于微循环功能障碍而出现心肌灌注不足,或梗死区域的顿抑心肌持续缺血、坏死[5],影响患者远期预后。AMI 后微血管的形成有利于恢复缺血心肌的血供,缩小心肌梗死面积,进而改善 AMI 后心功能,对患者的预后有着重要的临床意义,促血管新生将心肌梗死的治疗带向一个新的治疗方向[6]。血管新生即从先前的血管构造上生长出新的微血管的过程,它包括3个连续的步骤:①血管舒张,血管壁通透性升高,基底膜降解;②内皮细胞激活、增生、迁移;③新管腔形成及重塑[7]。很多调节途径参与其中,如Notch、P13K/Akt和MAPK/ERK等信号通路[8]。
miRNA是一类由18~25个核苷酸构成的高度保守的非编码小分子单链RNA,其通过与相应靶基因miRNA的3’非翻译区结合,影响其降解或后续的翻译过程,达到负性调控其基因表达的作用。有多种miRNA通过调节血管新生参与冠心病的发生和发展[9]。我们之前的研究也证实一些miRNA在冠心病和心衰的发生、发展、诊断以及预后中发挥着重要的作用[10-11]。调控新血管形成的特定miRNA有两大类,一为促进新血管形成的miRNA,二为阻止新血管形成的miRNA。有些文献总结了与血管新生相关的miRNAs,其中促血管新生的有miR-17-92、miR-let-7、miR-27b、miR-126、miR-130a、miR-210、miR-296、miR-378、miR-21、miR-31等;抑制血管新生的有miR-15/16、miR-424、miR-221/222、miR-92a、miR-320、miR-200b、miR-217、miR-503、miR-34、miR-214等[12]。miR-126是一种内皮特异性的 miRNA,在衰老内皮细胞及其分泌的微颗粒中表达下调[13],而内皮衰老是导致内皮功能障碍的重要因素之一;Sun等[14]发现,来自急性冠脉综合征(ACS)患者血液中的血小板源性外泌体(PLT-EXO)含有高表达的miR-126,通过干预 PLT-EXOP中miR-126水平,以减缓斑块内血管新生,这或许为治疗ACS提供新的策略;DA-Silva等[15]研究证实,有氧训练能够促进miR-126表达增加;miR-126通过间接调节VEGF途径和直接调节其参与血管新生有关信号途径(MAPK和P13K/Akt/eNOS等)的靶点,可能参与了运动诱导的心脏血管新生。miR-221/222也是在内皮细胞特异性高表达的miRNA,可在转录后水平抑制干细胞因子配体c-kit和内皮源性一氧化氮合酶(eNOS)等基因的表达,从而抑制内皮细胞增殖和迁移,抑制血管新生和血管形成[16]。Poliseno等[17]研究表明,在动脉粥样硬化过程中,miRNA-221/miRNA-222在内皮细胞中发挥显著的抗血管新生作用;Chen等[18]发现,miR-221在经血管紧张素Ⅱ治疗的人微血管内皮细胞中表达上调,且miR-221的特异性拮抗剂能够强力阻断血管紧张素Ⅱ的促血管新生作用,提示miR-221在血管新生中可能具有双重作用。
近年来,国内外学者在他汀类药物对血管新生的影响和miRNA的干预方面进行了大量的研究工作[19-20]。Colakoglu等[21]和Elewa等[22]研究表明,临床常规剂量他汀对缺血诱导的血管新生表现为促进作用,其机制可能与P13K/Akt通路有关。Khalighfard等[23]研究报道阿托伐他汀可通过干预血管新生传导通路,促进间充质细胞向血管内皮细胞分化;在冠状动脉慢血流患者,阿托伐他汀可通过miR-221-VEFG轴促进外周循环内皮祖细胞迁移和增殖[24]。Minami等[25]在对冠心病患者的研究中发现,在给予阿托伐他汀治疗后,冠心病患者外周血中的miR-221和miR-222的表达水平明显下调,证明阿托伐他汀可明显减少外周血中miR-221/miR-222的表达水平。Pan等[26]报道阿托伐他汀可以上调ApoE基因敲除小鼠颈动脉粥样斑块中miR-126表达水平。本实验通过建立急性心肌梗死兔模型,并用阿托伐他汀对心肌梗死兔进行药物干预,观察其对心肌梗死后左室收缩功能的影响,并选取了与内皮功能密切相关的miR-126和miR-221作为监测指标,结果发现阿托伐他汀可显著改善左室收缩功能。进一步取梗死心肌组织在组织层面研究发现,经药物治疗的兔梗死心肌组织中miR-221表达显著下调,而miR-126表达显著上调,这表明阿托伐他汀同样可以降低梗死心肌组织中miRNA的表达。我们进一步分析经他汀治疗后兔的心肌组织miR-221、miR-126的表达水平与新生血管密度的关系时发现,新生血管密度与miR-221的表达水平呈显著负相关,与miR-126表达呈显著正相关,这提示我们阿托伐他汀可能通过影响miR-221、miR-126表达进而促进血管新生,进一步提高左室收缩功能,改善心肌梗死患者的长期预后。
综上所述,本研究证实阿托伐他汀可改善心肌梗死后的左室收缩功能,其机制可能与通过调节梗死心肌组织miR-221和miR-126的表达而促进血管新生有关,其相关传导通路有待进一步研究,本实验为临床应用阿托伐他汀治疗AMI提供一定的理论依据。随着miRNAs对血管新生调控作用的进一步阐明,以miRNAs为靶点的治疗性血管新生将为冠心病以及血管性疾病的诊疗提供新的思路。
