熟地黄的大麻素2型受体激动剂活性及对骨代谢的调控作用研究
2022-10-21胡思婧练晨霞史晓林张泉龙赵琦明张巧艳秦路平
胡思婧,练晨霞,张 奇,周 灏,史晓林,程 刚,张泉龙,赵琦明,张巧艳,赵 瑛,秦路平*
• 药理与临床 •
熟地黄的大麻素2型受体激动剂活性及对骨代谢的调控作用研究
胡思婧1,练晨霞1,张 奇1,周 灏1,史晓林2,程 刚1,张泉龙1,赵琦明1,张巧艳1,赵 瑛3*,秦路平1*
1. 浙江中医药大学药学院,浙江 杭州 310053 2. 浙江省新华医院,浙江 杭州 310000 3. 咸阳市中心医院,陕西 咸阳 712000
探究熟地黄的大麻素2型受体(cannabinoid receptor 2,CB2R)激动活性及其对骨代谢的调控作用。采用双荧光素酶报告基因建立CB2R调节剂筛选体系;分别给予熟地黄提取物或CB2R选择性激动剂HU308或CB2R反向激动剂AM630处理,采用CCK-8法测定成骨细胞和破骨细胞的增殖活性;采用磷酸苯二钠法测定成骨细胞碱性磷酸酶(alkaline phosphatase,ALP)和破骨细胞抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)的活性;采用流式细胞仪测定成骨细胞的细胞周期;采用ALP染色观察成骨细胞分化;采用茜素红染色观察成骨细胞骨矿化结节的形成;采用TRAP染色观察破骨细胞数目;采用罗丹明-鬼笔环肽染色镜观察破骨细胞F-肌动蛋白(F-actin)环的结构和形态;采用Western blotting检测CB2R及骨代谢相关蛋白的表达。500 μg/mL熟地黄显著升高HEK293-CB2R细胞CB2R表达(<0.001),抑制forskolin刺激的HEK293-CB2R细胞中环磷酸腺苷(cyclic adenosine monophosphate,cAMP)的产生,并且其对CB2R的激动活性可被AM630逆转(<0.001)。500 μg/mL熟地黄显著促进成骨细胞增殖(<0.001),升高ALP活性(<0.001),促进骨矿化结节形成,上调CB2R及骨形成相关蛋白的表达(<0.05、0.01、0.001),抑制p38的表达(<0.05);抑制破骨细胞形成分化,降低TRAP活性(<0.001),抑制F-actin环的形成,下调CB2R、p-p38和骨吸收相关蛋白的表达(<0.05、0.001);熟地黄对成骨细胞和破骨细胞的作用可被AM630逆转(<0.05、0.01、0.001)。熟地黄具有特异性的CB2R激动活性,并可通过CB2R调控成骨细胞和破骨细胞的功能。
熟地黄;大麻素2型受体激动剂;双荧光素酶报告基因;成骨细胞;破骨细胞;地黄苷D
大麻素2型受体(cannabinoid receptor 2,CB2R)为G蛋白偶联受体超家族成员,参与炎症、纤维化、疼痛及骨代谢等多种生物活性的调节[1]。研究发现,CB2R激动剂如HU308及其对映体HU433参与成骨细胞和破骨细胞功能的调节,可减缓去卵巢诱导的大鼠骨丢失[2];CB2R激动剂4-喹诺酮-3-羧酰胺(4-quinolone-3-carboxamides,4Q3C)可减缓胶原诱导关节炎(collagen induced arthritis,CIA)小鼠炎性细胞浸润、破骨细胞数量及骨骼组织破坏,CB2R反向激动剂AM630可以逆转4Q3C对CIA小鼠骨骼的保护作用。因此,CB2R激动剂具有潜在的调节骨代谢的作用,可用于骨丢失相关疾病的治疗[3-5]。大麻中含有多种结构类型的CB2R激动剂,同时也对CB1R有激动作用,可导致精神样不良反应[6]。因此,从大麻以外的药用植物及中药中发现无精神样不良反应的CB2R调节剂,并研究其对骨代谢的调控作用,对于阐明植物药及中药抗骨质疏松的作用机制、发现结构新颖的抗骨质疏松先导化合物具有重要意义。
熟地黄为玄参科植物地黄(Gaetn.) Libosch. ex Fisch. et Mey.的干燥根的炮制品,具有补血滋阴、益精填髓等功效,用于遗精、腰膝酸软、消渴、淋证等的治疗[7]。现代研究表明熟地黄含有环烯醚萜类、紫罗兰酮类、苯乙醇苷类、三萜类、黄酮类及脂肪酸脂类等多种结构类型的化学成分,具有抗骨质疏松、抗氧化、抗肿瘤、调节免疫和降血糖等多种生物活性[8-11]。本课题组前期建立了双荧光素酶标记的CB2R调节剂筛选模型,对熟地黄等16味中药进行了筛选,发现熟地黄具有特异性的CB2R激动活性。因此,本研究在系统探索熟地黄提取物的CB2R激动剂活性的基础上,观察其基于CB2R激动活性的对成骨细胞和破骨细胞功能的调控作用,为熟地黄抗骨质疏松机制的深入研究及从中获得以CB2R为靶点的抗骨质疏松先导化合物提供科学的依据。
1 材料
1.1 动物
SPF级3日龄Wistar大鼠,购自浙江中医药大学实验动物研究中心,实验动物许可证号SCXK(浙)2021-0361。动物饲养于室温(25±2)℃、湿度45%~50%的环境中,自由进食饮水。动物实验严格遵守浙江中医药大学伦理规定(批准号109653-143166)。
1.2 细胞
小鼠单核巨噬细胞RAW264.7(目录号TCM13)、人类胚胎肾细胞HEK293(目录号GNHu43)购自中国科学院上海生科院细胞资源中心。
1.3 药材
熟地黄(批号200501)购自浙江中医药大学饮片有限公司,经浙江中医药大学药学院秦路平教授鉴定为玄参科植物地黄(Gaetn.) Libosch. ex Fisch. et Mey.的干燥根的炮制品。
1.4 药品与试剂
总RNA提取试剂盒(批号DP419)购自天根生化科技有限公司;NovoScript逆转录试剂盒(批号E047-01B)、Novo Start SYBR qPCR Super MixturecDNA扩增试剂盒(批号E096-01A)购自Novoprotein公司;pIRES2-EGFP、pGL4.29[luc2P/CRE/Hygro]、pRL-TK9由上海生工生物工程有限公司合成;DMEM高糖培养基(批号8117161)购自美国Gibco公司;α-MEM培养基(批号TBD41061)购自天津灏洋生物制品科技有限公司;Lipofectamine 3000转染试剂(批号2369247)购自美国Thermo Fisher Scientific公司;磷酸酶蛋白酶抑制剂(批号P1045)、Western及IP裂解液(批号P0013J)、5×上样缓冲液(批号P0015)、脱脂奶粉(批号P0216)、Western一抗稀释液(批号P0023A)、牛血清白蛋白(批号ST023)、BCA蛋白定量试剂盒(批号P0010)、30%丙烯酰胺溶液(批号ST003)、1.5 mol/L Tris-HCl(pH 8.8,批号ST788)、1 mol/L Tris-HCl(pH 6.8,批号ST768)、过硫酸铵(批号ST005)、TEMED(批号ST728)、DAPI染色液(批号061819191015)、双荧光素酶报告基因检测试剂盒(批号121820210416)、碱性磷酸酶(alkaline phosphatase,ALP)试剂盒(批号121820210416)购自上海碧云天生物技术有限公司;核因子-κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL,批号0615612F1322)购自杭州联科生物技术股份有限公司;Tris(批号A501492-0500)、甘氨酸(批号A502065-0500)购自上海生工生物科技有限公司;胎牛血清(批号10091-148)、腺苷酸环化酶激活剂forskolin(批号S1612)、CB2R反向激动剂AM630(批号GC10147)、青霉素-链霉素(批号15140-122)购自美国GLPBIO公司;人环磷酸腺苷(cyclic adenosine monophosphate,cAMP)检测试剂盒(批号MM-0006H1)购自酶免生物有限公司;抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色试剂盒(批号SKK0946)购自日本Wako公司;ECL显色液(批号1925901)购自美国Millipore公司;CCK-8增殖检测试剂盒(批号ab228554)、CB2R选择性激动剂HU308(批号ab254226)、成骨细胞特异基因Osterix兔多克隆抗体(批号ab22552)、骨桥蛋白(osteopontin,OPN)兔单克隆抗体(批号ab214050)、p38兔单克隆抗体(批号ab182453)、I型胶原蛋白(type I collagen,COL-1)兔单克隆抗体(批号ab138492)购自英国Abcam公司;基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)兔多克隆抗体(批号BA2202)购自武汉博士德生物工程有限公司;成骨特异性转录因子2(runt-related transcription factor 2,Runx2)兔多克隆抗体(批号12556S)、活化T细胞核因子1(nuclear factor of activated T-cells cytoplasmic 1,NFATc1)兔单克隆抗体(批号8032S)、c-Fos兔单克隆抗体(批号2250S)、p-p38兔单克隆抗体(批号4511S)购自美国CST公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔多克隆抗体(批号AF7021)、HRP标记的山羊抗兔IgG抗体(批号S0001)购自美国Affinity公司。
1.5 仪器
RE-2000A型旋转蒸发仪(上海亚荣生化仪器厂);XP105型电子天平(瑞士梅特勒-托利多仪器公司);智能数显多功能油水浴(巩义市予华仪器有限责任公司);ORW1.5S-5E型微波动态萃取设备(南京澳润微波科技有限公司);离心机、低温高速离心机、二氧化碳培养箱(美国Thermo Fisher Scientific公司);双垂直电泳仪、凝胶成像系统、荧光定量PCR仪器(美国Bio-Rad公司);多功能酶标仪(美国Bio-Tec公司);荧光相差倒置显微镜(日本Nikon公司)。
2 方法
2.1 细胞培养
成骨细胞提取自1日龄Wistar大鼠的颅骨,用含10%胎牛血清及1%青霉素-链霉素双抗的α-MEM培养基,HEK293细胞和RAW264.7细胞用含10%胎牛血清及1%青霉素-链霉素双抗的DMEM培养基,于37 ℃、5% CO2培养箱中培养,待细胞融合至80%左右进行传代。
2.2 CB2R双荧光素酶筛选体系的建立
使用Primer Express软件(Application Biosystems)设计标志基因的引物对,以基因作为内参,合成Eco RI黏结端和Bam HI黏结端的单链ERE齐聚物,并对其进行退火处理,形成双链分子。Eco RI和Bam HI双酶切分离双链寡聚体,用T4DNA连接酶连接,克隆到pIRES2-EGFP载体上荧光素酶编码区的上游。
将5×105个HEK293细胞接种于60 mm培养皿中,培养12 h后,用PBS缓冲液洗涤细胞,然后用Lipofectamine 3000试剂进行转染。混合液中含有检测报告质粒、编码荧光素酶的对照报告质粒和效应质粒,转染质粒比例pIRES2-EGFP-CB2R∶pGL4.29 [luc2P/CRE/Hygro]∶pRL-TK=2 μg∶10 μg∶1 μg。转染24 h后,更换为含G418(800 μg/mL)和潮霉素(400 μg/mL)的培养基,3 d更换1次培养基,2周左右得到稳定转染的细胞株。随机选取96孔板中的60个孔,30个孔为一组,每孔接种5×103个HEK293细胞后,分别加入含有1 μmol/Lforskolin的培养基作为阳性对照,含0.1% DMSO空白培养液作为空白对照,孵育6 h后测量双荧光素酶的发光值,以相对荧光素酶发光值即萤火虫荧光素酶化学发光值/海肾荧光素酶化学发光值,表示细胞CB2R的表达水平。高通量筛选系统定量评价指标包括信号本地比、信号窗、信噪比、信号本底变异系数、Z’因子等,以确保其高效、准确地应用于高通量数据收集。
2.3 熟地黄提取物的制备及其对CB2R的激动活性分析
2.3.1 熟地黄提取物的制备 取5 g熟地黄粉末于250 mL圆底烧瓶中,加入50 mL纯水,加热回流1 h,倾出上层清液,再加入50 mL纯水加热回流1 h,合并煎液后,用布氏漏斗滤过,将滤液减压浓缩定容至10 mL,得到生药量为0.1 g/mL的水提取物。采用《中国药典》2020版一部中熟地黄质量标准项下方法测定指标性成分含量,熟地黄提取物中地黄苷D质量分数为0.15%。
2.3.2 熟地黄提取物对CB2R的激动作用分析 将HEK293-CB2R细胞以5×104个/孔接种于6孔板,细胞贴壁后,饥饿培养24 h,用500 μg/mL的熟地黄提取物处理6 h,测定双荧光素酶发光值。
2.3.3 对CB2R激动作用的特异性检测 将HEK293-CB2R细胞以5×104个/孔接种于6孔板,细胞贴壁后,饥饿培养24 h,用500 μg/mL的熟地黄提取物,同时不加或者添加1 μmol/LCB2R反向激动剂AM630处理细胞6 h,测定双荧光素酶化学发光值。
2.3.4 细胞内cAMP水平的测定 按“2.3.3”项下方法处理细胞,培养结束后,加入100 μL IP裂解液,裂解30 min,收集细胞上清,按照试剂盒说明书测定细胞内cAMP水平。
2.4 熟地黄提取物对成骨细胞的作用研究
2.4.1 CCK-8检测细胞活性 将大鼠颅骨细胞以1×104个/孔接种于96孔板,37 ℃培养24 h,用500 μg/mL的熟地黄提取物和1 μmol/L HU308处理细胞;在考察CB2R依赖性时,用1 μmol/L CB2R反向激动剂AM630预处理30 min,再用500 μg/mL的熟地黄提取物或1 μmol/L HU308处理细胞。培养48 h后,加入10 μL CCK-8溶液培养30 min,测定450 nm处的吸光度()值。
2.4.2 ALP活性测定和染色 大鼠颅骨细胞按“2.4.1”项下方法处理,培养7 d后,按照试剂盒说明书测定ALP活性。弃去培养液,用预冷的PBS冲洗细胞2次,加入ALP染色液,37 ℃染色30 min,弃去染液,蒸馏水冲洗3次,于显微镜下观察拍照。
2.4.3 成骨细胞骨矿化结节的诱导及茜素红ARS染色 大鼠颅骨细胞按“2.4.1”项下方法处理,培养14 d后,用预冷的PBS冲洗细胞2次,于3.7%甲醛中固定10 min,用含40 mmol/L茜素红的ARS染料(pH 4.2)染色10 min,于光学显微镜下观察成骨细胞骨矿化结节的形态和数目。
2.4.4 成骨细胞周期检测 大鼠颅骨细胞按“2.4.1”项下方法处理,培养7 d后,药物处理后的成骨细胞离心5 min,弃去上清液,用预冷的PBS洗涤细胞1次,将细胞重悬于1 mL细胞周期检测试剂A和10 μL试剂B中,涡旋10 s,室温孵育30 min,采用流式细胞仪测定细胞周期。
2.5 熟地黄提取物对破骨细胞的作用研究
2.5.1 CCK-8检测细胞活性 将RAW264.7细胞以1×104个/孔接种于96孔板,37 ℃培养24 h,用500 μg/mL的熟地黄提取物和1 μmol/L HU308处理细胞;在考察CB2R依赖性时,用1 μmol/L CB2R反向激动剂AM630预处理30 min,再用500 μg/mL的熟地黄提取物和1 μmol/L HU308处理细胞。培养48 h后,按照CCK-8试剂盒说明书测定细胞活性。
2.5.2 TRAP活性测定和染色 将RAW264.7细胞以1×104个/孔接种于96孔板,细胞贴壁后,用25 ng/mL的RANKL诱导,使其分化为破骨细胞,按“2.5.1”项下方法处理细胞,培养3 d后,以硫代巴比妥钠洗涤细胞2次,每孔加入10 μL 0.1% Triton X-100反应10 min,加入TRAP反应液100 μL,37 ℃孵育30 min,每孔加入100 μL 1 mol/L NaOH溶液终止反应,测定405 nm处的值。用PBS洗涤细胞,每孔加50 μL 4%多聚甲醛固定20 min,然后加入50 μL 0.2% Triton X-100透化5 min,按TRAP染色试剂盒说明书进行染色,于显微镜下观察拍照。
2.5.3 破骨细胞F-肌动蛋白(F-actin)环的免疫荧光染色 将5×104个RAW264.7细胞接种于共聚焦培养皿(直径 35 mm)中,培养24 h,按“2.5.1”项下方法处理5 d,用4%多聚甲醛固定30 min,用5 g/mL鬼笔环肽在37 ℃下染色40 min,用PBS洗涤,再用4′,6′-二氨基-2-苯基吲哚在室温下染色10 min,于激光共聚焦显微镜下观察破骨细胞的F-actin环结构。
2.6 Western blotting检测CB2R、成骨相关蛋白和破骨相关蛋白表达
按“2.4.1”项和“2.5.1”项下方法处理后,提取成骨细胞或破骨细胞总蛋白,采用BCA蛋白定量试剂盒测定蛋白浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,用5%脱脂牛奶封闭后,分别加入CB2R抗体(1∶500)、GAPDH抗体(1∶1000)、成骨相关蛋白抗体(1∶1000)和破骨相关蛋白抗体(1∶1000),4 ℃孵育过夜;加入相应二抗(1∶1000),37 ℃孵育1 h,用MONAD QuickChemi 5100化学发光成像系统分析条带。
2.7 统计分析
3 结果
3.1 熟地黄提取物的CB2R激动活性分析
本研究建立了一种基于双荧光素酶的高通量筛选模型来检测CB2R和熟地黄提取物之间的相互作用。应用构建的HEK293-CB2R细胞体系评价其筛选CB2R调节剂的性能,发现信号本底值为4.8,信噪比为31.1,表明本底水平对高通量筛选的结果无显著影响。forskolin阳性对照组和DMSO空白对照信号平均值和标准偏差分别为(63.3±4.4)%和(13.1±1.6)%,信号窗为50.2%,信号本底变异系数分别为7.0%和7.6%,Z’因子为0.64,表明本模型性能较好,具有较高的可行性和可靠性。
为了验证该系统在筛选CB2R激动剂方面的可行性,检测了CB2R激动剂HU308处理的HEK293-CB2R细胞的相对荧光素酶活性,如图1-A所示,与只转染空载体的HEK293细胞相比,HU308显著增加了相对荧光素酶的活性(<0.001),1 μmol/L HU308作用6 h后相对荧光素酶发光值最高。本课题组前期利用双荧光素酶筛选模型对16种中药提取物进行筛选后,发现熟地黄提取物的CB2R激动活性可能具有特异性。如图1-B所示,100、250、500、750、1000 μg/mL熟地黄提取物作用于HEK293-CB2R细胞6 h后,以500 μg/mL熟地黄提取物作用效果最明显。因此,后续研究中,用500 μg/mL熟地黄提取物观察其CB2R激动活性及对骨代谢的调控作用。如图1-C所示,1 μmol/L HU308和500 μg/mL熟地黄提取物均能显著上调HEK293-CB2R细胞CB2R蛋白表达(<0.001)。
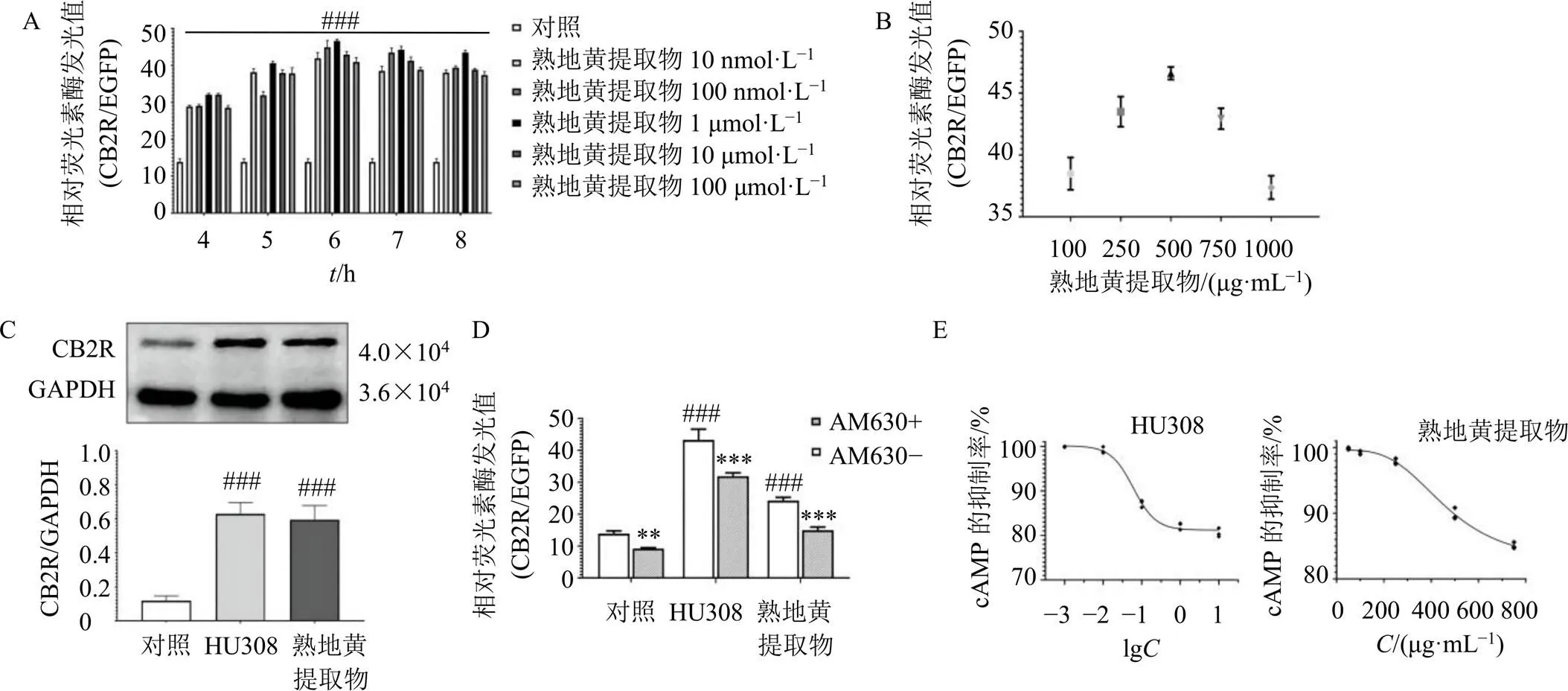
A-HU308对HEK293-CB2R细胞双荧光素酶活性分析 B-熟地黄提取物对HEK293-CB2R细胞CB2R双荧光素酶活性的影响 C-熟地黄提取物对HEK293-CB2R细胞CB2R蛋白表达的影响 D-AM630对HU308和熟地黄提取物在HEK293-CB2R细胞中CB2R激动活性的逆转作用 E-熟地黄提取物对HEK293-CB2R细胞cAMP的抑制作用 与对照组比较:###P<0.001;与无AM630的同组比较:**P<0.01 ***P<0.001
进一步用CB2R反向激动剂AM630确证熟地黄提取物CB2R激动活性的特异性,如图1-D所示,用AM630预先处理HEK293-CB2R细胞30 min,可以逆转HU308和熟地黄提取物对HEK293-CB2R细胞CB2R的激动作用(<0.001),表明熟地黄具有特异性的CB2R激动活性。CB2R通过与G蛋白偶联抑制细胞中腺苷酸环化酶(adenylate cyclase,AC)的活性,抑制细胞cAMP的产生。本研究用forskolin刺激HEK293- CB2R细胞,使细胞内cAMP含量增加,再用CB2R激动剂HU308或熟地黄提取物处理细胞,测定细胞内cAMP含量。如图1-E所示,HU308和熟地黄提取物均能够抑制forskolin刺激的HEK293-CB2R细胞中cAMP的产生,其半数抑制浓度(half inhibitory concentration,IC50)值分别为60.57 nmol/mL和(482.3±59.9)μg/mL。
3.2 熟地黄以CB2R为靶点促进成骨细胞的骨形成作用
如图2所示,CB2R选择性激动剂HU308和熟地黄提取物可促进成骨细胞的增殖、ALP活性和骨矿化结节的形成(<0.001)。熟地黄提取物作用成骨细胞后,G1期细胞比例降低,S期及G2期细胞比例增加,表明熟地黄提取物可能通过驱动细胞周期从G1期过渡到S期及G2期来促进成骨细胞的增殖(图2-D)。CB2R反向激动剂AM630能降低熟地黄提取物对成骨细胞骨形成的促进作用(<0.01、0.001),逆转熟地黄提取物对成骨细胞周期的调节作用,表明熟地黄提取物在一定程度上以CB2R相关的方式发挥增强成骨细胞的骨形成作用。
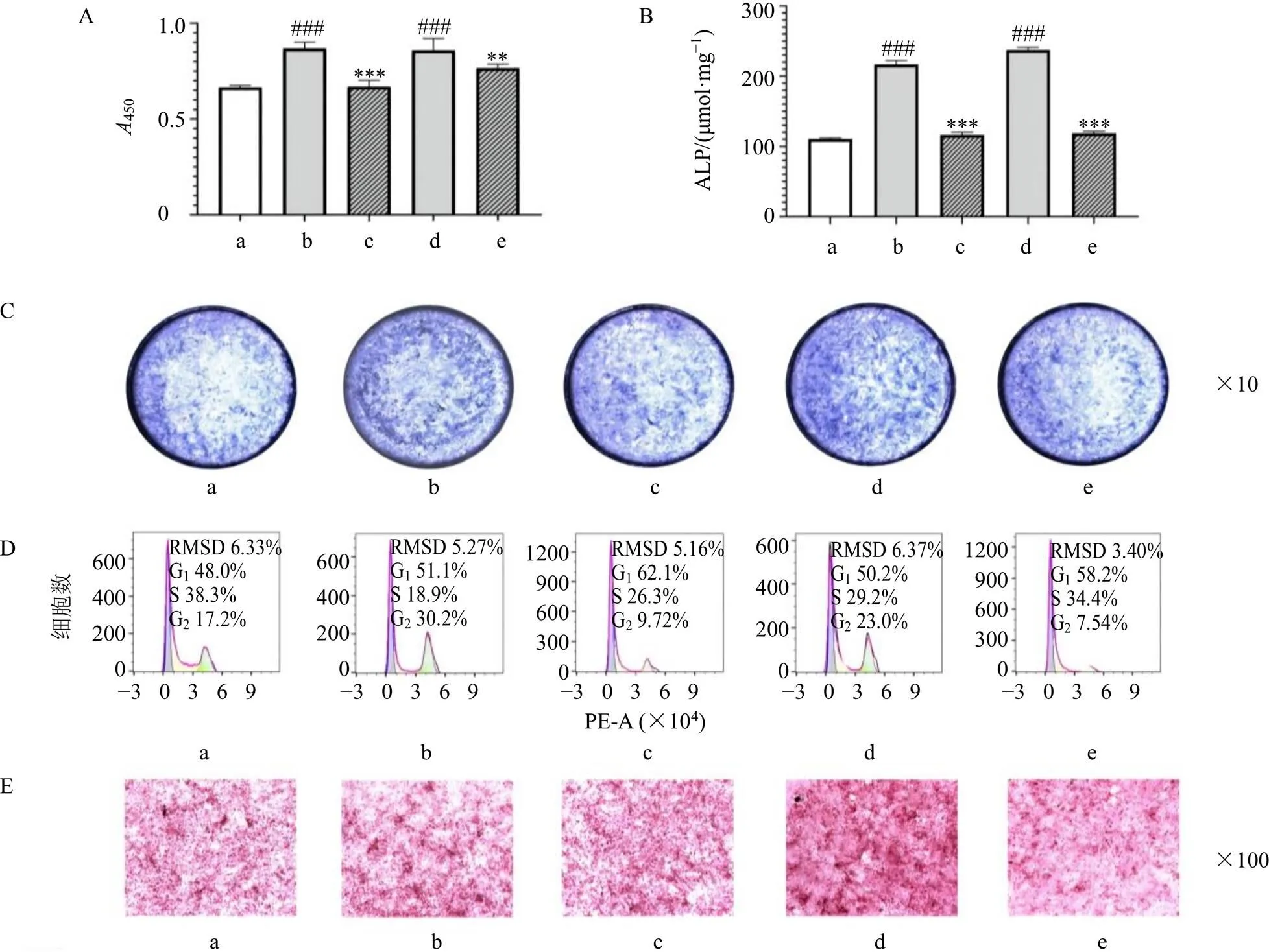
A-成骨细胞增殖 B-成骨细胞ALP活性 C-成骨细胞ALP染色 D-成骨细胞细胞周期分析 E-成骨细胞骨矿化结节的茜素红染色 a-对照组 b-HU308组 c-HU308+AM630组 d-熟地黄提取物组 e-熟地黄提取物+AM630组 与对照组比较:#P<0.05 ##P<0.01 ###P<0.001;与无AM630的同组比较:*P<0.05 **P<0.01 ***P<0.001,下图同
3.3 熟地黄提取物对成骨细胞CB2R及骨形成相关蛋白表达的影响
如图3所示,熟地黄提取物和HU308显著增加成骨细胞CB2R的表达(<0.01、0.001),AM630预处理可以降低其对成骨细胞CB2R蛋白表达的促进作用(<0.01、0.001)。熟地黄提取物和HU308可显著上调成骨细胞骨形成关键蛋白COL-1、OPN、Runx2和Osterix的表达(<0.05、0.01、0.001),AM630预处理能够逆转熟地黄提取物和HU308对成骨细胞关键蛋白表达的上调作用(<0.05、0.01、0.001)。CB2R与p38/丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路联系密切,熟地黄提取物和HU308可显著降低成骨细胞中p38的表达(<0.05),AM630预处理后可以逆转熟地黄提取物和HU308对成骨细胞p38表达的影响(<0.05、0.01)。
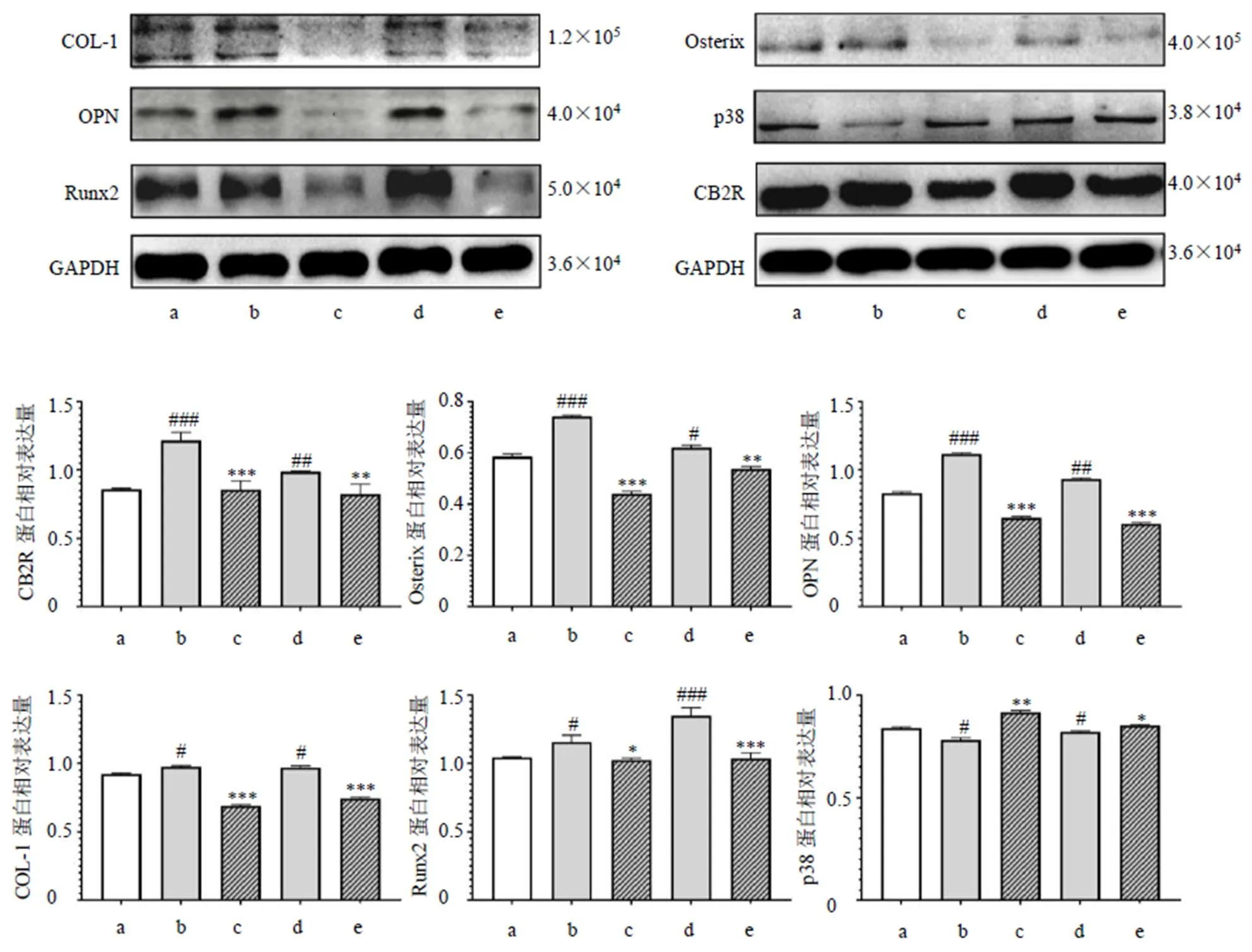
图3 熟地黄提取物对成骨细胞CB2R及骨形成相关蛋白表达的影响(, n = 3)
3.4 熟地黄提取物以CB2R为靶点抑制破骨细胞形成和分化的作用
如图4-A~C所示,HU308和熟地黄提取物作用72 h对RAW264.7细胞的活性没有显著的影响,但可显著抑制由RAW264.7细胞诱导的破骨细胞中TRAP酶的活性(<0.001),减少TRAP染色阳性破骨细胞的数目。
F-actin环是破骨细胞中形成的微管和微丝结构,在骨矿物质基质的密封区形成和骨吸收中发挥关键作用。如图4-D所示,HU308和熟地黄提取物处理RAW264.7细胞分化的破骨细胞5 d后,荧光显微镜下可见破骨细胞F-actin环的厚度变薄,结构不完整。CB2R反向激动剂AM630可显著降低熟地黄对破骨细胞TRAP活性及其形成分化的抑制作用(<0.001),逆转其对破骨细胞F-actin环形成的抑制作用。
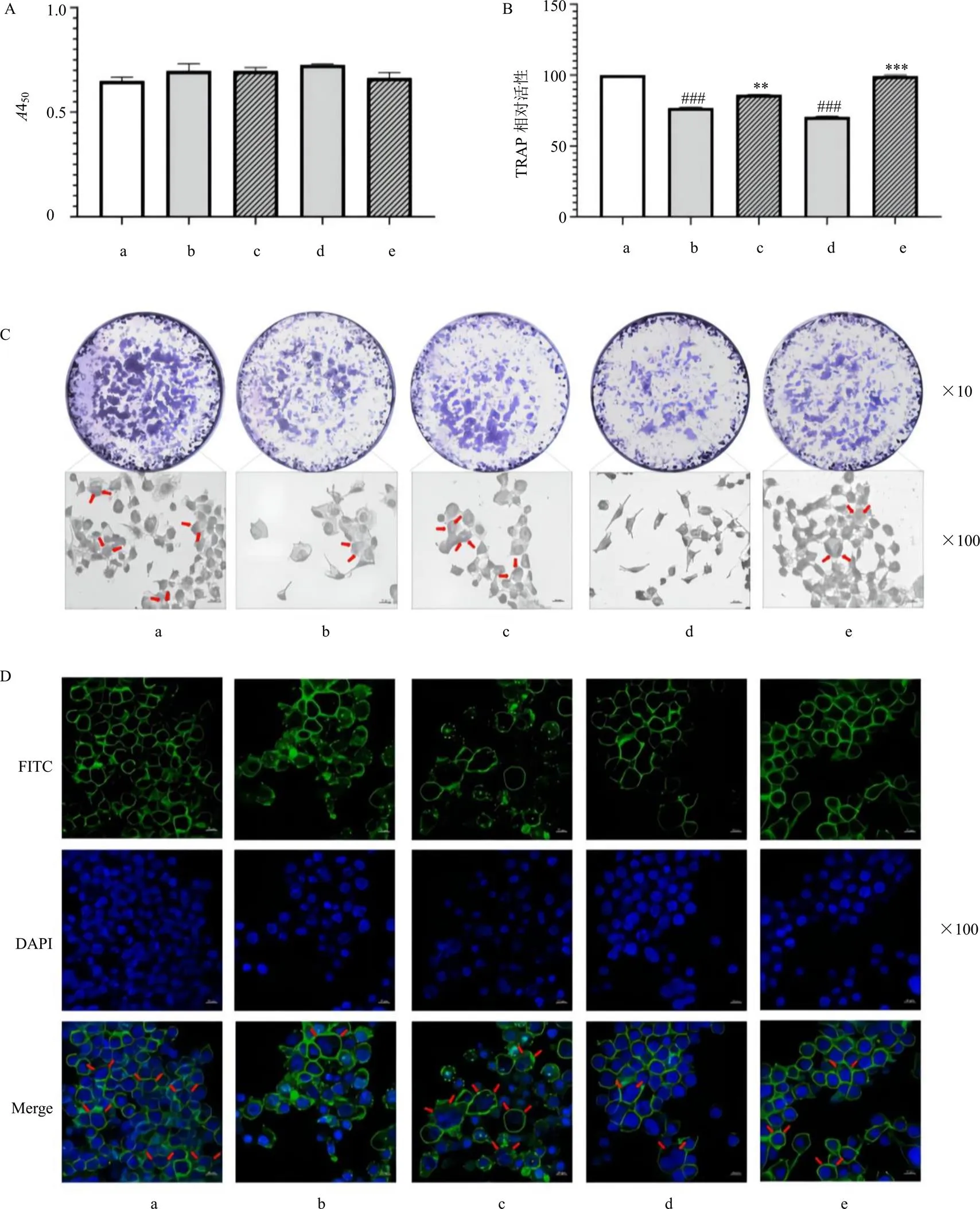
A-RAW264.7细胞的增殖 B-破骨细胞TRAP活性 C-破骨细胞TRAP酶染色(红色箭头表示成熟的破骨细胞) D-破骨细胞F-actin环染色(红色箭头表示破骨细胞的F-actin环)
3.5 熟地黄提取物对破骨细胞CB2R及骨吸收相关蛋白表达的影响
如图5所示,熟地黄提取物可显著增加破骨细胞CB2R的表达(<0.05),AM630能够逆转其对破骨细胞CB2R表达的激动作用(<0.001)。NFATc1和c-Fos是破骨细胞形成分化的关键转录因子,MMP9是破骨细胞分泌的降解骨基质的关键蛋白酶。熟地黄提取物显著抑制破骨细胞MMP9、NFATc1和c-Fos的表达及p38的磷酸化水平(<0.05、0.001),AM630能够逆转其对破骨细胞内NFATc1、MMP9、c-Fos及p-p38表达的抑制作用(<0.05、0.01)。
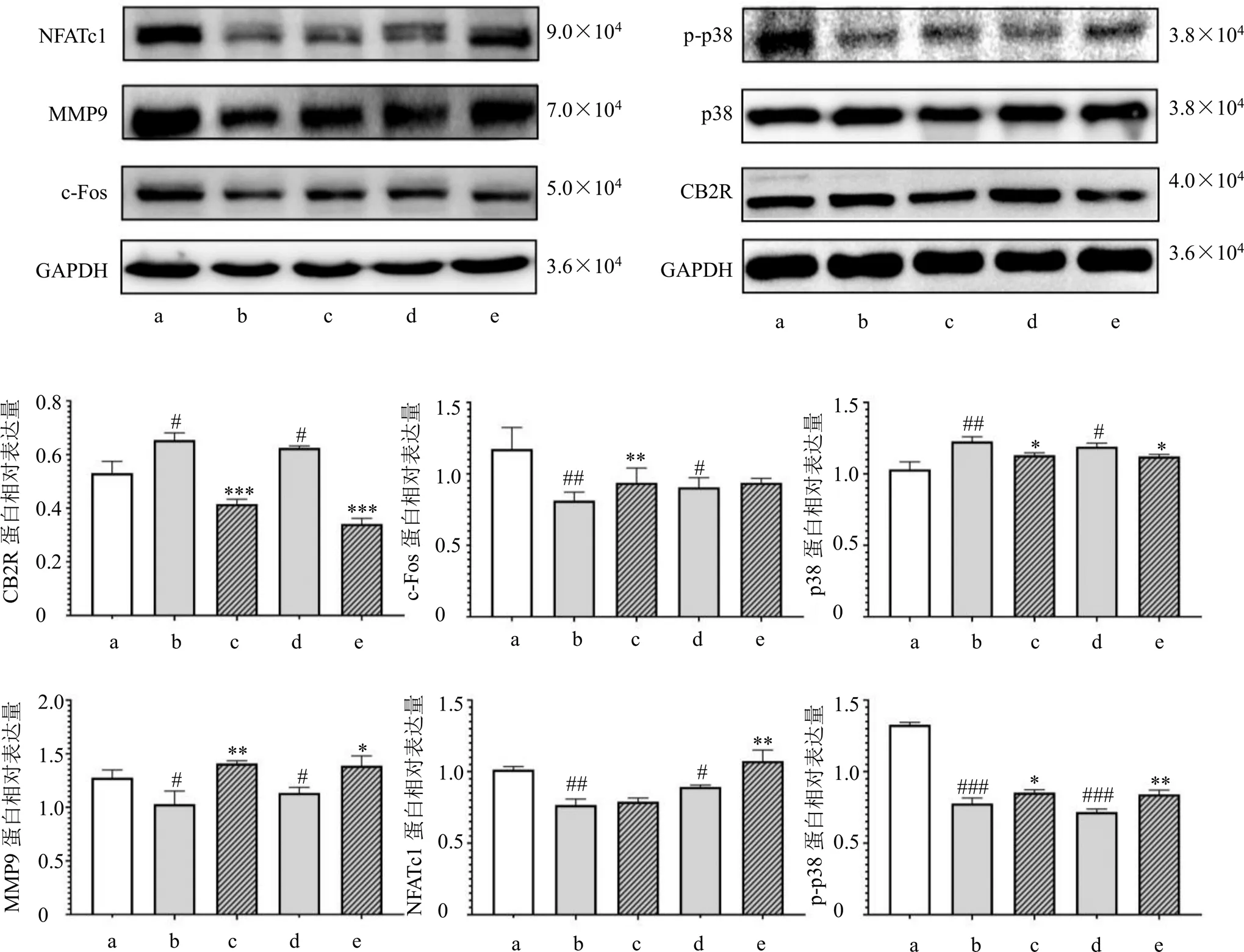
图5 熟地黄提取物对破骨细胞CB2R及骨吸收相关蛋白表达的影响(, n = 3)
4 讨论
本研究应用稳定、可靠的双荧光素酶报告基因的CB2R调节剂筛选体系分析了熟地黄提取物对CB2R的特异性激动活性及其对成骨和破骨细胞功能的调节作用,发现熟地黄对CB2R具有特异的激动作用,可促进成骨细胞的增殖、ALP活性、骨矿化结节形成及骨形成关键蛋白的表达,抑制破骨细胞的形成分化、TRAP活性及骨吸收关键蛋白的表达,并且熟地黄对成骨细胞和破骨细胞功能的调节作用可被CB2R反向激动剂AM630逆转,表明熟地黄可能以CB2R为靶点发挥调控骨代谢的作用。
本研究应用转染CB2R的HEK293细胞筛选具有CB2R激动活性的中药,并通过在仅转染EGFP的HEK293细胞及应用CB2R反向激动剂明确熟地黄提取物对CB2R的激动活性的特异性。同时,考虑到激活CB2R可抑制AC活性导致细胞内cAMP的水平降低,通过观察熟地黄提取物对转染CB2R的HEK293细胞内cAMP水平的抑制作用,发现其抑制细胞内cAMP的IC50值为(482.3±59.9)μg/mL,进一步确证了熟地黄的CB2R激动活性。
成骨细胞是体内参与骨形成的功能细胞,可表达CB2R。CB2R选择性激动剂如HU308等也表现出确切的调节成骨细胞功能的作用[12]。研究发现,CB2R激动剂β-石竹烯呈剂量相关性显著增加骨髓细胞诱导的成骨细胞的矿化,抑制骨髓细胞向脂肪细胞的分化[13]。CB2R部分激动剂厚朴酚能够保护MC3T3-E1成骨细胞免受抗霉素A的细胞毒作用,促进成骨细胞增殖、ALP活性及骨基质矿化[14]。本研究发现熟地黄提取物可通过激活CB2R调控成骨细胞CB2R/p38通路,调节细胞周期来促进成骨细胞的增殖、矿化及骨形成相关蛋白的表达,CB2R反向激动剂AM630可以逆转熟地黄提取物对成骨细胞的作用,表明熟地黄提取物通过激活CB2R抑制p38信号通路促进成骨细胞的增殖与矿化和骨形成作用。
破骨细胞是唯一具有骨吸收活性的功能细胞,CB2R激动剂直接作用于破骨细胞,抑制其形成、分化和骨吸收作用。CB2R部分激动剂甲基厚朴酚可显著抑制RANKL诱导的多核破骨细胞的形成和破骨细胞F-actin环的形成,抑制破骨细胞c-Fos、NFATc1及p38相关通路的激活[15];CB2R激动剂桦木酸显著抑制破骨细胞F-actin环的形成,进而抑制破骨细胞性骨吸收[16]。本研究发现熟地黄提取物能够减少RANKL诱导的破骨细胞的数量、破骨细胞的分化及F-actin环的形成,降低破骨细胞特异性蛋白MMP9、NFATc1及c-Fos的表达,抑制破骨细胞CB2R的表达和p38的磷酸化,CB2R反向激动剂AM630可逆转熟地黄提取物对破骨细胞的作用,表明熟地黄提取物通过激活CB2R,干预p38相关通路,降低p38的磷酸化水平,从而抑制破骨细胞的形成与分化和骨吸收活性。
熟地黄为抗骨质疏松中药方剂中使用频率最高的中药,含有环烯醚萜苷、苯乙醇苷、紫罗兰苷及脂肪酸类成分,对绝经后骨质疏松、糖尿病性骨质疏松、老年性骨质疏松及糖皮质激素诱导的骨质疏松症均有良好的防治作用[17]。研究发现,熟地黄中环烯醚萜苷类成分梓醇通过蛋白酪氨酸激酶2(Janus kinase 2,JAK2)/信号传导转录激活因子3(signal transducer and activator of transcription 3,STAT3)途径促进人骨髓间充质干细胞向成骨细胞分化,在颅骨缺损的去卵巢模型大鼠中可促进骨骼再生和血管形成[18-19];苯丙素苷类成分毛蕊花糖苷能够抑制RANKL诱导的RAW264.7细胞向破骨细胞分化,抑制成熟破骨细胞的骨吸收,并可以减轻去卵巢诱导的骨丢失[20]。本研究发现,熟地黄提取物可通过CB2R调控成骨细胞和破骨细胞的功能,表明熟地黄通过多成分、多靶点和多途径发挥调控骨代谢的作用。
利益冲突 所有作者均声明不存在利益冲突
[1] Bukke V N, Archana M, Villani R,. Pharmacological and toxicological effects of phytocannabinoids and recreational synthetic cannabinoids: Increasing risk of public health [J]., 2021, 14(10): 965.
[2] Smoum R, Baraghithy S, Chourasia M,. CB2 cannabinoid receptor agonist enantiomers HU-433 and HU-308: An inverse relationship between binding affinity and biological potency [J]., 2015, 112(28): 8774-8779.
[3] Bai J X, Ge G R, Wang Y J,. A selective CB2 agonist protects against the inflammatory response and joint destruction in collagen-induced arthritis mice [J]., 2019, 116: 109025.
[4] Apostu D, Lucaciu O, Mester A,. Cannabinoids and bone regeneration [J]., 2019, 51(1): 65-75.
[5] Tian F, Yang H T, Huang T,. Involvement of CB2 signalling pathway in the development of osteoporosis by regulating the proliferation and differentiation of hBMSCs [J]., 2021, 25(5): 2426-2435.
[6] Russell C, Rueda S, Room R,. Routes of administration foruse-basic prevalence and related health outcomes: A scoping review and synthesis [J]., 2018, 52: 87-96.
[7] Zhang R X, Li M X, Jia Z P.: Review of botany, chemistry and pharmacology [J]., 2008, 117(2): 199-214.
[8] Xu L, Kwak M, Zhang W,.polysaccharide induces toll-like receptor 4 dependent spleen dendritic cell maturation and anti-cancer immunity [J]., 2017, 6(7): e1325981.
[9] Liu C Y, Ma R F, Wang L L,.in osteoporosis: A review of traditional Chinese medicinal uses, phytochemistry, pharmacokinetics and pharmacology [J]., 2017, 198: 351-362.
[10] Huang Y E, Nan L, Xiao C W,. Optimum preparation method for self-assembled PEGylation nano-adjuvant based onpolysaccharide and its immunological effect on macrophages [J]., 2019, 14: 9361-9375.
[11] 杜珂, 高晓霞, 王锋, 等. 基于药效物质基础的熟地黄质-效评价研究进展 [J]. 中草药, 2019, 50(6): 1477-1484.
[12] Ofek O, Karsak M, Leclerc N,. Peripheral cannabinoid receptor, CB2, regulates bone mass [J]., 2006, 103(3): 696-701.
[13] Mlost J, Kac P, Kędziora M,. Antinociceptive and chondroprotective effects of prolonged β-caryophyllene treatment in the animal model of osteoarthritis: Focus on tolerance development [J]., 2022, 204: 108908.
[14] Li Y W, Kong D J, Ahmad A,. Targeting bone remodeling by isoflavone and 3, 3′-diindolylmethane in the context of prostate cancer bone metastasis [J]., 2012, 7(3): e33011.
[15] Rempel V, Fuchs A, Hinz S,.extract, magnolol, and metabolites: Activation of cannabinoid CB2 receptors and blockade of the related GPR55 [J]., 2012, 4(1): 41-45.
[16] Lee D, Yu J S, Huang P,. Identification of anti-inflammatory compounds from Hawaiian noni (L.) fruit juice [J]., 2020, 25(21): 4968.
[17] Xu R, Luo C, Ge Q W,.promotes bone fracture healing through activation of TGF-β signaling in mesenchymal progenitors [J]., 2020, 130: 110581.
[18] Chen L, Zhang R Y, Xie J,. STAT3 activation by catalpol promotes osteogenesis-angiogenesis coupling, thus accelerating osteoporotic bone repair [J]., 2021, 12(1): 108.
[19] Wan D, Yang X, Wang Y,. Catalpol stimulates VEGF production via the JAK2/STAT3 pathway to improve angiogenesis in rats’ stroke model [J]., 2016, 191: 169-179.
[20] Lee S Y, Lee K S, Yi S H,. Acteoside suppresses RANKL-mediated osteoclastogenesis by inhibiting c-Fos induction and NF-κB pathway and attenuating ROS production [J]., 2013, 8(12): e80873.
Agonistic activity ofon cannabinoid receptor 2 and its regulatory effects on bone metabolism
HU Si-jing1, LIAN Chen-xia1, ZHANG Qi1, ZHOU Hao1, SHI Xiao-lin2, CHENG Gang1, ZHANG Quan-long1, ZHAO Qi-ming1, ZHANG Qiao-yan1, ZHAO Ying3, QIN Lu-ping1
1. School of Pharmaceutical Sciences, Zhejiang Chinese Medical University, Hangzhou 310053, China 2. Zhejiang Xinhua Hospital, Hangzhou 310000, China 3. Xianyang Central Hospital, Xianyang 712000, China
To investigate the agonistic activity of Shudihuang (, RRP) on cannabinoid receptor 2 (CB2R) and its regulatory effects on bone metabolism.The CB2R regulator screening system was established by using double luciferase reporter gene. After treatment with RRP extract or CB2R selective agonist HU308 or CB2R inverse agonist AM630, the proliferation of osteoblasts and osteoclasts was detected by CCK-8. The activities of alkaline phosphatase (ALP) in osteoblasts and tartrate resistant acid phosphatase (TRAP) in osteoclasts were determined by disodium phenylphosphate method. The cell cycle of osteoblasts was determined by flow cytometry. The osteoblastic differentiation was observed by ALP staining. Alizarin red staining was used to observe the formation of bone mineralized nodules in osteoblasts. The number of osteoclasts was observed by TRAP staining. The structure and morphology of F-actin ring in osteoclasts were stained with rhodamine-phalloidin and observed with laser confocal microscopy. The expressions of CB2R and related proteins with bone metabolism were detected by Western blotting.500 μg/mL RRP significantly increased CB2R expression in HEK293-CB2R cells (< 0.001), inhibited the production of cyclic adenosine monophosphate (cAMP) in HEK293-CB2R cells stimulated by forskolin, and its agonistic activity on CB2R could be reversed by AM630 (< 0.001). 500 μg/mL RRP significantly promoted the proliferation of osteoblasts (< 0.001), increased the activity of ALP (< 0.001), promoted the formation of bone mineralized nodules, and up-regulated the expressions of CB2R and bone formation-related proteins (< 0.05, 0.01, 0.001), inhibited the expression of p38 (< 0.05); 500 μg/mL RRP inhibited the formation and differentiation of osteoclasts, decreased TRAP activity (< 0.001), inhibited the formation of F-actin ring, down-regulated CB2R, p-p38 and bone resorption-related proteins expressions (< 0.05, 0.001); The effect of RRP on osteoblasts and osteoclasts could be reversed by AM630 (< 0.05, 0.01, 0.001).RRP has specific CB2R agonistic activity, and can regulate the functions of osteoblasts and osteoclasts through CB2R.
; cannabinoid receptor 2 agonist; double luciferase reporter gene; osteoblast; osteoclast; rehmannioside D
R285.5
A
0253 - 2670(2022)20 - 6481 - 11
10.7501/j.issn.0253-2670.2022.20.020
2022-07-27
国家自然科学基金资助项目(81973534)
胡思婧,女,博士研究生,研究方向为中药活性成分及其作用研究。E-mail: hsj960321@163.com
赵 瑛,主管护师,主要从事临床护理工作。E-mail: zhao13892919525@163.com
秦路平,博士,教授,主要从事中药资源及品质评价研究。E-mail: lpqin@zcmu.edu.cn
[责任编辑 李亚楠]
