响应面法优化南方红豆杉干细胞培养体系
2022-10-20徐玲霞王景仪蒋继宏曹小迎
徐玲霞, 王景仪, 蒋继宏, 曹小迎
(江苏师范大学生命科学学院江苏省药用植物生物技术重点实验室, 徐州221116)
红豆杉(Taxussp.)又称紫杉,是红豆杉科红豆杉属的常绿乔木或灌木[1],主要分布于北半球,是我国国家一级珍稀保护树种,也是世界公认的濒临灭绝的天然珍稀抗癌植物[2-4]。红豆杉中的抗癌活性成分紫杉醇能够有效抑制癌细胞的增生繁殖,是治疗癌症的珍贵药物[5-6]。紫杉醇是由红豆杉属植物中提取得到的一种萜类化合物,最早是从短叶红豆杉中提取分离得到的,并对其进行结构鉴定和命名[7]。早期的紫杉醇主要是从红豆杉属植物中直接提取而来的,即使是紫杉醇含量较高的短叶红豆杉树皮中也只有 0.06%左右[8],含量极低。因此如何提高紫杉醇的产量已经成为当代科学家研究的焦点问题。
为解决紫杉醇的市场供需矛盾,一些新的紫杉醇药源途径逐渐被开发出来,其中,红豆杉细胞培养法是生产紫杉醇的有效途径之一[9-10]。迄今为止,关于红豆杉植物的组织和细胞培养领域的研究以及从愈伤组织中提取紫杉醇的研究报道较多[11-17],但红豆杉干细胞培养鲜有报道且未形成体系。已有的研究表明,在大规模培养时,红豆杉干细胞和愈伤组织相比,干细胞比愈伤组织增重明显,而且红豆杉干细胞在诱导后的紫杉烷类含量明显高于愈伤组织[18]。为此,在Lee等[19]诱导红豆杉干细胞培养体系的基础上,本文以南方红豆杉嫩茎为试材,在单因素试验的基础上应用响应面法研究了影响南方红豆杉干细胞生长的植物生长调节剂和抗褐化物,为进一步南方红豆杉的干细胞培养生产紫杉醇提供依据。
1 材料与方法
1.1 材料
三年生南方红豆杉购自无锡红豆杉集团,种植于江苏省药用植物生物技术重点实验室温室中。
1.2 培养基和培养条件
红豆杉干细胞诱导培养基,参照文献[19],具体为不含有(NH4)2SO4的B5培养基中加入1 mg/L的毒莠啶、30 g/L蔗糖和 4 g/L植物凝胶。用KOH调节pH值至5.5后,进行高温高压灭菌。红豆杉干细胞继代培养基为在诱导培养基的基础上蔗糖质量浓度改为20 g/L,添加0~0.02%的活性炭,植物生长调节剂、抗坏血酸、柠檬酸。培养室的培养条件为20 ℃±2 ℃,避光培养。
1.3 外植体消毒和接种
从实验室的温室中,选取生长状态较为接近的南方红豆杉一年生茎段,去除表面灰尘,用流水冲洗30 min,其中茎段需剪成1 cm左右的小段,然后用滤纸将南方红豆杉茎段的表面水分吸干,在超净工作台中用75%乙醇处理40 s,0.1%升汞处理8 min,无菌水冲洗5遍,用无菌刀片对半纵切,剥离去除木质部,形成层和韧皮部朝上,皮层朝下接入诱导培养基中进行干细胞诱导。
1.4 细胞鲜重和褐化率的响应面分析
1.4.1 单因素分析
为探讨不同质量浓度的植物生长调节剂对南方红豆杉干细胞增殖的影响,在干细胞继代培养基中分别添加GA3、2,4-D、NAA、6-BA、KT进行单因素试验,质量浓度为0、0.1、0.3、0.5、0.7和0.9 mg/L。对照组不添加植物生长调节剂。每次处理5个样品,重复3次。在培养室中培养90 d(每两周继代一次,如有愈伤组织,剥离去除)后从培养基中取出,吸干表面水分,称量鲜重并记录,计算每组处理的平均鲜重。
为减轻干细胞褐化对南方红豆杉干细胞生长的影响,在干细胞诱导培养基中分别对活性炭、柠檬酸、抗坏血酸质量浓度进行单因素试验,质量浓度为0、50、100、150和200 mg/L。对照组不添加抗褐化物质。每次接种25~30个样品,重复3次。在培养室中培养90 d(每两周继代一次)后,统计褐化率。
褐化率=褐化数÷(接种数-污染数)×100%。
1.4.2 响应面试验设计
在单因素试验的基础上,选取促进南方红豆杉干细胞增殖和抑制南方红豆杉干细胞褐化较优的水平数。根据Box-Behnken中心组合设计原理,采用四因素三水平响应面分析法进行试验设计,以培养基中的不同外源添加物及质量浓度为自变量,具体试验因素和水平见表1。

表1 Box-Behnken四因素三水平设计及编码水平
以植物生长调节剂GA3、活性炭、柠檬酸和抗坏血酸的用量作为影响因子,南方红豆杉干细胞鲜重和南方红豆杉干细胞的褐化率为响应值,确定南方红豆杉干细胞培养的最佳培养基组分及含量,最后经试验进行验证。
1.4.3 数据处理
将试验得到的南方红豆杉干细胞鲜重和褐化率数据使用Design-Expert 8.0.6软件进行方差分析,并采用Origin 8.5软件作图。
2 结果与分析
2.1 南方红豆杉植物干细胞的诱导
南方红豆杉形成层和韧皮部朝上,皮层朝下接入诱导培养基后30 d左右开始膨大,60 d左右逐渐长出愈伤和干细胞。继代后生长逐渐加快,在75 d左右形成如图1所示细胞团。形成层组织诱导出的干细胞生长较快并且比较松散透明,而韧皮部等组织诱导出的愈伤组织生长较慢并且质地较为坚硬。将诱导出的干细胞进行中性红染色,然后用显微镜进行观察。干细胞内有多个液泡,被中性红染成一个个圆点,而普通细胞只有一个被染红的大液泡(图2)。干细胞宏观形态特征有别于普通的愈伤组织,干细胞更加蓬松、易从愈伤组织剥离。

图1 南方红豆杉形成层组织培养结果Figure 1 Tissue culture results of cambium of Taxus chinensis

(a)普通的愈伤组织细胞;(b)干细胞。图2 南方红豆杉植物干细胞显微镜观察结果Figure 2 Microscopic observation of stem cells of Taxus chinensis
2.2 植物生长调节剂的选择
南方红豆杉干细胞鲜重称量的筛选结果表明,不同植物生长调节剂对南方红豆杉干细胞干重的影响不同,均优于对照组。当GA3添加量为0.5 mg/L时,南方红豆杉干细胞平均鲜重达到最大值,为1.89 g。从图3可以看出,在不同植物生长调节剂的作用下,南方红豆杉干细胞鲜重差异明显,说明植物生长调节剂的种类对南方红豆杉干细胞鲜重的影响显著。考虑到响应面法的浓度范围筛选需要,选择添加0.3~0.7 mg/L的GA3作为南方红豆杉干细胞细胞增殖的最有效质量浓度。
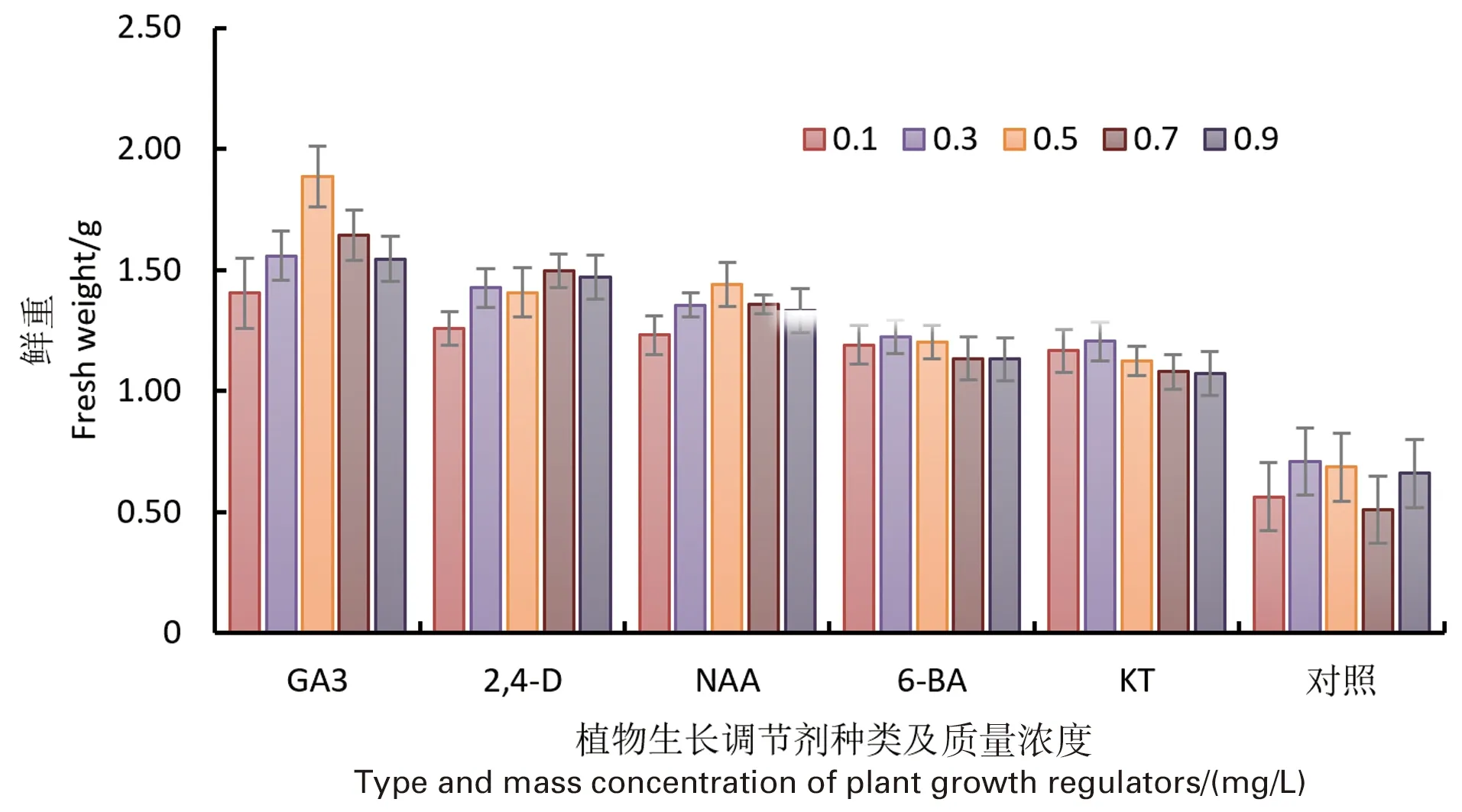
图3 不同植物生长调节剂对红豆杉干细胞鲜重的影响Figure 3 Effects of different plant growth regulators on fresh weight of Taxus chinensis stem cells
2.3 抗褐化物的选择
南方红豆杉干细胞在培养过程中会不断积累次生代谢产物而发生褐化(图4),因此需要在培养基中加入抗褐化剂。不同抗褐化物对南方红豆杉干细胞褐化的抑制情况如图5。柠檬酸、抗坏血酸、活性炭这些抗褐化物的加入均可在一定程度上减轻南方红豆杉干细胞的褐化程度。柠檬酸、抗坏血酸、活性炭在0、100和150 mg/L质量浓度下南方红豆杉干细胞褐化率并不呈现正态分布,说明不同种类的抗褐化物对南方红豆杉干细胞褐化结果有影响,而在50 和200 mg/L质量浓度下,抗褐化物种类的差异对实验结果的影响并不大,可进一步验证。

图4 南方红豆杉正常干细胞和褐化干细胞形态Figure 4 Normal and browning stem cells of Taxus chinensis

图5 不同抗褐化物对南方红豆杉干细胞褐化的影响Figure 5 Effects of different antioxidant compounds on browning of Taxus chinensis stem cells
根据抗褐化物浓度和南方红豆杉干细胞褐化率的箱体图(图6)可以整体把握南方红豆杉干细胞褐化率在不同质量浓度下的分布,抗褐化物的质量浓度越高南方红豆杉干细胞褐化率越低,在质量浓度为50 和100 mg/L时,不同种类的抗褐化物差异性较大。不同种类的抗褐化物对南方红豆杉干细胞褐化率无明显影响,但不同质量浓度对南方红豆杉干细胞褐化率有显著影响。基于此,我们发现:同种抗褐化物的不同质量浓度处理,南方红豆杉干细胞褐化率的差异显著,不同种类的抗褐化物在相同质量浓度下对南方红豆杉干细胞褐化的影响差异不显著。

图6 浓度和褐化率的箱体图Figure 6 Box diagram of concentration and browning rate
考虑到响应面法的质量浓度范围筛选需要,选择添加100~200 mg/L的柠檬酸、50~150 mg/L的抗坏血酸、50~150 mg/L的活性炭作为抑制南方红豆杉干细胞褐化的最有效质量浓度。
2.4 GA3和3种抗褐化物对南方红豆杉干细胞增殖和褐化的响应面分析
2.4.1 响应面试验方案及结果
基于上一部分得到的单因素试验结果,由Design-Expert 8.0.6统计分析软件设计出四因素三水平中心组合试验设计方案及结果如表2所示,以GA3(A)、柠檬酸(B)、抗坏血酸(C)、活性炭(D)为自变量,24个析因试验点,5个中心试验点,共计29个试验方案用以计算试验误差。

表2 响应面试验设计与结果
2.4.2 回归方程拟合及方差分析
使用软件统计分析试验结果,并进行回归分析,用Y1表示南方红豆杉干细胞鲜重响应值,Y2表示南方红豆杉干细胞褐化率响应值,分别得到二次多项式的回归方程:Y1=2.12+0.02A-0.07B+0.05C+0.02D+0.02AB-0.01AC-0.01AD-0.02BC-0.01BD0.05CD-0.27A2-0.15B2-0.18C2-0.22D2,Y2=11.88-0.41A-0.32B-0.51C-0.99D-0.13AB+1.16AC+1.85AD-0.77BC+0.46BD+0.39CD+1.53A2+2.96B2+1.88C2+3.23D2。
南方红豆杉干细胞鲜重的回归模型方差分析见表3。从表3可以看出,因素A、B、C、D及其交互组合对南方红豆杉干细胞鲜重的促进作用均不显著。该模型与实际结果拟合良好(F=6.09,P<0.01),试验方法可靠。同时,该回归模型与实际结果拟合的差异不显著(P>0.05),说明可用该回归模型来优化南方红豆杉干细胞增殖培养基的组分。该回归模型的校正系数Adj R-Squared为71.81%,表明71.81%的数据可用此多项式回归方程解释,有28.19%的变异度,该模型拟合程度有待优化。该回归模型的信噪比为7.41(>4),表明利用该回归模型预测南方红豆杉干细胞鲜重的最大值是可行的。因此,我们可利用该多项式回归方程分析和预测红豆杉干细胞鲜重。

表3 南方红豆杉鲜重的二次响应面回归模型的方差分析
由表3可以看出:一次项B的P值小于0.05,表明柠檬酸对南方红豆杉干细胞增殖具有显著影响;二次项A2、B2、C2、D2的P值均小于0.01。影响GA3、柠檬酸、抗坏血酸和活性炭促进南方红豆杉干细胞增殖的4个因素的主次关系为柠檬酸>抗坏血酸>GA3>活性炭。
南方红豆杉干细胞褐化率的回归模型方差分析见表4。由表4可以看出,因素D及其交互组合AD对抑制南方红豆杉干细胞褐化的作用均显著,因素A、B、C及其他交互组合对抑制南方红豆杉干细胞褐化的作用均不显著。该回归模型与南方红豆杉干细胞褐化结果拟合良好(F=5.53,P<0.01),试验方法可靠。同时,该回归模型与南方红豆杉干细胞褐化结果拟合的差异不显著(P>0.05),说明可利用该回归模型优化抑制南方红豆杉干细胞褐化的培养基的组分。模型的校正系数Adj R-Squared为70%,表明70%的数据可用此多项式回归方程解释,有30%的变异度,该模型拟合程度有待优化。信噪比为7.94(>4),表明试验所用的模型用来预测南方红豆杉干细胞褐化率的最小值是可行的。因此,我们可利用该多项式回归方程可分析和预测红豆杉干细胞褐化率。
由表 4可以看出:一次项D的P值小于0.05,表明活性炭对南方红豆杉干细胞褐化具有显著影响;交互项AD的P值小于0.05,其余交互项均大于0.05,说明GA3和活性炭的交互作用对抑制南方红豆杉干细胞的褐化具有显著影响。影响GA3、柠檬酸、抗坏血酸和活性炭抑制南方红豆杉干细胞褐化的4个因素的主次关系为活性炭>抗坏血酸>GA3>柠檬酸。

表4 南方红豆杉干细胞褐化率的二次响应面回归模型的方差分析
2.4.3 响应面图分析
固定GA3(A)、柠檬酸(B)、抗坏血酸(C)、活性炭(D)中的任意两个因素为零,探讨其余两个因素间的交互作用及对南方红豆杉干细胞鲜重的影响。结果如图7所示,当任意两个变量的质量浓度增加时,南方红豆杉干细胞鲜重也随之上升,达到一定值时,稍微下降或趋于稳定。其中图7(k)和(l)为固定GA3和柠檬酸质量浓度为零水平时,抗坏血酸和活性炭质量浓度对南方红豆杉干细胞增殖的影响和两者之间的交互作用。相比其他交互曲面,该曲面弧度较大、陡峭程度并不明显,说明抗坏血酸与活性炭之间有相互作用,虽不明显,但作用强度大于其他因素组合,与方差分析结果相符。在抗坏血酸质量浓度较低时,南方红豆杉干细胞鲜重随活性炭质量浓度的增加而增加,随后趋于平缓,最后有所下降。综上所述,活性炭质量浓度对鲜重影响稍大,这可能与其抑制南方红豆杉干细胞褐化有关。通过软件得到促进南方红豆杉干细胞增殖的最佳外源物质添加质量浓度为:GA30.51 mg/L;柠檬酸138.56 mg/L,抗坏血酸107.39 mg/L,活性炭101.16 mg/L。此时对南方红豆杉干细胞的预测鲜重为2.13 g。

图7 GA3、柠檬酸、抗坏血酸和活性炭间的交互作用对南方红豆杉干细胞鲜重影响的响应面图和等高线Figure 7 Response surface and contour plots of the effects of the interaction between GA3, citric acid, ascorbic acid and activated carbon on the fresh weight of Taxus cuspina stem cells
固定GA3(A)、柠檬酸(B)、抗坏血酸(C)、活性炭(D)中任意两个因素为零,探讨其余两个因素间的交互作用及对南方红豆杉干细胞褐化的影响,结果如图8所示,当任意两个变量的质量浓度增加时,南方红豆杉干细胞褐化率随之下降,达到一定值时,稍微上升或趋于稳定。其中图8(e)和 (f)为固定柠檬酸和抗坏血酸质量浓度为零水平时,GA3和活性炭质量浓度对南方红豆杉干细胞褐化的影响和两者之间的交互作用。在GA3和活性炭交互作用下曲面陡峭,说明二者之间交互相互作用显著,与方差分析结果相符。当GA3质量浓度较低时,南方红豆杉干细胞褐化率随活性炭质量浓度的增加而减小,随后趋于平缓,最后又有所上升。综上所述,活性炭对褐化率影响稍大于GA3。通过软件得到抑制南方红豆杉干细胞褐化的最佳外源物质添加质量浓度为:GA30.51 mg/L,柠檬酸148.21 mg/L,抗坏血酸104.57 mg/L,活性炭102.37 mg/L。此时对南方红豆杉干细胞的预测褐化率为11.82%。

图8 GA3、柠檬酸、抗坏血酸和活性炭间的交互作用对南方红豆杉干细胞褐化影响的响应面图和等高线Figure 8 Response surface and contour plots of the effects of interaction between GA3, citric acid, ascorbic acid and activated carbon on the browning of Taxus cuspidate stem cells
2.4.4 验证试验
试验得出促进南方红豆杉干细胞增殖的最佳外源物质添加质量浓度为GA30.51 mg/L、柠檬酸138.56 mg/L、抗坏血酸107.39 mg/L、活性炭101.16 mg/L。抑制南方红豆杉干细胞褐化的最佳外源物质添加质量浓度为GA30.51 mg/L、柠檬酸148.21 mg/L、抗坏血酸104.57 mg/L、活性炭102.37 mg/L。考虑到实际操作性,将试验条件定为GA30.5 mg/L、柠檬酸150 mg/L、抗坏血酸100 mg/L、活性炭100 mg/L。该条件下的5次试验平均鲜重和褐化率分别为(2.05±0.57) g和(11.82±1.56)%。与模型计算出的干细胞鲜重和褐化率接近,说明该响应面模型可靠,此培养基的外源物质添加方法可有效优化南方红豆杉干细胞的培养。
3 讨论
在红豆杉组织培养的过程中,受到多种因素的影响,如植物生长调节剂和抗褐化剂等。
李斌连等[20]在诱导红豆杉愈伤组织的研究中发现2,4-D对愈伤组织诱导影响最大,在培养基中添加2,4-D 2.0 mg/L、NAA 1.0 mg/L、IAA 2.0 mg/L诱导效果最好。文芳等[21]研究认为NAA、6-BA、2,4-D在1∶0.62∶0.23的比例下最有利于红豆杉细胞的生长。盛长忠等[22]研究了南方红豆杉叶片诱导愈伤组织的条件及最适培养基组成,发现2,4-D比NAA更有利于愈伤组织的形成。
李张等[23]发现多种抗褐化剂对南方红豆杉愈伤组织的褐化均有一定的抑制作用。郑超等[24]发现红豆杉愈伤组织褐化程度与总酚含量呈显著正相关,而总酚含量与PPO、POD活性则呈负相关,抗坏血酸和柠檬酸处理红豆杉愈伤组织,能有效抑制总酚的积累,从而降低其褐化程度。胡风庆等[25]通过多种途径降低PPO活性,从而降低了东北红豆杉细胞的褐化程度。李丽等[26]在对曼地亚红豆杉和南方红豆杉愈伤组织的诱导中认为,在培养基中添加0.01~0.2 mg/L的抗坏血酸能较有效地抑制红豆杉愈伤组织的褐化。
4 结论
研究不同植物生长调节剂对南方红豆杉干细胞干重的影响,考虑到响应面法的质量浓度范围筛选需要,选择添加0.3~0.7 mg/L的GA3作为南方红豆杉干细胞细胞增殖的最有效质量浓度。通过响应面试验探讨了不同质量浓度的GA3、柠檬酸、抗坏血酸、活性炭对南方红豆杉干细胞的诱导率和褐化率的影响,并建立模型。最后,对模型进行了验证,结果为在CMC基础培养基中,添加GA30.5mg/L、柠檬酸150 mg/L、抗坏血酸100 mg/L和活性炭100 mg/L为促进南方红豆杉干细胞增殖、抑制南方红豆杉干细胞褐化的最佳复配质量浓度。
