口蹄疫病毒感染与免疫鉴别诊断及免疫评价二联试纸的优化
2022-10-20杨苏珍孙亚宁刘运超柴书军张改平
杨苏珍,孙亚宁,刘运超,柴书军,张改平,2,3
(1.河南省农业科学院,动物免疫学重点实验室,郑州 450002;2.河南农业大学牧医工程学院,郑州 450002;3.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
口蹄疫(foot-and-mouth disease,FMD)是危害猪、牛、羊等主要家畜畜种的疫病,口蹄疫的流行可造成巨大的经济损失和政治影响,引发严重的负面社会影响,因此被列在一类动物疫病的首位[1]。中国猪、牛、羊养殖量最大、邻国众多,防控口蹄疫不仅对本国农牧业发展起关键作用,而且对全球口蹄疫防控有重要意义[2]。目前,除一些发达国家消灭了口蹄疫并保持着无疫状态外,口蹄疫仍在众多发展中国家流行或散发[3]。
疫苗免疫是防控口蹄疫的主要手段。早期使用的疫苗主要是弱毒疫苗,因其存在与流行毒重组和更替畜主返强的潜在风险,以及活毒的持续感染妨碍疫源净化等缺陷,20世纪70年代后逐渐被灭活疫苗取代[4]。口蹄疫灭活疫苗是目前使用的主要疫苗,在口蹄疫防控中发挥了重要作用。欧洲经历十多年的灭活疫苗接种后,疫情得到了有效控制,多数国家达到无疫标准。在此情况下,欧洲共同体虽然于1991年停止了疫苗的使用,可疫苗库中始终留存战备疫苗[5]。南美也有一些国家使用灭活疫苗,有效控制了疫情,取得了无口蹄疫国家地位。在使用口蹄疫疫苗的国家,势必要进行疫苗免疫效果评价和感染动物与免疫动物鉴别诊断[6-7]。目前国内外有多种商品化的酶联免疫吸附试验(ELISA)试剂盒,大体上分为两类:一类是结构蛋白抗体检测ELISA试剂盒和液相阻断ELISA试剂盒,用于评价疫苗免疫效果[7-8];另一类是非结构蛋白抗体检测ELISA试剂盒,用于口蹄疫病毒(Foot and mouth disease virus,FMDV)感染动物与免疫动物的鉴别诊断[8]。为了使检测方法更加简便,进一步降低检测成本,节约检测时间,河南省农业科学院动物免疫学实验室已成功建立了一种FMDV感染与免疫鉴别诊断及免疫评价二联试纸[9],为使该试纸商品化,本研究进一步对该试纸的胶体金垫的处理液、金标蛋白的缓冲液、样品垫的缓冲液、喷膜蛋白的稀释液以及样品稀释液进行优化,为基层FMDV的检测提供简便的方法,为口蹄疫的防控赢得宝贵的时间。
1 材料与方法
1.1 主要试剂
氯金酸(HAuCl4·H2O)、牛血清白蛋白(bovine serum albumin,BSA)、酪蛋白(casein)、金黄色葡萄球菌蛋白A(Staphylococcusaureusprotein A,SPA)和柠檬酸三钠(C6H5Na3O7·2H2O)均购自郑州慧耕达生物科技有限公司;硝酸纤维素膜(HF13502S25,30 cm×2 cm)、吸水纸和玻璃纤维购自上海金标生物科技有限公司;口蹄疫O型抗体液相阻断ELISA(LPB ELISA)检测试剂盒和3ABC阻断ELISA(3ABC ELISA)抗体检测试剂盒均购自兰州兽研生物科技有限公司;四硼酸钠(Na2B4O7·10H2O)、十二水合磷酸氢二钠(Na2HPO4·12H2O)、二水合磷酸二氢钠(NaH2PO4·2H2O)、叠氮化钠(NaN3)、曲拉通100(Trition X-100)等均购自国药集团化学试剂有限公司。
1.2 主要仪器
三维喷点系统(BioDot-XYZ3060)、读条仪(BioDot-TSR3000)、压壳机(HGS802)、紫外可见分光光度计(U-3000)和斩切机(BioDot-CM 4000)均购自杭州峰航科技有限公司;离心机(SIGMA4-16K)和定时恒温双向磁力搅拌器(93-3)均购自上海亚荣生化仪器厂;电热鼓风干燥箱(101-2AB)购自上海一恒科学仪器有限公司;薄膜连续封口机(900型)购自广州华丰包装设备有限公司;加热磁力搅拌器(JB-SX)购自南北仪器设备有限公司。
1.3 方法
1.3.1 试纸原理 根据FMDV结构蛋白(structural protein,SP)VP1和非结构蛋白(Non-structural protein,NSP)2B、3B、3C上主要抗原表位,按照市场上现有几种FMDV疫苗毒株序列,设计合成4条结构蛋白多肽和5条非结构蛋白多肽,并在氨基端加入半胱氨酸,将合成并纯化的多肽与BSA载体蛋白偶联。将BSA-SPs抗原和BSA-NSPs抗原分别作为检测线1(test line 1,T1)和检测线2(test line 2,T2),FMDV单克隆抗体IgG作为质控线(control line,C),胶体金标记SPA作为探针建立FMDV抗体评价和感染与免疫鉴别诊断二联试纸。试纸模式和原理见图1。
1.3.2 金标物的优化 在双抗体或多种抗体检测系统中,金标蛋白需要同时结合多种抗体,本系统选择了能结合猪IgG的羊抗猪IgG和SPA,分别用生理盐水稀释成浓度为1.0 mg/mL,取2个离心管,每管加入1 mL用K2CO3调整过pH的胶体金(GNP)溶液,将稀释好的羊抗猪IgG和SPA溶液分别缓慢加入胶体金中,每管10 μL。按照张改平[10]报道方法进行胶体金标记后,分别按照1.5、1.0、0.5 μL/条将金标蛋白点在试纸条上,检测FMDV阳性血清和阴性质控血清,对比检测结果,根据检测结果的特异性和敏感性,选择最适的蛋白和最佳用量作为最佳标记用量。
1.3.3 金标蛋白保存液的筛选 不同的金标蛋白保存液对金标蛋白的稳定性、特异性、敏感性都有影响,本研究根据所标记蛋白的性质,设计4种金标蛋白保存液(表1)。操作方法:分别向1 mL 的胶体金溶液中缓慢地加入5 μL浓度为1 mg/mL的蛋白溶液(共4管),反复吹打混匀后,室温放置30 min;加入100 μL 50 g/L酪蛋白封闭液,混匀,室温静置10 min;12 000 r/ min,4 ℃离心20 min,弃上清;4管沉淀分别用100 μL 1~4号金标蛋白保存液重悬,将重悬的金标蛋白溶液室温放置7 d,观察金标蛋白状态,并组装试验用试纸,检测质控血清,根据敏感性、特异性和稳定性检测结果选择最佳的金标蛋白保存液。
1.3.4 感染检测线(T2)多肽抗原的筛选 在本试纸系统中,T2检测线用来鉴别FMDV感染和免疫动物,选用了FMDV非结构蛋白2B、3B、3C上的5个抗原表位偶联载体蛋白BSA(BSA-NSPs)作为抗原,为筛选这5个多肽抗原的最佳使用方法,分别将5种多肽抗原用生理盐水稀释为0.5 mg/mL,喷膜做检测线,检测FMDV O型感染血清、FMDV O型免疫血清和阴性血清,对比检测结果,筛选特异性和灵敏度较高的抗原,并优化喷涂条件,对比等量混合多肽喷涂效果,选择T2检测线的多肽抗原;并进一步优化筛选到的多肽喷膜量,按1.0、0.5、0.25、0.125 mg/mL的量喷膜,分别检测FMDV O型感染血清和阴性血清,根据特异性和灵敏度选择最佳喷膜剂量。
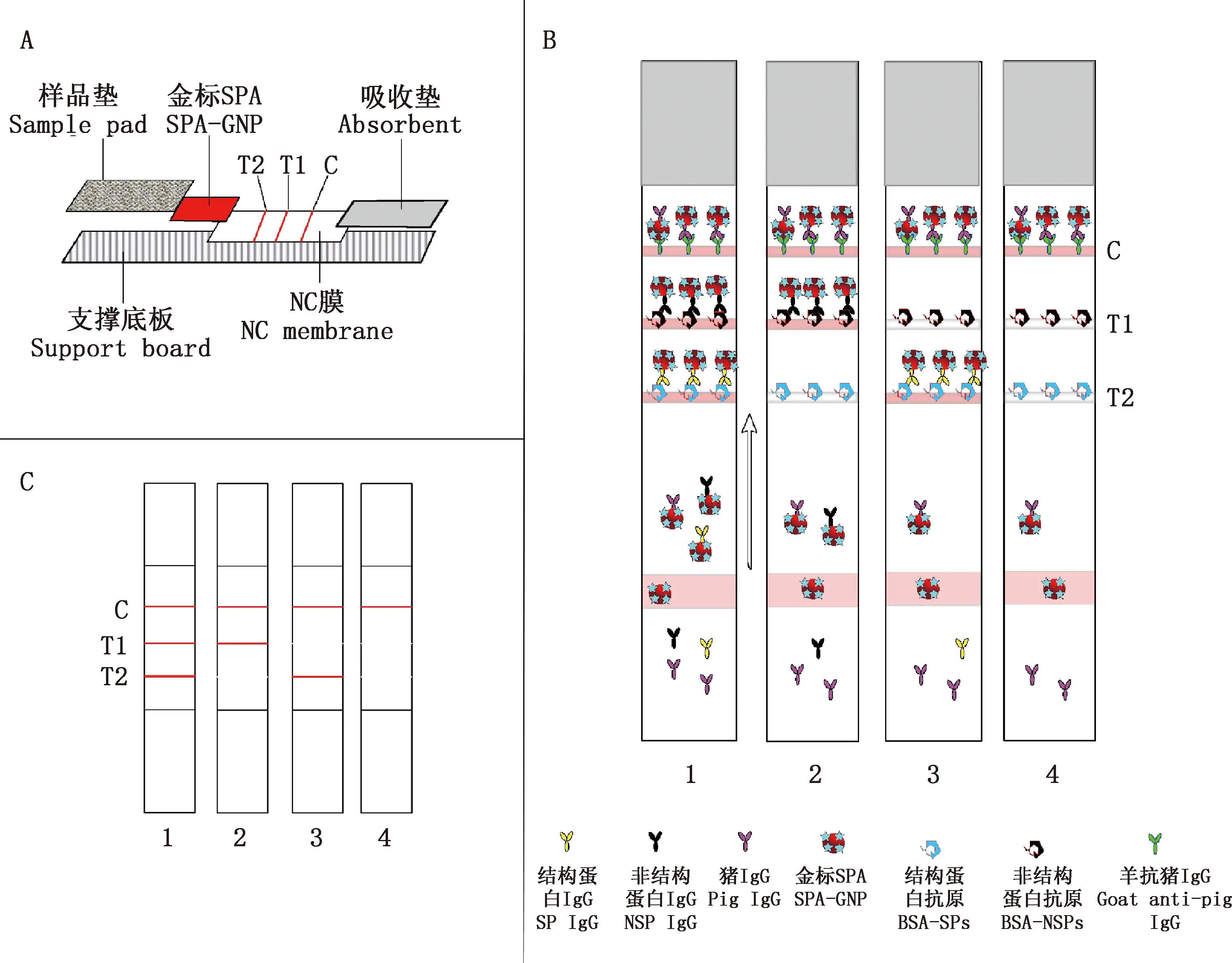
①A,试纸结构图;B,试纸原理图;C,试纸显色结果图。②T1检测线,非结构蛋白表位抗原(BSA-NSPs)印迹;T2检测线,结构蛋白表位抗原(BSA-SPs)印迹。1,O型FMDV感染血清检测结果;2,FMDV感染血清(O型除外)检测结果;3,O型FMDV免疫血清检测结果;4,FMDV阴性血清检测结果 ①A,Structure diagram of the test strip;B,Principle diagram of the test strip;C,Test results of the test strip.②T1 line,BSA-NSPs antigen;T2 line,BSA-SPs antigen;1,The test result of FMDV type O infected serum;2,The test result of FMDV infected but not type O serum;3,The test result of FMDV type O immunized serum;4,The test result of FMDV negative serum图1 试纸原理图Fig.1 Principle diagram of the immunocromatographic strip

表1 金标蛋白保存液配方Table 1 Formulations of colloidal gold-labeled protein preservation solution
1.3.5 多肽抗原稀释液的筛选 BSA偶联后的SP、NSP多肽抗原,用微量分光光度计测定蛋白浓度。分别用PBS、生理盐水、CBS和0.1 mol/L Tris-HCl缓冲液溶解为1 mg/mL的溶液,喷于硝酸纤维素膜(nitrocellulose membrane,NC)上,42 ℃干燥40 min,制成T1、T2印迹,组装成试验用试纸,检测免疫血清、感染血清以及阴性血清,选择特异性和灵敏度较高组对应的缓冲液为多肽抗原稀释液。
1.3.6 两条检测线(T1、T2)蛋白位置优化 多联检测中,检测线上蛋白会互相影响,从而出现假阳性或假阴性结果,为了检测结果的准确性,试验优化了拦截抗原位置。按照1.3.3、1.3.4和1.3.5筛选到的条件,在T1、T2两条检测线上分别喷涂BSA-SPs及BSA-NSPs多肽抗原,组装试纸,检测FMDV O型和A型感染血清及O型免疫血清,探索两种多肽抗原位置对检测结果的影响,确定两条检测线喷涂抗原蛋白。
1.3.7 样品垫缓冲系统的筛选 将切割好的玻璃纤维棉,分别浸泡于3种不同配方的缓冲液中(表2),5 min后取出,42 ℃鼓风干燥箱中干燥4 h,分别与制备好的各组分组装成试纸,检测试纸灵敏度,确定较优缓冲液配方。

表2 样品垫缓冲液配方Table 2 Formulations of buffer systems of sample pad
1.3.8 样品稀释液优化 血清样品的基础稀释液为生理盐水。在本试纸检测中,以生理盐水为稀释液稀释的标准血清显色稍浅,为增加显色强度,改善检测灵敏度,在生理盐水的基础上分别加入1.0% 的Tween-20和1.0% 的PEG20000配制2种新的样品稀释液,并与生理盐水对照检测效果。以猪O型FMDV阳性和阴性质控血清为样品,分别用上述3种稀释液稀释后用试纸检测,选择无非特异性且显色最深的稀释液作为样品稀释液。
1.3.9 试纸与商品ELISA试剂盒的对比试验 以优化后的试纸检测266份田间猪血清样品,并与口蹄疫O型抗体液相阻断ELISA检测试剂盒(LPB ELISA)和3ABC阻断ELISA抗体检测试剂盒(3ABC ELISA)检测结果进行对比,计算该试纸与商品ELISA试剂盒的符合率。
2 结 果
2.1 金标蛋白的优化结果
采用胶体金标记的羊抗猪IgG和SPA,对FMDV阳性血清和阴性血清的检测结果显示,金标SPA的在试纸系统中的显色较深,敏感性优于羊抗猪IgG,且无非特异反应,因此选择金标SPA作为探针用于本试纸系统,在3种不同的金标SPA用量中,0.5 μL/条显色较浅,1.5 μL/条和1.0 μL/条显色无明显差别,为保证试纸的特异性,本系统选用1.0 μL/条的金标SPA(图2)。

1,FMDV阴性血清;2,FMDV阳性血清 1,FMDV negative serum;2,FMDV positive serum图2 金标蛋白优化试验结果Fig.2 Results of gold-labeled protein optimization test
2.2 金标蛋白保存液的筛选结果
由图3可知,1号和3号金标保存液重悬金标蛋白稳定性差,已形成肉眼可见的板结,不能用于检测,2号和4号金标保存液重悬金标蛋白呈酒红色、透亮无沉淀,状态稳定,可用于检测。2号和4号金标保存液重悬金标蛋白,每条点金1 μL,检测1∶200倍稀释的FMDV阴、阳性质控血清(表3),结果显示2号保存液重悬的金标蛋白的特异性优于4号,无非特异反应,所以选用2号金标蛋白保存液。

图3 金标蛋白保存液的筛选试验Fig.3 The screening test of preservation solutions of colloidal gold-labeled protein
2.3 感染检测线多肽的筛选结果
采用偶联BSA的5种非结构蛋白多肽抗原(BSA-NSP1、BSA-NSP2、BSA-NSP3、BSA-NSP4、BSA-NSP5)检测FMDV感染血清和阴性血清,筛选结果显示,BSA-NSP1、BSA-NSP2、BSA-NSP5能与FMDV抗体特异性结合(图4)。将3种多肽抗原单独及等量混合后作为检测线,结果显示,这3种多肽抗原单独及等量混合后作为拦截线显色强弱无明显差别(图5A),可以混合使用。为了检测的广谱性,将3种多肽抗原混合(BSA-NSPs)后作为感染检测线。进一步优化喷涂量,结果显示,1.0 mg/mL蛋白喷膜时,阴性血清有非特异性显色,0.5 mg/mL蛋白喷膜时,阳性血清显色与1.0 mg/mL蛋白喷膜时无明显差异,且阴性血清无非特异性反应(图5B),因此选择0.5 mg/mL为最佳喷膜剂量。

表3 金标蛋白保存液稳定性试验结果Table 3 Stability detection results of preservation solutions of colloidal gold-labeled protein

1,FMDV O型感染血清;2,FMDV O型免疫血清;3,FMDV阴性血清。图5同 1,FMDV type O infected serum;2,FMDV type O immunized serum;3,FMDV negative serum. The same as fig.5图4 5条多肽初步筛选结果Fig.4 Preliminary screening results of the five peptides
2.4 多肽抗原稀释液的筛选
试验结果显示,4种稀释液对FMDV O型免疫血清的敏感性和特异性影响不大,敏感性都为1∶12 800,阴性血清检测结果都为阴性,无非特异性反应。检测FMDV O型感染血清时,含生理盐水、PBS和CBS的缓冲液检测结果相似,试纸灵敏度均为1∶3 200,无非特异反应。使用含Tris-HCl的稀释液时,试纸灵敏度可达1∶6 400,且无非特异反应。因此,T1、T2都用0.1 mol/L Tris-HCl配制成0.5 mg/mL的蛋白溶液(表4)。

A,多肽抗原的筛选;B,多肽抗原用量的筛选 A,Rescreening results of peptide antigen;B,Rescreening results of the amount of the peptide antigen图5 3条多肽复筛结果Fig.5 Rescreening results of the three peptides

表4 不同抗原稀释液筛选结果Table 4 Screening results of different antigen dilutions
2.5 两条检测线(T1、T2)蛋白位置优化结果
由表5可知,当T2线位置上喷涂非结构蛋白多肽抗原(BSA-NSPs),T1线上喷涂结构蛋白多肽抗原(BSA-SPs)时,检测FMDV O型免疫血清时,T2线出现非特异性反应;当T2线位置上喷涂结构蛋白多肽抗原(BSA-SPs),T1线上喷涂非结构蛋白多肽抗原(BSA-NSPs)时,检测结果准确,因此选择检测线T1为非结构蛋白多肽抗原,T2为结构蛋白多肽抗原。

表5 两条检测线位置优化试验Table 5 Position optimization test of the two test lines
2.6 样品垫缓冲系统优化结果
常用的3种试纸缓冲系统中,3号显色弱,1号检测阴性血清有很弱的非特异性,2号显色最强,且无非特异性(图6),因此选择2号试纸缓冲系统。
2.7 样品稀释液优化结果
3种样品稀释液筛选结果显示,生理盐水显色较浅,生理盐水中加入1.0%的PEG20000时有非特异性反应,加入1%Tween-20时既能增加试纸显色又无非特异性(图7),因此,选用生理盐水加1%Tween-20作为本试纸的样品稀释液。
2.8 试纸与商品ELISA试剂盒的符合率
优化后的试纸与两种商品化ELISA试剂盒对比试验结果见表6,在266份血清检测结果中,本研究优化后的试纸条与3ABC ELISA试剂盒检测结果一致的有256份,二者的符合率为96.20% (256/266),与LPB ELISA 试剂盒检测结果一致的有251份,符合率为94.36% (251/266)。

1,FMDV O型感染血清;2,FMDV A型感染血清;3,FMDV免疫血清;4,FMDV阴性血清。图7同 1,FMDV type O infected serum;2,FMDV type A infected serum;3,FMDV immunized serum;4,FMDV negative serum. The same as fig.7图6 样品垫缓冲液筛选结果Fig.6 Screening results of sample pad buffer systems
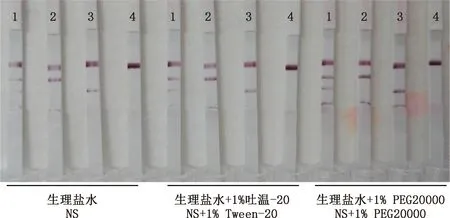
图7 样品稀释液优化试验结果Fig.7 Optimization test results of sample dilutions

表6 试纸与商品ELISA试剂盒的对比试验结果Table 6 The comparison experiment results of the strip and commercial ELISA kits 份
3 讨 论
发展中国家控制FMD的主要手段是疫苗免疫[11],对于FMDV疫苗免疫的动物,势必要做免疫效果评价和疫苗免疫动物与病毒感染动物的鉴别诊断。目前,中国通用的FMDV抗体评价的主要方法是液相阻断ELISA法,鉴别FMDV感染与免疫动物的主要方法是非结构蛋白抗体检测的间接ELISA和竞争ELISA方法[2,12],这些方法敏感且特异性好,唯一的不足就是检测周期较长,需要专业的技术人员和检测实验室。本试纸的建立和优化在借鉴这些ELISA方法的特异、敏感等优势的基础上,进一步实现了快速、简便的特点,任何人都可以随时随地进行检测,并用肉眼进行结果判断,不需要借助任何仪器[13-14]。
目前关于抗体检测的产品多为单靶标检测,大大影响了免疫层析检测的快速及简便性,也增加了检测的成本,建立多联检测已经成为免疫层析试纸发展的趋势[15]。但是成功制备多联检测免疫层析试纸是一个具有挑战的、复杂的过程,其中最关键的就是检测抗原的选择及质量,抗原的质量直接决定着产品检测的特异性及灵敏度[16];其次是免疫层析试纸的缓冲系统,包括胶体金标记、金标蛋白干燥及样品垫处理过程中的缓冲体系、蛋白、小分子保护物质、高分子聚合物及表面活性剂等,任何一个环节都将影响免疫层析试纸最终的检测灵敏度、准确性及稳定性[17-20]。
抗原蛋白是抗体检测的核心,经过鉴定、筛选、优化得到了能与FMDV抗体特异性结合的表位多肽,为使多肽更加稳定,通过偶联技术将其与载体蛋白偶联制备了稳定的抗原蛋白。此外,制备本试纸的难点是感染抗体和免疫抗体同步检测,所以需要同一种金标蛋白能同时结合两种抗体,同时选择的拦截线又能够准确地区分出两种抗体,因此本研究选择了间接法模式,利用SPA能够特异结合哺乳动物IgG Fc片段的特点[21],通过胶体金标记的SPA结合被检样品中的IgG,当胶体金-SPA-IgG复合物迁移至检测线抗原蛋白时,检测线上的结构蛋白抗原和非结构蛋白抗原分别结合特异性抗体,从而区分出感染抗体和免疫抗体。为使检测更加特异灵敏,本研究进一步优化了两条检测线的位置和使用比例。
本试纸通过系统地优化各种缓冲液体系、蛋白、小分子保护物质、高分子聚合物及表面活性剂等,制备了高度特异、敏感、稳定的FMDV感染与免疫鉴别诊断及免疫评价二联试纸。优化过程中发现喷膜缓冲液中离子的种类对抗原在NC膜上的结合效率有影响;样品垫缓冲系统中,缓冲液及保护蛋白的种类对试纸检测灵敏度及特异性影响较大,样品稀释液中加入Tween-20可以增加检测的灵敏度。
4 结 论
本研究经过对FMDV感染与免疫鉴别诊断及免疫评价二联试纸的优化,确定了该试纸的工艺参数:胶体金标记SPA蛋白,浓度为1 mg/mL;金标蛋白保存液选用ddH2O含15 mg/mL BSA、13.25 mg/mL Na2HPO4·12H2O、15.9 mg/mL NaH2PO4·2H2O、0.3 mg/mL NaN3和10% Trition X-100;多肽抗原稀释液为0.1 mol/L Tris-HCl,将T1、T2检测线蛋白均配制成0.5 mg/mL的蛋白溶液;样品垫缓冲液为10 mg/mL酪蛋白、5% Trition X-100、0.3 mg/mL NaN3,溶于0.02 mol/L Na2B4O7·10H2O 中;样品稀释液选用生理盐水含1.0% Tween-20溶液。经优化后的试纸与3ABC阻断ELISA抗体检测试剂盒的符合率为96.20%,与口蹄疫O型抗体液相阻断ELISA检测试剂盒的符合率为94.36%。本研究为该试纸的批量生产和产业化应用奠定了基础,为基层FMDV的检测提供稳定、特异、敏感、准确的检测方法。
