乙草胺对小鼠卵母细胞体外成熟的影响
2022-10-20赵予晗焦安惠王玉琪高青山
王 宇,赵予晗,焦安惠,王玉琪,高青山
(1.延边大学农学院,延吉 133000;2.东北寒区肉牛科技创新教育部工程研究中心,延吉 133000;3.吉林省延边黄牛种质资源保护工程研究中心,延吉 133000)
乙草胺(acetochlor)又称禾耐斯,化学式C14H20ClNO2,属于酰胺类除草剂[1],在农业生产中可用于清除一年生禾本科和阔叶杂草,如常被用于黄豆、玉米、棉花、花生等农作物的除草。因其毒性小而且除草效果非常好,因而被广泛使用。但随着乙草胺的大量使用,土壤、河流、地表水中均可检测出乙草胺的残留[2]。长江流域、黑龙江流域、松花江流域等均检出了乙草胺[3],中国31个省会城市和25个二级城市水源水及出厂水中也有不同浓度的乙草胺被检出[4]。同时大量研究表明,乙草胺具有细胞遗传毒性、生殖发育毒性、消化系统毒性等。如刘阳等[5]研究表明,经乙草胺处理后花背蟾蜍的蝌蚪期肝脏内超氧化物歧化酶(SOD)和谷胱甘肽(GSH)的表达量均降低,表明乙草胺对肝脏细胞具有氧化损伤作用。Song等[6]研究表明,乙草胺可能通过生殖细胞氧化应激,促使发生ERK-p53-Bcl-2级联反应,进而诱导小鼠精原细胞(GC-1)凋亡。Zhang等[7]研究表明,低剂量乙草胺可诱导斑马鱼卵巢卵黄原蛋白(Vtg)合成,促进卵巢发育,而高剂量乙草胺则降低卵巢抵抗氧化应激能力,破坏卵巢发育。
虽然已有研究证实乙草胺会对动物机体造成急性毒性、生殖发育毒性等,但国内外关于乙草胺对生殖系统的研究仅局限于雄性哺乳动物生殖系统,对雌性哺乳类动物卵母细胞成熟相关方面尚不清楚。本试验通过在体外培养液中添加不同浓度乙草胺,以期探究其对小鼠卵母细胞体外成熟的影响,为判定乙草胺的毒性及对动物和人类健康的危害提供参考。
1 材料与方法
1.1 材料
1.1.1 试验动物 雌性昆明小鼠60只,5~6周龄,体重20~24 g,健康状况良好,购自延边大学实验动物中心。试验前将小鼠置于延边大学实验动物中心鼠房饲养1周,适应环境。饲养在20~23 ℃环境中,光照条件为12 h光照、12 h黑暗,自由饮食。
1.1.2 主要试剂及仪器 透明质酸酶(Hy)、牛血清白蛋白(BSA)、矿物油、卵母细胞体外清洗液(M2)、M16、KSOM培养液均购自南京爱贝生物科技有限公司;活性氧(ROS)、谷胱甘肽(GSH)检测试剂盒均购自ThermoFisher公司;孕马血清促性腺激素(PMSG)购自宁波第二激素厂;乙草胺标准溶液购自上海恒远生物科技有限公司;JC-1、RNA提取试剂盒均购自Invirtrogen公司;逆转录试剂盒购自Qiagen公司;实时荧光定量PCR试剂盒购自KAPA公司。体视显微镜(SZ61)购自Olympus公司;荧光显微镜(Ti-S)购自NIKON公司;CO2细胞培养箱(Heracell 150i)购自ThermoFisher公司;恒温板(TP-UNI)购自TOKAI HIT公司;PCR仪(9902)购自Veriti公司。
1.2 方法
1.2.1 卵母细胞采集与培养 将小鼠腹腔注射10 IU PMSG,48 h后使用脱臼处死法处死,分离卵巢并置于M2液中。随后在体视显微镜下,用1 mL注射器针头刺破卵泡收集卵丘-卵母细胞复合体(COCs),用M2液清洗COCs 3遍后,将COCs分别转移至含有0(对照组)、10、50、100、130、200 μmol/L乙草胺的M16液中体外成熟培养14 h。
1.2.2 第一极体排出率统计 将培养14 h后的COCs用0.1%透明质酸酶去除卵丘,1% BSA-PBS清洗4次后,在体视显微镜下观察,统计排出第一极体的卵母细胞数量。
1.2.3 卵母细胞体外受精与培养 将雄鼠使用颈椎脱臼法处死,采用无菌操作法摘取附睾尾采集精子,并放入装有精子获能液(TYH)的培养皿中,放于培养箱进行获能。将体外培养14 h后的各组COCs取出,精子用体外受精液(HTF)清洗3次,放入已提前平衡的培养小滴(20 μL),加入20 μL密度为106/mL已获能的精子。6 h后将受精卵取出,加入少量0.1%透明质酸酶进行吹打,用KSOM培养液清洗3次后用KSOM培养液进行培养,置于37 ℃、5% CO2培养箱中培养96 h,统计各组囊胚率。通过第一极体排出率及囊胚率,筛选出适宜浓度的乙草胺用于后续试验。
1.2.4 囊胚细胞总数和细胞凋亡率测定 将培养96 h的囊胚用1% BSA-PBS清洗3次后放入3.7%多聚甲醛中室温固定15 min,用1% BSA-PBS清洗4次后放入0.1% Triton X-100中37 ℃透膜15 min,用1% BSA-PBS清洗4次放入荧光素复合剂(Fluorescein-dUTP)避光孵育1 h,用1% BSA-PBS清洗3次放入Hoechst 33342染色剂37 ℃避光孵育35 min,用1% BSA-PBS清洗3次,放于载玻片,封片进行拍照,ImageJ 1.48软件统计分析。
1.2.5 卵母细胞ROS、GSH、MMP水平的检测 将在对照组及筛选出的适宜乙草胺浓度组培养液中培养14 h的COCs用0.1%透明质酸酶去除卵丘,用1% BSA-PBS清洗3次,随后分别放入DCFH-DA、CMF2HC、JC-1染色液中,37 ℃避光孵育25 min,用1% BSA-PBS清洗4次后,分别放在荧光显微镜下拍照并用ImageJ 1.48软件进行荧光强度分析。
1.2.6 卵母细胞凋亡相关基因表达量的检测 将在对照组及筛选出的适宜乙草胺浓度组培养液中培养14 h的COCs用0.1%透明质酸酶去除卵丘,用1% BSA-PBS清洗3次,用RNA提取试剂盒提取各组卵母细胞的总RNA并反转录合成cDNA。根据GenBank中半胱氨酸天冬氨酸蛋白酶-9(Caspase-9)、B细胞淋巴瘤-2(Bcl-2)、B细胞淋巴瘤-xl(Bcl-xl)基因的序列,用Primer Premier 3.0软件设计实时荧光定量PCR引物,引物信息见表1。引物均由深圳华大基因股份有限公司合成。实时荧光定量PCR反应体系20 μL:cDNA(80 ng/μL)2 μL,上、下游引物各0.5 μL,SYBR Green 10 μL,KSF ROX High 0.2 μL,KSF ROX LOW 0.2 μL,ddH2O 6.6 μL。PCR反应程序:95 ℃ 20 s;95 ℃ 3 s,60 ℃ 20 s,72 ℃ 1 s,共40个循环。用2-ΔΔCt法计算各基因的相对表达量。

表1 引物信息Table 1 Primer information
1.2.7 数据统计分析 每个试验至少重复3次。采用SPSS 19.0软件进行单因素方差分析,用LSD法进行组间多重比较。P<0.05表示差异显著。
2 结 果
2.1 乙草胺对小鼠卵母细胞第一极体排出率的影响
与对照组相比,10、50 μmol/L乙草胺组卵母细胞第一极体排出率无显著差异(P>0.05);100、130、200 μmol/L乙草胺组卵母细胞第一极体排出率显著降低(P<0.05)(图1)。
2.2 乙草胺对小鼠早期胚胎发育能力的影响
由图2可知,与对照组相比,10、50 μmol/L乙草胺组囊胚率无显著差异(P>0.05),100、130 μmol/L乙草胺组囊胚率显著降低(P<0.05),200 μmol/L乙草胺组体外受精胚胎未发育到囊胚期。由于100、130 μmol/L乙草胺不仅可以使卵母细胞第一极体排出率显著降低,而且卵母细胞受精后可发育为囊胚,因此用于后续研究。

数据肩标不同字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)。下同 Values with different letter superscripts mean significant difference (P<0.05);While with the same letter superscripts mean no significant difference (P>0.05).The same as below图1 各组小鼠卵母细胞第一极体排出率Fig.1 The first polar body excretion rates of mice in each group
2.3 乙草胺对小鼠卵母细胞ROS水平的影响
与对照组相比,100、130 μmol/L乙草胺组ROS水平显著升高(P<0.05),100与130 μmol/L乙草胺组间无显著差异(P>0.05)(图3)。

A~C,分别代表对照组、100和130 μmol/L乙草胺组ROS水平染色图片(100×);D,各组ROS水平 A-C,The ROS staining pictures of the control group,100 and 130 μmol/L acetochlor groups,respectively (100×);D,ROS levels in each group图3 各组小鼠卵母细胞ROS水平Fig.3 ROS levels of mouse oocytes in each group
2.4 乙草胺对小鼠卵母细胞GSH水平的影响
与对照组相比,100、130 μmol/L乙草胺组GSH水平显著降低(P<0.05),100与130 μmol/L乙草胺组间无显著差异(P>0.05)(图4)。

A~C,分别代表对照组、100和130 μmol/L乙草胺组GSH水平染色图片(100×);D,各组GSH水平 A-C,Represent the GSH staining pictures of the control group,100 μmol/L and 130 μmol/L acetochlor groups,respectively (100×);D,GSH levels in each group图4 各组小鼠卵母细胞GSH水平Fig.4 GSH levels of mouse oocytes in each group
2.5 乙草胺对小鼠卵母细胞MMP水平的影响
与对照组相比,100、130 μmol/L乙草胺组MMP水平显著降低(P<0.05),且130 μmol/L乙草胺组卵母细胞MMP水平显著低于100 μmol/L乙草胺组(P<0.05)(图5)。

A,对照组、100和130 μmol/L乙草胺组MMP水平染色图片(200×);B,各组MMP水平 A,The staining pictures of MMP levels in control group,100 and 130 μmol/L acetochlor groups (200×);B,MMP levels in each group图5 各组小鼠卵母细胞MMP水平Fig.5 MMP levels of mouse oocytes in each group
2.6 乙草胺对小鼠卵母细胞凋亡相关基因表达的影响
与对照组相比,100、130 μmol/L乙草胺组卵母细胞Caspase-9基因相对表达量显著高于对照组(P<0.05);100、130 μmol/L乙草胺组卵母细胞Bcl-2、Bcl-xl基因相对表达量显著低于对照组(P<0.05)(图6)。
2.7 乙草胺对小鼠早期胚胎发育质量的影响
与对照组相比,100、130 μmol/L乙草胺组囊胚细胞总数显著降低(P<0.05),且130 μmol/L 乙草胺组囊胚细胞总数显著低于100 μmol/L乙草胺组(P<0.05);100、130 μmol/L乙草胺组囊胚内细胞凋亡率显著升高(P<0.05),且130 μmol/L 乙草胺组囊胚内细胞凋亡率显著高于100 μmol/L乙草胺组(P<0.05)(图7)。

图6 各组小鼠卵母细胞凋亡相关基因的相对表达量Fig.6 Relative expression of apoptosis-related genes in mouse oocytes in each group
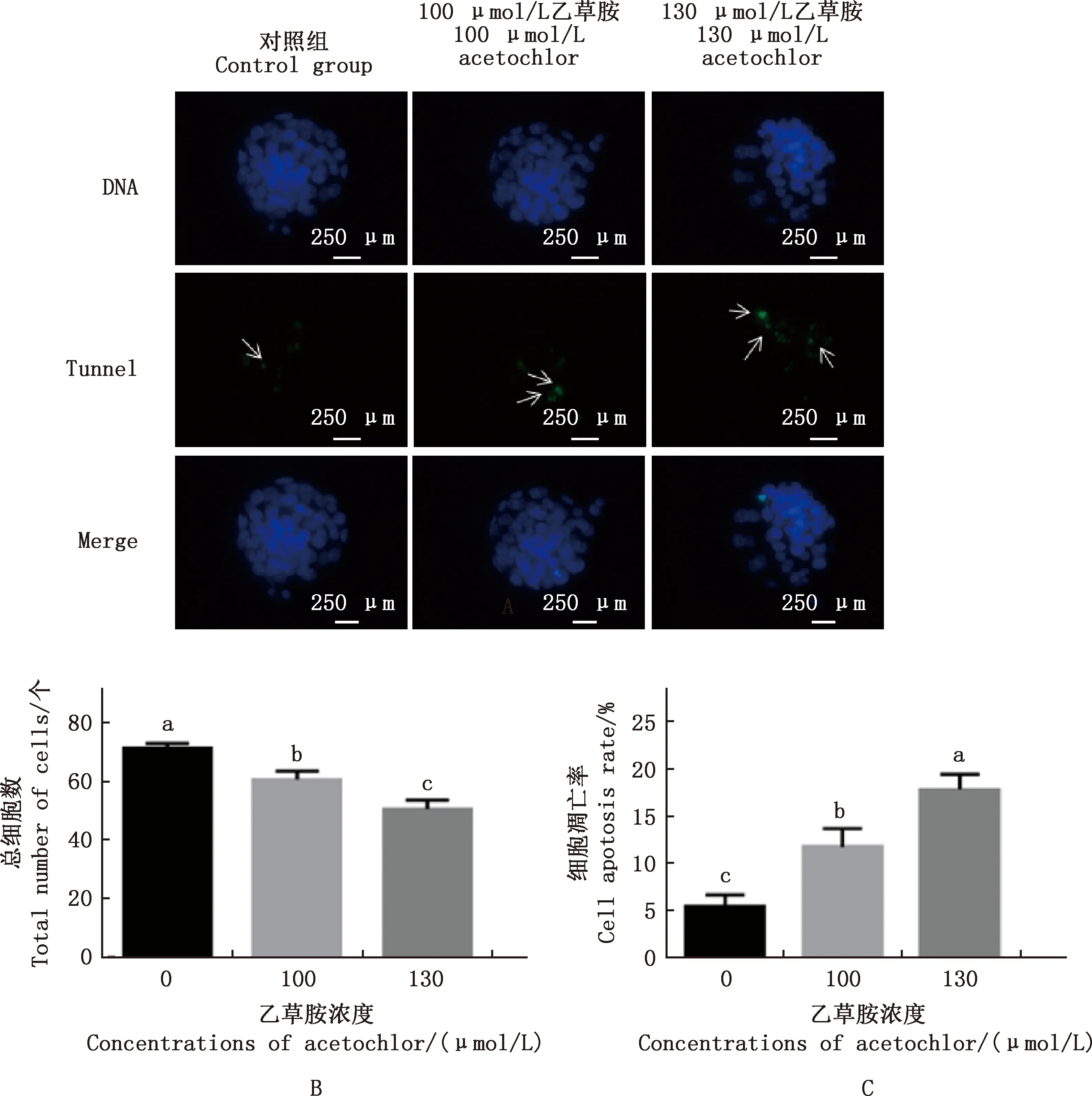
①A,对照组、100和130 μmol/L乙草胺组囊胚Hoechst 33342和Tunnel染色(400×);B,各组囊胚内细胞团细胞数;C,各组细胞凋亡率。②箭头代表凋亡细胞 ①A,Blastocyst Hoechst 33342 and Tunnel staining were performed in control group and 100 and 130 μmol/L acetochlor groups (400×);B,The number of cells in the blastocyst inner cell mass in each group;C,The apoptosis rate in each group.②Arrows represent apoptotic cells图7 各组小鼠囊胚细胞总数及细胞凋亡率Fig.7 The total number of blastocyst cells and the apoptosis rate of mouse blastocysts in each group
3 讨 论
辅助生殖技术在当今社会迅速发展,卵母细胞排出第一极体作为判断卵母细胞是否成熟的重要标准[8],是后期胚胎形成的关键前提[9-10]。本试验首先研究了不同浓度乙草胺对小鼠卵母细胞成熟的情况,结果表明,100、130、200 μmol/L乙草胺组卵母细胞第一极体排出率显著低于对照组,说明乙草胺可能阻滞了卵母细胞成熟的进程。进一步将卵母细胞进行体外受精,发现100、130 μmol/L乙草胺组囊胚率显著低于对照组,200 μmol/L乙草胺组未发育到囊胚期,这可能是由于乙草胺对卵母细胞的毒性作用导致的。将囊胚进行dUTP和Hoechst 33342染色,结果显示,100、130 μmol/L乙草胺组囊胚细胞总数比对照组显著降低,100、130 μmol/L乙草胺组囊胚内细胞凋亡率比对照组显著升高,说明乙草胺对小鼠卵母细胞的成熟具有毒性作用,并且这种毒性作用将持续影响卵母细胞受精后的发育潜力。杨晓梅等[11]研究表明,不同浓度乙草胺对中华大蟾蜍不同时期的早期胚胎均具有明显致死作用,与本试验结果相符。因此,在体外培养过程中添加100 μmol/L乙草胺即可降低卵母细胞成熟和后期胚胎发育潜能。
氧化应激是影响卵母细胞成熟的主要因素之一,绝大多数农药的残留会导致动物机体产生氧化应激[12-14]。ROS的形成是生命机体基础代谢所产生的正常现象,但是过量ROS会破坏机体氧化还原平衡,线粒体功能损伤和细胞凋亡[15]。本试验结果表明,100、130 μmol/L乙草胺组卵母细胞ROS水平显著高于对照组,说明乙草胺可以诱导小鼠卵母细胞发生氧化应激。GSH在细胞氧化还原平衡维持中发挥重要作用,参与清除机体内过量ROS,具有天然的抗氧化功能[16]。本试验结果表明,100、130 μmol/L乙草胺组GSH水平显著低于对照组,说明乙草胺破坏了小鼠卵母细胞的氧化平衡状态。蒋青桃等[17]研究表明,乙草胺对小鼠氧化应激促进精原细胞的死亡;李龙雪等[18]研究表明,乙草胺通过引起大鼠肝脏细胞的氧化应激,促进肝脏损伤。这些研究结果与本试验研究结果相符,说明乙草胺可以改变细胞氧化-还原稳态的作用,也揭示了乙草胺导致卵母细胞发育阻滞的内在原因。当细胞产生氧化应激时,细胞中的线粒体功能会受到损伤。线粒体是完成细胞内能量转换的重要场所,参与细胞内氧化-还原平衡及信号传导[19-20]。MMP水平的高低会影响细胞的生存能力[21]。Torner等[22]研究表明,在卵母细胞体外成熟过程中存在着活跃线粒体分布变化,并且线粒体在胞质中的分布状态与卵母细胞质量直接相关。本试验结果表明,100、130 μmol/L乙草胺组卵母细胞MMP水平显著降低,表明100 μmol/L乙草胺即可引起的线粒体膜电位障碍,从而干扰卵母细胞成熟。
细胞凋亡是基因控制下的细胞程序性死亡,用于选择清除衰老或变异的细胞[23]。据报道,接触乙草胺会促使小鼠睾丸细胞产生凋亡[24]。本研究结果显示,100、130 μmol/L乙草胺组小鼠卵母细胞促凋亡基因Caspase-9的转录水平显著升高,抗凋亡基因Bcl-xl及Bcl-2转录水平显著降低。这表明100 μmol/L乙草胺即可通过影响凋亡相关因子mRNA的转录水平降低卵母细胞的质量。
4 结 论
在卵母细胞体外成熟过程中添加100 μmol/L乙草胺即可降低卵母细胞第一极体排出率,产生高水平的ROS、造成线粒体功能损伤及细胞凋亡,推测这是乙草胺暴露导致卵母细胞发育阻滞的潜在机制,结果可为研究体内乙草胺对卵母细胞质量的影响提供参考。
