柠檬苦素对小鼠卵母细胞体外成熟及其体外受精胚胎发育的影响
2022-10-20焦安惠张笑梦赵予晗高青山
焦安惠,张笑梦,赵予晗,王 宇,高青山
(1.延边大学农学院,延吉 133000;2.东北寒区肉牛科技创新教育部工程研究中心,延吉 133000;3.吉林省延边黄牛种质资源保护工程研究中心,延吉 133000)
哺乳动物卵母细胞成熟的质量是影响受精和胚胎发育潜能的主要因素[1-2]。卵母细胞体外成熟(IVM)技术是目前研究中应用最广泛的人工生殖技术之一[3]。在体外成熟过程中,由于脱离相对稳定的母体低氧环境,卵母细胞内维持氧化还原稳态的抗氧化系统受损,导致活性氧(ROS)堆积,造成氧化应激[4]。抗氧化系统由多种抗氧化基因调控,包括内源性抗氧化酶及抗氧化剂,如过氧化氢酶(CAT)、过氧化物还原酶-3(Prdx3)、谷胱甘肽过氧化物酶3(GPx3)及谷胱甘肽(GSH)等[5]。CAT在细胞中分布广泛,主要存在于过氧化物酶体、胞质和线粒体中,将过氧化氢(H2O2)分解为氧气和水[6]。H2O2是丰度最高的ROS分子之一,通过芬顿效应可导致细胞DNA损伤和细胞凋亡[7]。Prdx3可以通过催化过氧化氢和烷基过氧化氢的还原来调节细胞内的活性氧水平,在卵母细胞成熟和胚胎发育中起着重要作用[8]。GPx能催化GSH形成氧化型谷胱甘肽(GSSG),将氧化物还原为羟基化合物,是生物机体抗氧化指标之一。当ROS积累超过内源性抗氧化系统的清除能力会导致连锁反应并最终导致细胞结构的损伤[9],破坏线粒体功能,促使细胞凋亡,从而降低卵母细胞的质量,影响早期胚胎发育潜力。线粒体作为细胞中重要的能量供应来源,也是ROS的主要内源性来源,有促进Ca2+稳态以及参与细胞凋亡等功能[3]。由线粒体介导的半胱天冬酶级联激活是体外培养卵母细胞发生凋亡的主要途径之一。该途径基本上由细胞色素C的传递和半胱天冬酶的激活控制。线粒体在这一凋亡途径中起着不可替代的作用。B淋巴细胞瘤-2(Bcl-2)家族通过促凋亡和抗凋亡成员之间的平衡在调节细胞死亡中发挥关键作用[10]。B淋巴细胞瘤-xl(Bcl-xl)是Bcl-2家族成员,Bcl-xl和Bcl-2具有抑制凋亡的作用,Bcl-xl的高表达可以抑制细胞色素C的释放,从而抑制细胞凋亡。半胱氨酸蛋白酶-3(Caspase-3)是细胞凋亡过程中最重要的末端剪接酶,具有不可替代的作用。激活的Caspase-3是细胞凋亡的关键执行者[11]。
氧化应激是影响卵母细胞体外成熟与发育的主要因素[4]。近年来,大量研究表明,在体外成熟培养液中添加抗氧化剂可有效降低氧化应激损伤,从而提高体外受精胚胎的发育潜力[12]。如褪黑素[13]、白藜芦醇[14]、槲皮素[15]和黄连素[16]等。柠檬苦素(Lim)又称吴茱萸内酯、黄柏内酯,是一种从中药和柑橘类水果中提取的天然高度氧化的四环三萜类化合物[17-18]。目前已知的柠檬苦素类化合物大约有300余种,按其结构划分为三类:柠檬苦素苷元、降解型柠檬苦素和糖苷型柠檬苦素。Lam等[19]发现,Lim类化合物可以通过GST(谷胱甘肽转移酶)促进GSH与人体中具有较高亲和力的致癌物相连接,减少其毒性和增加其可溶性。Murthy等[20]发现,Lim能够诱导内源性凋亡通路的活化,下调Bcl-2/Bax比率,促使细胞色素C从线粒体内释放,但不会对Caspase-8的表达产生影响。已有研究发现,Lim具有抑制肿瘤细胞增殖[21]、抗炎、抗氧化、抗菌、抗肺纤维化的药理作用[22-24]。除上述作用外,Lim类化合物还具有镇痛、降低胆固醇,保护肝脏损伤[25]、防止动脉粥样硬化等作用[26]。
Lim能有效抑制ROS的产生,快速淬灭自由基[27],其修复氧化损伤的功能已受到越来越多研究人员的关注,但在动物生殖领域特别雌性配子发育过程中的具体作用鲜有研究。为了缓解氧化应激损伤,改善卵母细胞质量,从而提高体外受精胚胎的发育潜力,本试验以小鼠为研究对象,在体外成熟培养液中添加Lim,探讨Lim对小鼠卵母细胞及后续体外受精早期胚胎发育的影响,为优化卵母细胞体外成熟体系提供理论依据。
1 材料与方法
1.1 材料
1.1.1 动物 6~7周龄雌性昆明小鼠,体重22~26 g,购自延边大学动物中心。小鼠饲养环境温度维持在23~26 ℃,人工光照(黑暗、光照各12 h),饲喂普通繁殖饲料,自由采食和饮水。
1.1.2 主要试剂及仪器 柠檬苦素(Acmec公司);M2操作液、M16体外成熟培养液、KSOM胚胎培养液、TYH精子获能培养液、HTF受精培养液(南京爱贝生物技术有限公司);细胞内ROS检测试剂(DCFH-DA,南京建成生物工程研究所有限公司);细胞内谷胱甘肽检测试剂(CMF2HC,ThermoFisher公司);线粒体膜电位检测试剂(JC-1)、mRNA提取试剂盒(Invitrogen公司);逆转录试剂盒(Qiagen公司);实时荧光定量PCR试剂(KAPA公司);福尔马林(FA)、Triton X-100、Hoechst 33342 试剂(Sigma-Aldrich公司);TUNEL试剂盒(Roche公司)。体视显微镜(Olympus公司);免疫荧光显微镜(Nikon公司);PCR仪(Veriti公司);二氧化碳培养箱(ThermoFisher公司);可调移液枪(RAININ公司);恒温板(TOKAI HIT公司)。
1.2 最适Lim浓度筛选
将6~7周龄雌性昆明小鼠腹腔注射10 IU孕马血清促性腺激素(PMSG)进行超数排卵,48 h后采用颈椎脱臼法处死,摘取双侧卵巢,用M2操作液清洗2次,用1 mL注射器针头在体视显微镜下刺破卵泡,释放卵丘-卵母细胞复合体(COCs)。将包裹3层以上卵丘细胞的COCs用预平衡的M16培养液清洗5次,放入提前2 h预平衡的添加0(对照组)、10、20、50 μmol/L Lim的M16培养小滴中,置37 ℃、5% CO2培养箱中培养。12 h后,用0.1%透明质酸酶(Hy)消化卵丘颗粒细胞,用1% BSA-PBS清洗4次,统计各组小鼠卵母细胞第一极体(PBI)排出率,以确定后续试验的最适Lim浓度。
1.3 Lim对卵母细胞体外成熟的影响
1.3.1 Lim对卵母细胞内ROS和GSH水平的影响 按照1.2的方法将COCs进行12 h 体外成熟培养后去除卵丘颗粒细胞,将卵母细胞分为对照组及最适Lim浓度组,分别用1% BSA-PBS按1∶1 000稀释DCFH-DA、CMF2HC染色剂,将卵母细胞用1% BSA-PBS清洗4次后置于稀释好的染色剂中,38 ℃避光孵育20 min,用 1% BSA-PBS清洗4次,置于荧光显微镜下观察并采集图像。
1.3.2 Lim对卵母细胞内MMP水平的影响 按照1.2的方法将COCs进行12 h体外成熟培养后去除卵丘颗粒细胞,将卵母细胞分为对照组及最适Lim浓度组,分别用1% BSA-PBS按1∶1 000稀释JC-1染色剂,将卵母细胞用1% BSA-PBS清洗4次后置于稀释好的染色剂中,38 ℃避光孵育20 min,用 1% BSA-PBS清洗4次,置于荧光显微镜下观察并采集图像。红色荧光代表线粒体高电位,绿色荧光代表线粒体低电位,以红荧光强度/绿荧光强度表示MMP水平。
1.3.3 Lim对卵母细胞抗氧化及凋亡相关基因表达水平的影响 按照1.2的方法将COCs进行12 h体外成熟培养后去除卵丘颗粒细胞,将卵母细胞分为对照组及最适Lim浓度组,每组收集20个成熟卵母细胞,在1% BSA-PBS中清洗3次,将样本放置于50 μL裂解液中裂解。使用DynaBeads mRNA Direct Kit试剂盒提取RNA并反转录合成cDNA。根据GenBank中GPx3、CAT、Prdx3、Bcl-2、Bcl-xl和Caspase-3基因序列,利用Primer Premier 5.0软件设计引物,引物信息见表1。引物均由华大基因科技有限公司合成。PCR反应体系20 μL:cDNA 2 μL,SYBR Mix 10 μL,上、下游引物各0.8 μL,ROX Low 0.4 μL,ddH2O 6.8 μL。PCR反应程序:95 ℃ 3 s,60 ℃ 20 s,72 ℃ 1 s。用2-ΔΔCt法计算各基因的相对表达量。

表1 引物信息Table 1 Primer information
1.3.4 成熟液中添加Lim对早期胚胎发育能力的影响 按照1.2的方法将COCs进行体外成熟培养,培养24 h后将卵母细胞分为对照组及最适Lim浓度组。选取10周龄健康雄鼠采取颈椎脱臼法处死,取出双侧附睾尾,用1 mL注射器针头刺破附睾尾释放精子,将精子团引入平衡后的TYH培养小滴中获能1~1.5 h。吸取获能精子,放入HTF微滴中精卵共孵育6 h后,将受精卵移至预平衡的KSOM微滴中,放入培养箱中继续培养,在培养的24、96 h统计卵裂率和囊胚率。将对照组和试验组的囊胚分别在多聚甲醛溶液(浓度为3.7%)中室温固定20 min后,用1% BSA-PBS清洗3次移至1% BSA-PBS中封闭1 h,用0.5% Triton X-100室温透膜40 min,用1% BSA-PBS清洗3次后,用1% BSA-PBS封闭1 h,将Fluorescein-dUTP与脱氧核苷酸转化酶18∶2混合均匀,38 ℃避光染色1 h;用1% BSA-PBS清洗3次,放入1% BSA-PBS中38 ℃封闭1 h;用Hoechst 33342在38 ℃下避光染色20 min;用1% BSA-PBS清洗3次进行封片,在荧光显微镜下观察并统计囊胚总细胞数及凋亡细胞数。
1.4 数据统计与分析
各试验进行4次以上重复。用SPSS 19.0软件进行单因素方差分析,组间差异用t检验进行比较。结果用平均值±标准差表示。用GraphPad Prism 5.0软件作图。P<0.05表示差异显著。
2 结 果
2.1 添加不同浓度Lim对卵母细胞体外成熟的影响
由图1可知,与对照组相比,20 μmol/L Lim组PBI排出率显著升高(P<0.05),而10、50 μmol/L Lim组PBI排出率均无显著差异(P>0.05)。因此,后续试验均在成熟培养液中添加20 μmol/L Lim。
2.2 添加Lim对卵母细胞内ROS和GSH水平的影响
由图2可知,20 μmol/L Lim组ROS荧光强度低于对照组,20 μmol/L Lim组GSH荧光强度高于对照组(图2A);与对照组相比,Lim组ROS水平显著降低(P<0.05)(图2B),Lim组GSH水平显著增加(P<0.05)(图2C)。
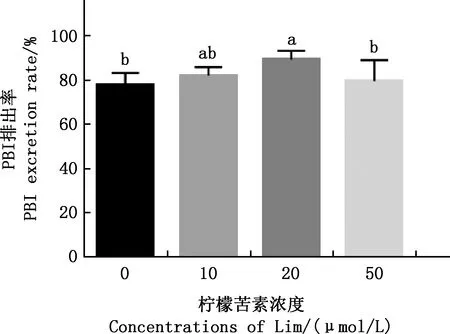
肩标不同字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)。下同 Values with different letter superscripts mean significant difference (P<0.05);While with the same letter superscripts mean no significant difference (P>0.05).The same as below图1 各组小鼠卵母细胞PBI排出率Fig.1 PBI excretion rate of mouse oocytes in each group

A,ROS、GSH荧光染色(100×);B,ROS相对水平;C,GSH相对水平 A,ROS and GSH fluorescence staining (100×);B,Relative level of ROS;C,Relative level of GSH图2 各组小鼠卵母细胞的ROS和GSH水平Fig.2 ROS and GSH levels of mouse oocytes in each group
2.3 添加Lim对卵母细胞内MMP水平的影响
由图3可知,20 μmol/L Lim组MMP的高、低电位水平均高于对照组(图3A);与对照组相比,Lim组小鼠卵母细胞MMP水平显著升高(P<0.05)(图3B)。
2.4 添加Lim对卵母细胞抗氧化及凋亡相关基因表达水平的影响
由图4可知,与对照组相比,20 μmol/L Lim组小鼠卵母细胞抗氧化相关基因GPx3、CAT和Prdx3及抗凋亡相关基因Bcl-2、Bcl-xl的表达水平均显著上调(P<0.05),促凋亡相关基因Caspase-3的表达水平显著下调(P<0.05)。
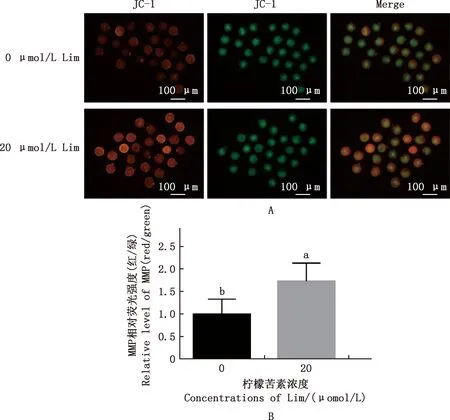
A,MMP荧光染色(100×);B,MMP相对荧光强度 A,MMP fluorescence staining(100×);B,MMP relative fluorescence intensity图3 各组小鼠卵母细胞的MMP水平Fig.3 MMP levels of mouse oocytes in each group

图4 各组小鼠卵母细胞抗氧化及凋亡相关基因相对表达量Fig.4 Relative expression of antioxidant and apoptosis-related genes of mouse oocytes in each group
2.5 在体外成熟期间添加Lim对体外受精早期胚胎发育的影响
由图5可知,20 μmol/L Lim组囊胚内细胞数多于对照组,凋亡细胞数低于对照组(图5A);与对照组相比,20 μmol/L Lim组卵裂率、囊胚率和囊胚总细胞数均显著增加(P<0.05)(图5B~5D),凋亡率显著降低(P<0.05)。

A,囊胚染色(200×);B,卵裂率;C,囊胚率;D,囊胚总细胞数;E,囊胚内凋亡细胞比率 A,Staining of blastocyst (200×);B,Cleavage rate;C,Blastocyst rate;D,Total cell number of blastocyst;E,Ratio of apoptotic cells in blastocyst图5 各组体外受精胚胎体外发育情况Fig.5 In vitro development of in vitro fertilization embryos in each group
3 讨 论
卵母细胞的成熟是胚胎发育的基石,体外成熟培养引起的氧化应激是卵母细胞成熟的关键问题之一。尽管科研人员为体外培养体系优化做出巨大努力,但体外生产的囊胚数量和质量仍落后于体内生产的囊胚,其差异主要表现在形态、代谢、基因表达和低温耐受性等方面,各个发育阶段产生的负面影响都会对后续发育造成连锁反应。本试验结果表明,在体外成熟期间补充Lim对小鼠卵母细胞的成熟产生有利影响,增强了体外受精胚胎的卵裂率、囊胚率及囊胚内细胞数。小鼠受精能力是胚胎发育关键步骤,在此时期细胞的发育容易受到氧化应激的干扰导致发育阻滞,氧化应激是二细胞胚胎中细胞周期停滞的主要原因之一[28]。本研究结果与使用其他抗氧化剂,如白藜芦醇[14]、虾青素[29]的研究结果一致。说明在体外成熟培养液中添加Lim可促进卵母细胞成熟,从而提高后续胚胎的发育潜力。
与体内环境相比,体外培养过程中卵母细胞抗氧化能力降低,从而导致卵母细胞更易受到氧化应激的影响。卵母细胞中ROS水平升高会导致细胞膜损伤、DNA突变和断裂,以及线粒体功能障碍,最终导致卵母细胞减数分裂停滞和胚胎发育受阻。GSH是一种直接抗氧化剂和几种抗氧化酶的底物,因其本身含有巯基极易被氧化,所以具有清除自由基以及保护蛋白质和酶等生物大分子巯基的功能。GSH水平的高低是卵母细胞胞质成熟和影响卵母细胞还原能力的重要因素,间接反映了卵母细胞发育至囊胚阶段的潜力[30]。本试验中,Lim促进GSH生成,缓解了ROS过度积累,这与Li等[18]用Lim处理肝脏细胞减少ROS的积累、恢复部分GSH的结果一致。本试验中,Lim提高了小鼠卵母细胞抗氧化相关基因GPx3、CAT和Prdx3的mRNA表达水平。Ishak等[31]研究发现,用Lim治疗小鼠结直肠癌(CRC)可上调抗氧化相关基因mRNA表达,与本试验结果一致。上述结果说明Lim在小鼠卵母细胞成熟过程中通过上调抗氧化相关基因参与了氧化还原稳态的调节,提高了小鼠卵母细胞抗氧化能力。
成熟卵母细胞和随后胚胎发育高度依赖于线粒体,因其自身DNA (mtDNA)不受组蛋白保护而易受到氧化应激的影响[32]。MMP是线粒体依靠呼吸链在内膜间形成的电势差,是线粒体氧化磷酸化和形成ATP的源动力[33]。本试验结果发现,添加Lim可显著提高卵母细胞MMP水平,这与褪黑素[34]、原花青素B1[35]等抗氧化剂通过提高MMP水平而提升卵母细胞质量的相关报道一致。本研究结果表明,小鼠卵母细胞体外成熟期间用Lim处理可以显著改善线粒体功能,减少氧化应激的影响,提高卵母细胞发育能力。
氧化应激导致高水平的ROS通过损害卵母细胞和胚胎中的线粒体活性,导致细胞DNA被破坏和细胞色素C的释放,破坏线粒体膜结构,从而促使细胞凋亡发生[36]。本试验中添加Lim处理后,小鼠卵母细胞的抗凋亡相关基因Bcl-2、Bcl-xl的mRNA表达水平提高,促凋亡相关基因Caspase-3的mRNA表达水平降低。Mahmoud等[37]发现,在大鼠肝细胞中添加Lim可降低凋亡标志基因Caspase-3的表达,表明Lim在缺血性肝脏中发挥抑制细胞凋亡的作用,这与本研究结果一致。本试验还发现,添加Lim可以降低囊胚内凋亡细胞比率。卵母细胞中凋亡相关基因mRNA表达水平和囊胚凋亡结果均证明添加Lim可抑制卵母细胞发育至囊胚过程中的细胞凋亡。
4 结 论
在体外成熟培养液中添加20 μmol/L Lim可以保护卵母细胞在体外成熟培养过程中免受氧化应激损伤、提高抗氧化能力、增强线粒体功能、降低细胞凋亡水平,提高卵母细胞成熟质量从而提高体外受精胚胎的发育潜力。
