水牛MFSD2A基因多态性及其与产奶性状的关联分析
2022-10-20梁莎莎庞春英邓廷贤陆杏蓉段安琴马小娅方艳艳梁贤威
梁莎莎,庞春英,邓廷贤,陆杏蓉,段安琴,马小娅,方艳艳,梁贤威
(中国农业科学院广西水牛研究所,广西水牛遗传繁育重点实验室,南宁 530001)
水牛以耐粗饲而著称,具有适应性强、耐高温高湿、抗病力强和易饲养等特点。水牛奶含有较高的乳脂肪(8.0%)、乳蛋白(4.5%)、不饱和脂肪酸,以及较低的磷脂和胆固醇水平[1],具有重要的经济价值。然而水牛平均产奶量却远低于荷斯坦奶牛,因此,提高水牛泌乳性能至关重要,挖掘与产奶性状相关的候选基因有助于改善水牛泌乳性能。
主要促进因子超家族成员2a(major facilitator superfamily domain containing 2a,MFSD2A)是一种膜转运蛋白,属于次级转运蛋白的主要促进因子超家族[2-3]。Sánchez-Campillo等[4]研究发现,母体血液中MFSD2A的水平可作为一种潜在的生物标记物,用于早期检测妊娠期间MFSD2A表达紊乱及其对儿童神经发育的影响。脂质组学分析表明,MFSD2A基因敲除小鼠大脑中二十二碳六烯酸(DHA)水平显著降低,并伴有海马区和小脑区神经细胞丢失,以及认知障碍和严重焦虑[5]。作为一种脂质转运蛋白,MFSD2A在哺乳动物主要促进剂超家族(MFS)成员中是独一无二的,通常运输可溶性底物[6]。MFSD2A在脂肪代谢和能量消耗中具有潜在的作用,有研究表明MFSD2A基因敲除小鼠(禁食20 h)与野生型小鼠相比,空腹血浆甘油三酯(TG)显著降低[7],而甘油三酯也是乳脂的重要组成部分,因此MFSD2A基因有可能对乳汁中的乳脂含量产生影响。但是目前鲜有MFSD2A基因在哺乳动物产奶性状方面的研究,在水牛上的更是寥寥无几。水牛MFSD2A基因定位于6号染色体,全长12 791 bp,共有14个外显子。本试验利用PCR扩增技术对水牛MFSD2A基因各个外显子及部分内含子序列进行SNP位点筛选,利用Sequenom MassARRAY SNP飞行时间质谱技术对突变位点进行基因型检测,研究MFSD2A基因多态性及其与乳脂率等产奶性状的关联性,旨在从分子水平挖掘与产奶性状相关的标记,为水牛产奶性状的分子标记辅助选择提供理论基础。
1 材料与方法
1.1 材料
于广西水牛研究所种畜场随机选取383头饲养管理水平一致的水牛,其中包含3个纯种(摩拉水牛、尼里-拉菲水牛和地中海水牛)以及2个杂交品种(摩拉尼里杂交水牛和地中海杂交水牛)。采取颈静脉采血方式,每个个体抽取5 mL血液保存于真空采血管中(含EDTA抗凝剂),4 ℃保存。此外收集其中315头水牛的产奶性状表型数据(305 d产奶量、乳脂率、乳蛋白率和乳尿素氮)用于统计分析。
1.2 主要试剂
动物血液基因组DNA提取试剂盒购自天根生物科技(北京)有限公司;PremixTaq酶购自TaKaRa公司。
1.3 血液DNA提取和PCR扩增
采用动物血液基因组DNA提取试剂盒进行水牛基因组DNA样本的抽提,并结合NanoDrop2000紫外分光光度计和1.0%琼脂糖凝胶电泳进行基因组DNA样本的质控。质控后的基因组DNA样本稀释至30~50 ng/μL,随机选取50个样本,每个样本取10 μL混合作为DNA混合池。
参考GenBank数据库中水牛MFSD2A基因序列(登录号:XM_025289025.1),使用Primer Premier 3.0软件设计该基因14个外显子(包含每个外显子上下游200 bp的内含子序列)的引物序列,以水牛DNA样本混合池为模板进行PCR扩增。引物信息见表1。引物均由深圳华大基因生物科技公司合成。PCR反应体系50 μL:DNA模板1 μL,PremixTaq酶25 μL,上、下游引物各2 μL,ddH2O 20 μL。PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸8 min。取10 μL PCR扩增产物进行1.0%琼脂糖凝胶电泳检测后,委托深圳华大基因生物科技公司进行测序。

表1 水牛MFSD2A基因SNP筛选引物信息Table 1 Primer information for SNP screening of MFSD2A gene in buffalo
1.4 SNP筛选及基因分型
使用DNA Star-SeqMan软件对序列峰图进行比对分析,筛选SNP位点。将检测合格的383个DNA样本送至北京康普森生物技术有限公司,利用Sequenom MassARRAY飞行时间质谱技术对筛选的SNP位点进行分型。相关分型引物序列见表2,引物均由深圳华大基因生物科技公司合成。

表2 用于SNP分型的扩增引物和延伸引物Table 2 Amplification primers and extension primers for SNP genotyping
1.5 统计分析
1.5.1 产奶数据整理 使用Excel对产奶数据进行整理,胎次水平依据自然胎次划分,前7个胎次用1、2、3、4、5、6、7(超过7的也划为7胎次)表示;季节按春季(3~5月)、夏季(6~8月)、秋季(9~11月)和冬季(12~次年2月)划分为4个季度;305 d产奶量按照《中国水牛科学》[8]中的校正方法进行校正。
1.5.2 遗传多样性分析 使用genetics R语言程序包计算多态位点的等位基因频率、基因型频率、群体杂合度(heterozygosity,He)和多态信息含量(polymorphism information content,PIC),并进行Hardy-Weinberg平衡检验。
1.5.3 SNP位点不同基因型与水牛产奶性状的关联分析 采用SAS 9.4软件的GLM过程对产奶性状和MFSD2A基因突变位点基因型进行关联分析。关联分析模型为:Yijklm=μ+Gi+Pj+Sk+Dl+Am+eijklm。其中,Yijklm为产奶性状表型记录;μ为群体平均值;Gi为基因效应;Pj为胎次效应;Sk为季节效应;Dl为泌乳天数效应;Am为年龄效应;eijklm为随机残差。各项产奶数据使用最小二乘均值±标准差表示,以P<0.05为差异显著性判断标准。
1.5.4 连锁不平衡及单倍型分析 使用Haploview4.2软件对符合Hardy-Weinberg平衡的SNP位点进行连锁不平衡(LD)及单倍型分析,单倍型模块划分按照四配子法则(four gamete rule)。单倍型与水牛产奶性状的关联分析方法同1.5.3。
2 结 果
2.1 水牛MFSD2A基因多态位点筛选
将测序结果结合DNA Star-SeqMan软件比对后,在水牛MFSD2A基因上共发现了7个SNPs位点,分别位于内含子1(g.568 C>G 和g.701 A>G)、内含子2(g.3203 T>G和g.3326 G>A)、内含子6(g.8290 T>C和g.8523 C>G)和内含子8(g.9138 G>T)(图1)。
2.2 Sequenom MassARRAY基因分型
针对筛选出的7个SNPs位点,使用Sequenom MassARRAY飞行时间质谱技术对其进行基因分型。由图2可知,所有的SNPs位点中均检测出3种常见基因型,平均检测率为99.37%。以g.568 C>G为例,结果显示未检测出基因型的2头,检出CC野生型纯合子243头,CG突变型杂合子124头,GG突变型纯合子14头。
2.3 水牛MFSD2A基因的遗传多样性分析
由表3可知,g.568 C>G位点的CC为优势基因型,C为优势等位基因;g.701 A>G位点的AA为优势基因型,A为优势等位基因;g.3203 T>G位点的TT为优势基因型,T为优势等位基因;g.3326 G>A位点的GA为优势基因型,G为优势等位基因;g.8290 T>C位点的TT为优势基因型,T为优势等位基因;g.8523 C>G位点的CG为优势基因型,C为优势等位基因;g.9138 G>T位点的GT为优势基因型,G为优势等位基因。这7个SNPs位点的最小等位基因频率(MAF)均>0.1,PIC均在0.25~0.4之间,属于中度多态;经χ2适合性检测表明,除g.8290 T>C外,其余位点均处于Hardy-Weinberg平衡状态(P>0.05)。

图1 水牛MFSD2A基因SNPs位点测序峰图Fig.1 Sequencing peak map of SNPs site of MFSD2A gene in buffalo
2.4 MFSD2A基因SNP位点不同基因型与水牛产奶性状的关联分析
使用SAS 9.4软件对MFSD2A基因的7个SNPs位点不同基因型与水牛305 d产奶量、乳脂率、乳蛋白率和乳尿素氮这4个产奶性状的最小二乘均值进行关联分析,结果见表4。由表4可知,这7个SNPs位点与305 d产奶量均显著关联,其中g.568 C>G、g.701 A>G、g.8523 C>G位点的GG基因型和g.3326 G>A位点的AA基因型个体305 d产奶量的最小二乘均值均超过2 700 kg,且显著高于其他基因型(P<0.05);而3种基因型中突变杂合子基因型个体的305 d产奶量最低。
g.568 C>G和g.701 A>G位点与乳脂率显著关联,乳脂率依次为突变纯合子>野生纯合子>突变杂合子,且突变纯合子(GG)和野生纯合子(CC和AA)个体的乳脂率均分别显著高于对应的突变杂合子(CG和GA)个体(P<0.05)。
g.568 C>G、g.701 A>G、g.3326 G>A、g.8290 T>C和g.8523 C>G与乳蛋白率均显著关联,其中g.568 C>G 和g.3326 G>A的野生纯合子个体乳蛋白率均显著高于突变杂合子个体(P<0.05),g.8290 T>C和g.8523 C>G的突变杂合子乳蛋白率显著高于野生纯合子(P<0.05)。这7个SNPs位点与乳尿素氮均无显著关联(P>0.05)。

表4 MFSD2A基因SNPs位点不同基因型与水牛产奶性状的关联分析Table 4 Association analysis of different genotypes of MFSD2A gene SNPs with milk production traits in buffalo
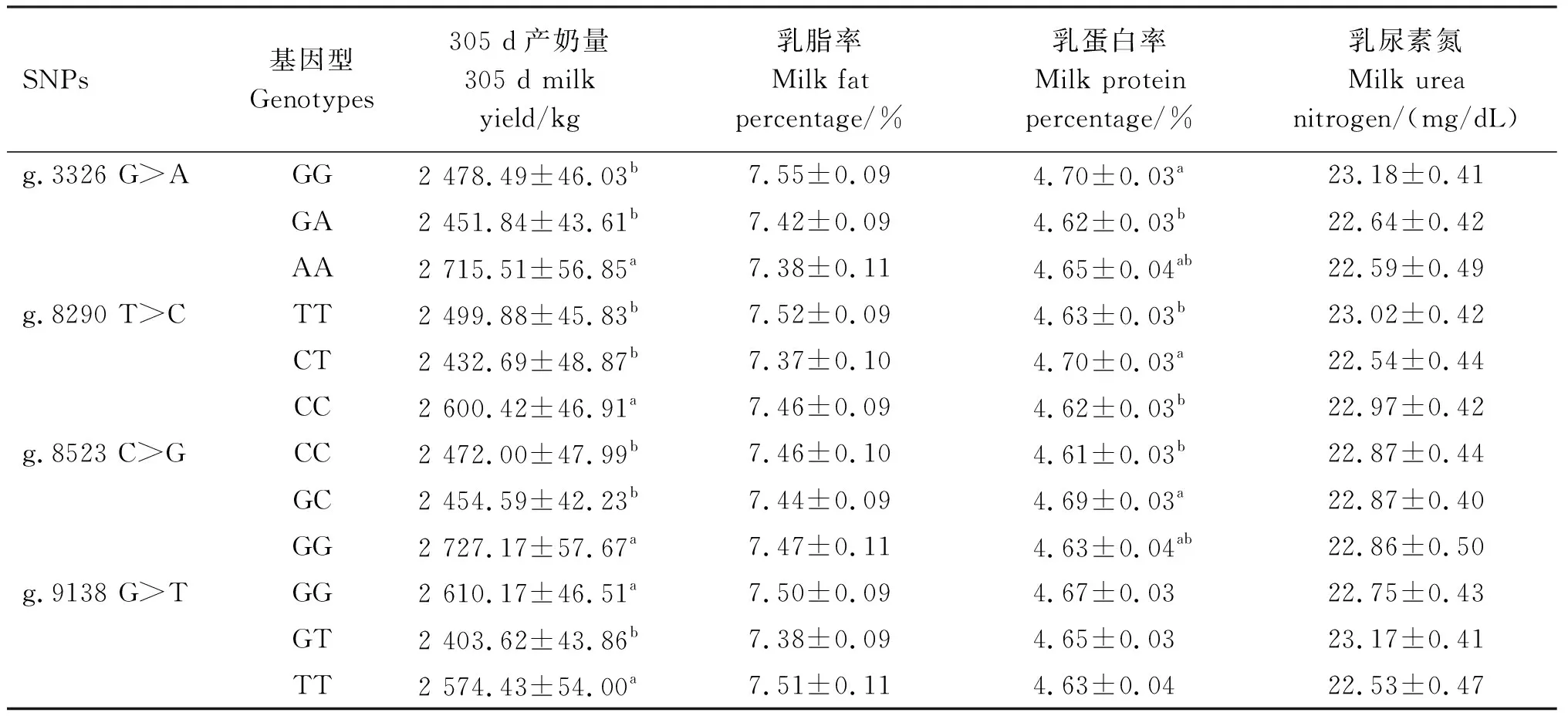
续表
2.5 水牛MFSD2A基因SNPs位点的连锁不平衡及单倍型分析
对处于Hardy-Weinberg平衡状态的6个SNPs进行后续分析,由图3可知,g.568 C>G、g.701 A>G和g.3203 T>G可组成一个单倍型模块(Block 1),g.8523 C>G和g.9138 G>T可组成另一个单倍型模块(Block 2)。其中,g.568 C>G和g.701 A>G、g.568 C>G和g.3326 G>A、g.8523 C>G和g.9138 G>T的r2分别为0.87、0.37和0.48,均>0.33,处于强连锁不平衡状态。

A,连锁不平衡单倍型块图(D’值):格子中的数字为D’×100的值,无数字的表示D’=1;B,连锁不平衡单倍型块图(r2值):格子中的数字为r2×100的值,根据r2值判断位点之间的连锁不平衡状态,r2=0表示完全连锁平衡,r2>0.33表示强连锁不平衡,r2=1表示完全连锁不平衡 A,LD-Block (D’):The number in the grid is the value of D’×100,no value means D’=1;B,LD-Block (r2): The number in the grid is the value of r2×100,the linkage among SNPs was evaluated by the value of r2,r2=0 indicated no linkage or linkage equilibrium,r2>0.33 indicated strong linkage,r2=1 indicated full linkage图3 水牛MFSD2A基因6个SNPs位点连锁不平衡分析Fig.3 Analysis of linkage disequilibrium of six SNPs of MFSD2A gene in buffalo
如表5所示,Block 1和Block 2的SNPs各能形成3种单倍型。分别对这2个单倍型模块的6种单倍型与水牛产奶性状进行关联分析,结果如表6所示,Block 1中的H1(CAG)单倍型个体乳蛋白率显著高于H2(CAT)和H3(GCT)(P<0.05);Block 2中的D3(GG)单倍型个体305 d产奶量极显著高于D1(CG)和D2(CT)型(P<0.01)。

表5 水牛MFSD2A基因单倍型及其频率Table 5 Haplotype and frequency of MFSD2A gene in buffalo

表6 水牛MFSD2A基因单倍型与水牛产奶性状的关联分析Table 6 Association analysis of MFSD2A gene haplotype and milk production traits in buffalo
3 讨 论
MFSD2A是一个营养调节基因,在动物生长发育、运动功能和脂肪代谢中发挥着多种作用。MFSD2A基因敲除小鼠肝脏脂肪代谢正常,但全身能量消耗增加。与野生型小鼠相比,MFSD2A基因敲除的小鼠更小、更瘦,并降低了血清、肝脏和棕色脂肪甘油三酯[7]。目前对MFSD2A的研究更多集中于人类大脑和眼睛等器官的发育和疾病中,在哺乳动物产奶性状方面的功能尚不清楚,本试验利用PCR扩增技术及Sequenom MassARRAY SNP飞行时间质谱技术在水牛MFSD2A基因内含子序列中筛选出7个SNPs位点。内含子在真核生物基因组序列中占比很大,是基因组中重要的组成部分。一般来说,内含子区域承受的选择压力要远远低于外显子区域,因此变异程度高于编码序列[9]。内含子作为非编码序列通常被认为是不会行使功能的,但有研究表明内含子与基因表达、细胞骨架构建和动态变化密切相关[10]。内含子及被剪接体切除的内含子会影响mRNA代谢的许多过程[11]。而内含子区域的SNP位点有可能通过影响剪切位点活性来影响基因功能,剪切位点的失活可能会影响碱基的翻译和蛋白质序列。
遗传多样性分析结果显示,g.8290 T>C位点偏离Hardy-Weinberg平衡状态,可能是受到了突变、选择和遗传漂移等影响。这7个SNPs位点PIC均在0.25~0.5之间,表明这些SNPs位点处于中度多态,有较大遗传变异性和选择潜力。进一步对其不同基因型与水牛产奶性状进行关联分析,结果显示纯合子的基因型在305 d产奶量和乳脂率的选择上更有优势。
连锁不平衡是指2个或多个基因座上等位基因非随机关联现象[12],某些等位基因常常随机关联在一起,同时遗传给后代,这些等位基因组成的单倍型在群体中出现的频率较高,引起连锁不平衡。种群中的连锁不平衡会受到如种群结构、迁移、选择、遗传漂移、突变和重组率等因素影响[13]。连锁不平衡图谱的开发和群体水平单倍型模块的表征有助于候选基因和候选区域的研究[13],也有助于理解表型和基因之间非线性关联的本质。基因的连锁不平衡分析基于随机分布状态下的实际单体型频率与预期频率之间的差异来实现的,以D’和r2(取值范围为0~1)来表示位点间的连锁不平衡程度[14],D’=1、r2=1则表示基因座处于完全连锁不平衡状态。本试验选择使用r2而不是D’来评估连锁不平衡是因为与D’相比,在有限的样本数中r2受等位基因频率的影响较小,D’在小样本数和低频率等位基因中往往被高估[15-17]。对水牛MFSD2A基因符合Hardy-Weinberg平衡的6个SNPs位点进行连锁不平衡分析,结果显示,g.568 C>G和g.701 A>G位点处于极强连锁不平衡状态(D’=1,r2=0.87),这也解释了这2个SNPs位点基因型频率相似和关联分析结果一致的现象。
单倍型是指单个染色体上等位基因的组合,换句话说,是指同一亲本来源的等位基因[18]。虽然本研究在MFSD2A基因单个SNP位点不同基因型与水牛产奶性状关联分析中找到了许多显著关联的基因型,但单个SNP研究不全面且繁琐,由于SNPs位点之间可能通过连锁共同遗传而发挥作用,因此利用单倍型分析可避其不足[19]。本试验的单倍型分析结果发现了2个单倍型模块,共形成6种单倍型。分别对这6种单倍型与水牛产奶性状进行关联分析,结果发现Block 1中的H1(CAG)单倍型乳蛋白率显著高于H2(CAT)和H3(GCT),Block 2中的D3(GG)单倍型305 d产奶量显著高于D1(CG)和D2(CT)型,因此H1和D3单倍型是提高水牛305 d产奶量和乳蛋白率的有利单倍型。
主要促进因子超家族(MFS)是最大和最多样化的膜转运蛋白[20],作为单一转运体、联合转运体和反向转运体,在细胞内外运输物质[21]。MFS转运蛋白包括MFSD1、MFSD2A、MFSD2B和MFSD3等,它们可以运输寡糖、单糖、药物、酶辅因子、多肽、氨基酸、维生素、碱基、核苷、核苷酸、生色团、有机和无机阴离子等[22]。与大多数其他MFS成员运输糖和氨基酸等水溶性配体不同,MFSD2A是第一个被发现唯一转运脂质的成员,这意味着MFSD2A具有独特的结构特征和转运机制[23]。在本试验中发现了与水牛乳脂率显著关联的MFSD2A基因SNPs位点,还发现了其他与产奶量和乳蛋白率相关的SNPs位点和单倍型,虽然乳脂率的变化会影响乳蛋白率和产奶量,但这其中的调控机制尚不明确,后续还需要进行进一步的研究。在今后的选择过程中,应考虑优势等位基因的固定,以提高水牛产奶性能。但由于本试验中的样本量较少,需要进一步在大群体中去验证,以鉴定这些SNPs位点是否可以作为影响水牛产奶性能的有效分子标记,为今后开展水牛标记辅助选择育种研究提供可靠的理论基础。
4 结 论
本试验共检测到MFSD2A基因7个SNPs位点,与305 d产奶量均显著关联,g.568 C>G和g.701 A>G位点与乳脂率显著关联,g.568 C>G、g.701 A>G、g.3326 G>A、g.8290 T>C和g.8523 C>G与乳蛋白率显著关联,这7个SNPs位点与乳尿素氮均无显著关联。纯合子的基因型在高305 d产奶量和乳脂率的选择上更有优势,H1(CAG)和D3(GG)单倍型是提高水牛305 d产奶量和乳蛋白率的有利单倍型。本试验结果对今后开展水牛标记辅助选择育种研究具有一定参考意义。
