线叶金雀花总黄酮提取工艺优化及对大肠杆菌的抑菌作用
2022-10-20王振伟郑黎静
王振伟 郑黎静
(黄河水利职业技术学院环境工程学院,河南 开封 475000)
线叶金雀花[AspalathusLinearis(Brum.f.) R. Dahlgren]是来源于南非的豆科植物,又名南非茶、博士茶,经发酵后茶味道香甜,气味淡雅,已于2014年被国家卫生和计划生育委员会批准作为新食品资源[1]。线叶金雀花中主要的化学成分包括黄酮类、酚类、花色苷、有机酸和多糖类物质[2],具有强抗氧化活性[2]、保护心脏[3]、抗炎[4]、抑菌[5]、增加骨密度[6]、降血糖[7]、辅助治疗糖尿病[8]和抗焦虑[9]等作用。现有研究[7,10]表明,线叶金雀花中主要的生物活性物质是黄酮类化合物,主要由阿司巴汀、荭草苷、异荭草苷、牡荆素、异牡荆素、异槲皮苷、芦丁、金丝桃苷等组成,具有较强的抗氧化活性,且阿司巴汀还具有降血糖、抗炎和抑菌作用。
大肠杆菌是常见的食源性条件致病菌之一,广泛分布在各种食物中,严重危害着人们的身体健康[11]。目前,抑制食品贮藏期间大肠杆菌污染的主要方式是添加化学防腐剂,然而,随着人们健康意识的增加,消费者越来越倾向于利用天然提取物作为防腐剂抑制大肠杆菌的污染[12]。研究[13]发现,黄酮类化合物能够与受试细菌的细胞壁形成复合物,造成细菌生理功能障碍,从而起到抑菌的作用,同时由于天然黄酮类物质具有安全、绿色、高效等特点,更容易被消费者接受。目前,黄酮类化合物最常用的提取方法为超声辅助乙醇提取法,具有提取率高、提取时间短,操作简便、成本低、产物易纯化、设备要求低等优点,已被广泛应用于铁皮石斛花[14]、红豆树叶[15]、柠条锦鸡儿[16]和橄榄叶[17]等多种植物资源总黄酮的提取。然而,有关线叶金雀花总黄酮提取工艺的进一步优化及其对大肠杆菌抑菌活性的研究尚未见报道。
研究拟以线叶金雀花为研究对象,采用超声辅助法对线叶金雀花总黄酮进行提取,利用单因素试验和响应面法优化提取工艺条件,在此基础上,评估线叶金雀花总黄酮对大肠杆菌的抑菌活性,并探讨其作用机制,旨在为开拓线叶金雀花资源在食品领域中的应用提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
线叶金雀花:短切Freshpak系列产品(发酵红茶),产地为南非,生产日期为2021年3月15日,保质期24个月,扶风斯诺特生物科技有限公司;
大肠杆菌(EscherichiacoliO157:H7):广东环凯生物科技有限公司;
芦丁标准品(纯度≥98%):南京杜莱生物技术有限公司;
亚硝酸钠、硝酸铝、无水乙醇:分析纯,河南拓弘化工有限公司;
胰蛋白胨大豆琼脂、营养肉汤培养基:河南瑞伦特生物科技有限公司。
1.1.2 主要仪器设备
电子天平:BCE323-1CCN型,上海坤诚科学仪器有限公司;
高压蒸汽灭菌锅:YXQ-100SII型,浙江明德仪器有限公司;
数控超声波清洗器:GT0303型,深圳市冠博科技实业有限公司;
紫外分光光度计:T2602S型,青岛精诚仪器仪表有限公司;
透射电子显微镜:JEM-1400Flash型,日本电子株式会社。
1.2 方法
1.2.1 标准曲线的制作 参照钟尉方等[18]的方法,所得标准曲线方程为y=13.231x+0.048 4(R2=0.987 7)。
1.2.2 线叶金雀花总黄酮提取及含量测定 取10 g经干燥粉碎后的线叶金雀花粉末,按一定的乙醇体积分数、料液比、超声温度、超声时间进行提取,抽滤后得到线叶金雀花提取液,将提取液与相应试剂进行反应后测定510 nm 处溶液的吸光值,并按式(1)计算总黄酮提取率。
(1)
式中:
W——总黄酮提取率,%;
c——总黄酮质量浓度,mg/mL;
v——滤液体积,mL;
M——线叶金雀花质量,g。
1.2.3 单因素试验 以10 g线叶金雀花粉末为基准,在乙醇体积分数50%,料液比1∶25 (g/mL),超声温度70 ℃,超声时间60 min的基础上,以总黄酮提取率为评价指标,考察乙醇体积分数(30%,40%,50%,60%,70%)、料液比[1∶10,1∶15,1∶20,1∶25,1∶30 (g/mL)]、超声温度(40,50,60,70,80 ℃)和超声时间(20,40,60,80,100 min)对总黄酮提取率的影响。
1.2.4 响应面试验优化 在单因素试验的基础上,以提取率为响应值,选用Design-Expert 8.0.6.1软件中的Box-Behnken模型构建四因素三水平的响应面试验,优化线叶金雀花总黄酮提取工艺。
1.2.5 大肠杆菌抑菌圈直径(DIZ)测定 采用纸片扩散法[10]。
1.2.6 大肠杆菌最小抑菌浓度(MIC)和最小杀菌浓度(MBC)测定 根据Fei等[19]的方法稍作修改。将线叶金雀花总黄酮与灭菌的胰蛋白胨大豆琼脂培养基(约50 ℃)在无菌24孔板中充分混合,使其终质量浓度分别达到3.125,6.250,12.500,25.000,50.000,100.000 mg/mL,以0.1 mg/mL的氨苄青霉素为阳性对照。待培养基凝固后,向孔中央加入2 μL大肠杆菌菌悬液(106CFU/mL),37 ℃培养24 h,以肉眼未见菌落长出的最小浓度定义为线叶金雀花总黄酮对大肠杆菌的MIC。用浓度≥1 MIC的线叶金雀花总黄酮处理大肠杆菌菌悬液1 h,平板涂布,菌落无法生长的最低浓度被定义为MBC。
1.2.7 生长曲线测定 取25 μL大肠杆菌菌悬液(OD600 nm=0.2),加入线叶金雀花总黄酮,使其终浓度分别为0(对照组),0.5,1.0,1.5,2.0 MIC,并调整总体系达到250 μL,于37 ℃下培养,并构建生长曲线[10]。
1.2.8 透射电子显微镜观察 根据Li等[20]的方法稍作修改。分别用0,1,2 MIC的线叶金雀花总黄酮处理大肠杆菌菌悬液(OD600 nm=0.5)4 h,离心得到菌泥。将菌泥先后加入到2.5%戊二醛和1%锇酸中固定2 h,每次固定后离心,并用磷酸缓冲液洗涤2次。用不同体积分数的乙醇(50%,70%,90%,100%)处理样品10 min,包埋及双重染色处理后置于透射电子显微镜下观察。
1.2.9 数据分析 除透射电子显微镜外所有试验均重复3次,采用Office 2019处理单因素试验数据,利用Design Expert 8.0.6.1软件进行响应面数据分析。
2 结果与分析
2.1 单因素试验
由图1可知,当乙醇体积分数>50%时,乙醇与线叶金雀花总黄酮之间的极性差不再增加,反而会导致其他溶性杂质的溶解,增加了与黄酮溶出的竞争,导致总黄酮提取率下降[14]。当料液比<1∶25 (g/mL)时,总黄酮提取率随料液比的增大而增加;当料液比>1∶25 (g/mL),超声波对线叶金雀花的破碎及空化作用减弱,提取率下降[15]。当超声温度>70 ℃时,过高的温度会破坏黄酮类物质的结构稳定性,从而导致总黄酮提取率下降[16]。当超声时间>60 min时,长时间的超声作用也会破坏黄酮类物质的稳定性,并增加溶液黏度和传质阻力,不利于黄酮类物质的溶出[17]。综上,超声辅助乙醇法提取线叶金雀花总黄酮的适宜工艺条件为乙醇体积分数50%,料液比1∶25 (g/mL),超声温度70 ℃,超声时间60 min。
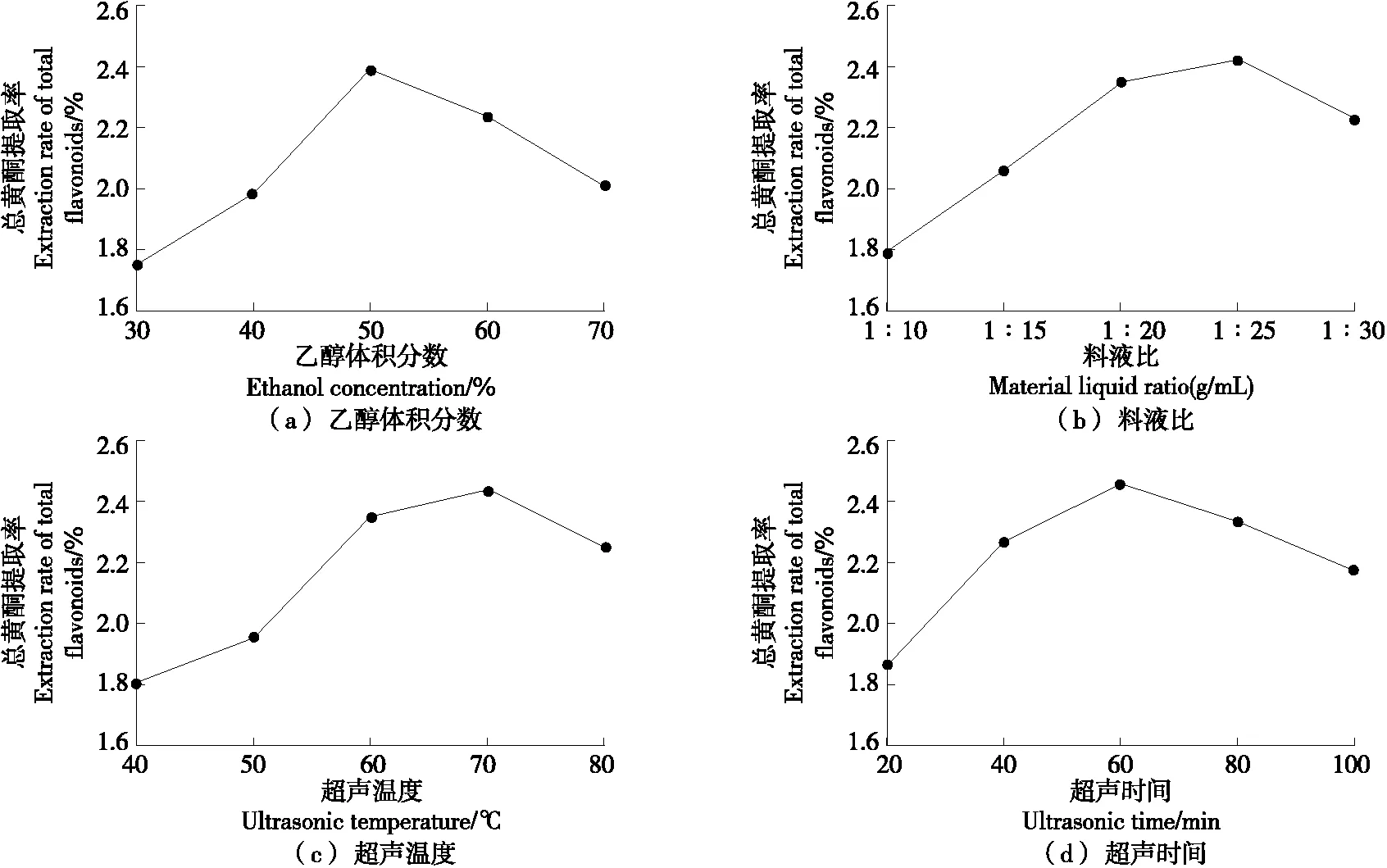
图1 单因素试验结果
2.2 响应面优化
2.2.1 响应面试验设计及结果 在单因素试验的基础上,以乙醇体积分数、料液比、超声温度和超声时间为因素,以总黄酮提取率为响应值,根据Box-Behnken模型构建四因素三水平的响应面试验,因素水平见表1,试验设计及结果见表2。

表1 响应面试验因素与水平表
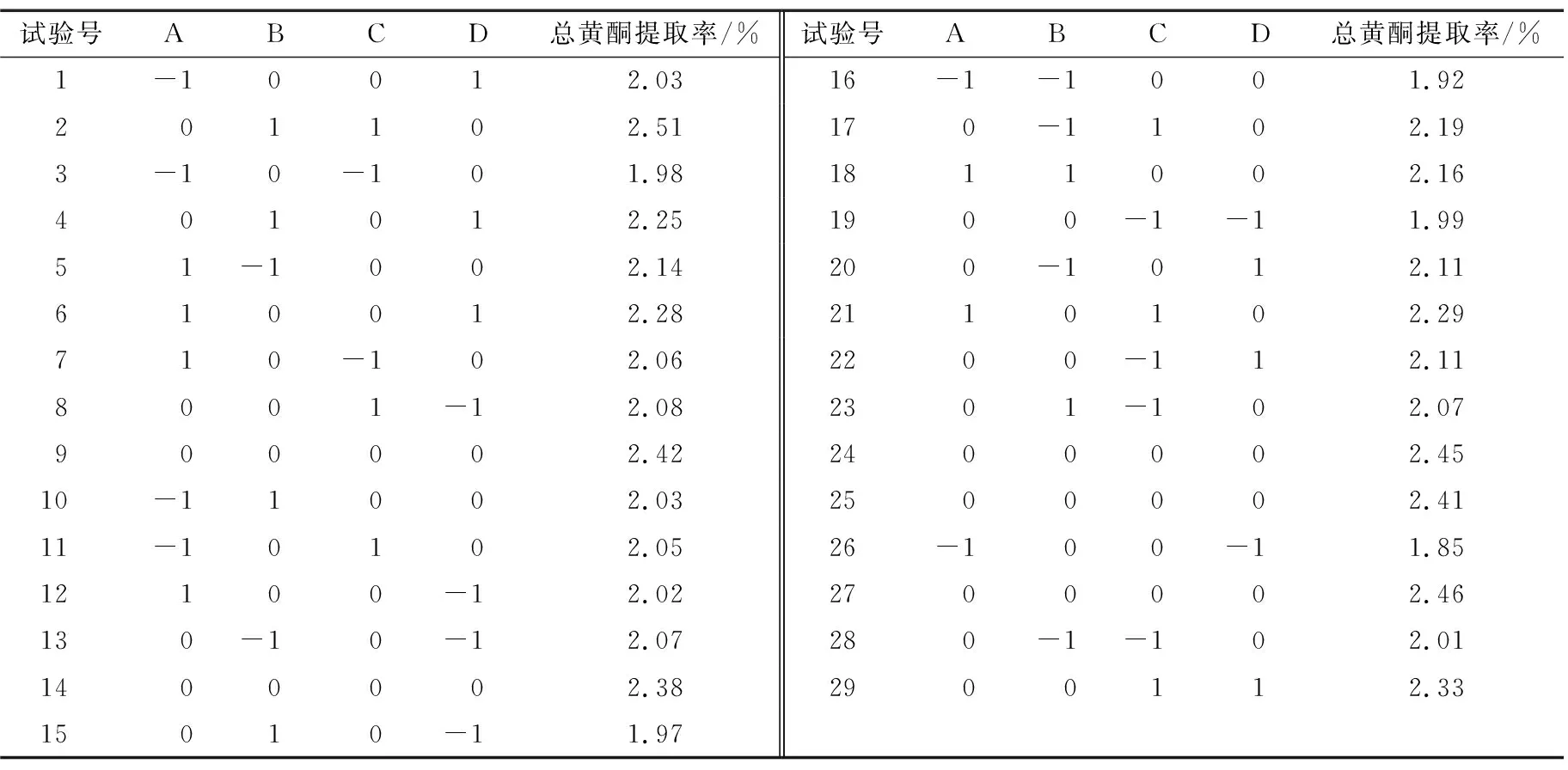
表2 响应面试验设计及结果
对响应面试验结果进行回归拟合,构建优化线叶金雀花总黄酮提取率的回归方程:
Y=2.42+0.091A+0.046B+0.10C+0.094D-0.023AB+0.040AC+0.020AD+0.065BC+0.060BD+0.032CD-0.21A2-0.14B2-0.11C2-0.18D2。
(2)
由表3可知,模型极显著(P<0.001),失拟项不显著(P>0.05),说明模型拟合度与置信度符合要求,可用于线叶金雀花总黄酮提取率的预测和分析。显著性分析检验结果显示,一次项A、C、D,二次项A2、B2、C2和D2对总黄酮提取率影响极显著(P<0.01),一次项B,交互项BC和BD对总黄酮提取率影响显著(P<0.05)。由F值可知,各因素对总黄酮提取率的影响顺序为超声温度>超声时间>乙醇体积分数>料液比。
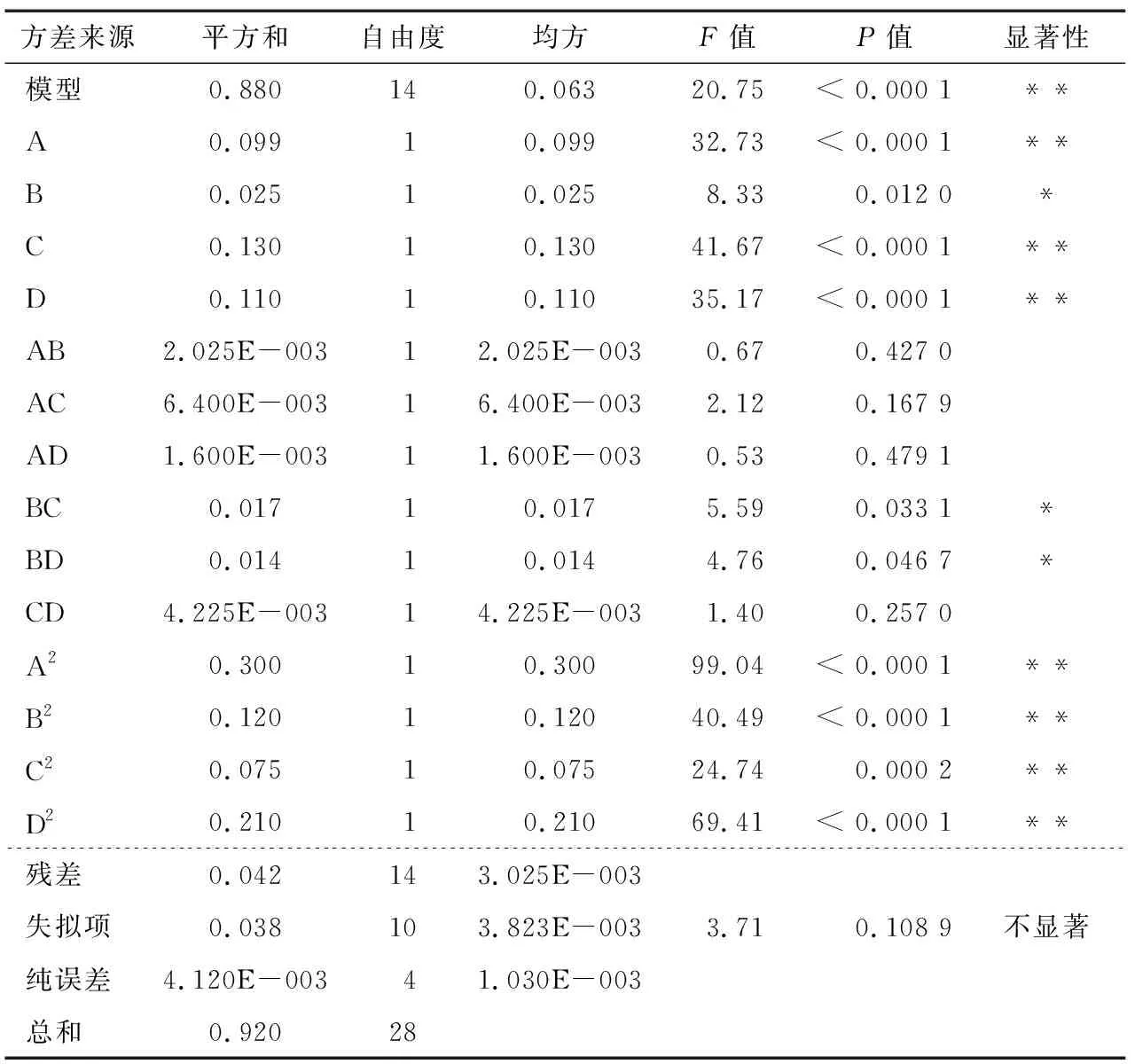
表3 方差分析†
2.2.2 各因素交互作用 由图2可知,料液比和超声温度、料液比和超声时间相互作用形成的响应面坡度陡峭,说明料液比和超声温度、料液比和超声时间的交互作用明显,对线叶金雀花总黄酮提取率影响显著(P<0.05),与方差分析结果一致。
2.2.3 验证实验 根据响应面回归模型预测可知,线叶金雀花总黄酮的最佳提取工艺为乙醇体积分数52.75%,料液比1∶27.01 (g/mL),超声温度77.12 ℃,超声时间68.15 min,该条件下预测线叶金雀花总黄酮提取率为2.50%。为方便试验操作,最终确定最佳提取条件为乙醇体积分数53%,料液比1∶27 (g/mL),超声温度77 ℃,超声时间68 min,此条件下实测线叶金雀花总黄酮提取率为2.46%(n=3),与预测值相近,且高于Bramati等[21]的水提法(提取率为0.55%),说明超声辅助乙醇提取法提取线叶金雀花总黄酮具有一定的优越性。

图2 各因素交互作用对线叶金雀花总黄酮提取率影响的响应面图

表4 线叶金雀花总黄酮对大肠杆菌的抑菌试验†
2.3 线叶金雀花总黄酮的抑菌活性
2.3.1 DIZ、MIC和MBC 由表4可知,线叶金雀花总黄
酮对大肠杆菌的DIZ、MIC和MBC值分别为(11.4±0.21) mm、12.5 mg/mL和25 mg/mL。目前,黄酮类化合物已被证实对大肠杆菌具有明显的抑制作用,如:头花蓼中总黄酮对大肠杆菌的MIC和MBC值分别为7.3,7.9 mg/mL[22];藜麦种子总黄酮对大肠杆菌的MIC值为32 mg/mL[23];紫叶李皮总黄酮对大肠杆菌的MIC和MBC分别为12.6,25.2 mg/mL[24];苦荞麸皮黄酮提取物对大肠杆菌的MIC和MBC值分别为25,50 mg/mL[25]。与上述黄酮类物质相比,线叶金雀花总黄酮对大肠杆菌的抑制效果处中上等水平,可用作天然防腐剂的开发。
2.3.2 对大肠杆菌生长曲线的影响 由图3可知,在线叶金雀花总黄酮的作用下,大肠杆菌的生长被显著抑制(P<0.05),对数生长期消失,且线叶金雀花总黄酮质量浓度越高,抑菌效果越好。当作用浓度为2 MIC时,大肠杆菌的生长被完全抑制,说明线叶金雀花总黄酮能够有效抑制大肠杆菌的生长繁殖,并呈浓度依赖效应,与胎菊水提物抑制大肠杆菌[11],苋菜粗提物抑制金黄色葡萄球菌[12]和丁香酸抑制阪崎克罗诺杆菌[26]的生长曲线相似。
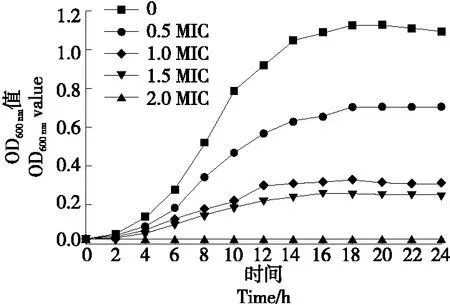
图3 线叶金雀花总黄酮对大肠杆菌生长曲线的影响
2.3.3 透射电子显微镜分析 由图4可知,正常状态下大肠杆菌呈杆状,胞内细胞液饱满,细胞形态正常。经1,2 MIC的线叶金雀花总黄酮处理后,大肠杆菌的细胞形态发生了严重损伤,包括细胞塌陷、细胞壁和细胞膜分离、细胞液外泄、细胞破碎等现象,且上述细胞形态学损伤会随线叶金雀花总黄酮作用浓度的增加而加剧,表明线叶金雀花总黄酮能够通过破坏大肠杆菌的细胞形态达到抑制其生长的目的。这与胎菊水提物抑制大肠杆菌、茶多酚抑菌阪崎克罗诺杆菌、橄榄油多酚抑制蜡样芽孢杆菌的过程一致,且细胞液外泄是胞内蛋白质和核酸等生物大分子含量减少的重要原因之一[11, 19-20]。此外,天然产物对食源性致病菌的抑菌作用是否可逆与受试细菌的细胞形态受损程度有关,如果受试细菌只是细胞表面形成气孔或囊泡,则通过再培养,受试细胞仍能够正常生长繁殖,相比之下,如果受试细菌出现细胞液外泄,则再培养也无法使细菌正常生长[20,27]。综上,在线叶金雀花总黄酮的作用下,大肠杆菌的细胞形态发生了不可逆的损伤。

图4 线叶金雀花总黄酮对大肠杆菌细胞形态的影响
3 结论
研究了线叶金雀花总黄酮的最佳超声提取工艺参数及其对大肠杆菌的抑制作用。结果表明,线叶金雀花总黄酮的最佳提取工艺参数为乙醇体积分数53%,料液比1∶27 (g/mL),超声温度77 ℃,超声时间68 min,此工艺条件下线叶金雀花总黄酮的提取率为2.46%。抑菌试验结果显示,线叶金雀花总黄酮对大肠杆菌的抑菌圈直径、最小抑菌浓度和最小杀菌浓度分别为(11.40±0.21) mm、12.5 mg/mL和25 mg/mL。此外,不同质量浓度的线叶金雀花总黄酮对大肠杆菌具有良好的抑制作用,并可对受试细菌造成严重的细胞形态学损伤。后续将进一步对线叶金雀花总黄酮进行提纯,并分析其活性物质组成,以期能够应用于食品防腐中。
