面粉中霉菌和酵母计数能力验证结果分析
2022-10-20仇平平
能力验证(Proficiency Testing)是利用实验室间比对来判定实验室和检查机构检测能力的活动,是检验实验室检测水平的一项重要手段。实验室通过参加能力验证活动,不仅可以清楚了解本机构实验室的检测能力和水平,考察检验人员的技术水平和设备的性能,还可以从外部寻找与同行之间的差异,发现自身存在的不足,及时有效地提出改进措施,持续改进和完善实验室的质量控制和管理[1-2]。
霉菌和酵母属于真菌,在食物中繁殖速度非常快,会产生大量的毒素,对人体造成致命性的危害。例如,黄曲霉毒素就是由黄曲霉和寄生曲霉等某些菌株产生的双呋喃环类毒素,黄曲霉毒素已被世界卫生组织癌症研究机构划定为一类天然存在的致癌物[3]。花生、花生油、玉米等食品中极易受到黄曲霉毒素的污染。同时,霉菌和酵母也是评价食品卫生质量的指示菌,已成为食品中常规的检测项目之一[4]。目前,《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》(GB 4789.15—2016)是普遍采用的霉菌和酵母检验方法,该方法操作简单,但由于霉菌和酵母自身繁殖特点,前期生长缓慢,后期急剧生长,蔓延生长甚至连片,导致计数时比较困难,因此霉菌和酵母计数也是考察实验室和检测人员技术水平的重要参考。
1 材料与方法
1.1 样品
本次能力验证样品由中国食品药品检定研究院提供,2份待测样品,每份样品包含装有菌球的西林瓶1瓶(规格:1粒/瓶)和相同编码的面粉1袋(规格:25 g/袋),2份样品的编号分别为TF03280014和TF03280027。
1.2 培养基及试剂
孟加拉红琼脂,北京陆桥技术股份有限公司;0.85%无菌生理盐水,北京陆桥技术股份有限公司。
1.3 仪器设备
无菌均质器S-154,上海德记行科技发展公司;MJ-250BSH-Ⅲ型霉菌培养箱S-01,上海新苗医疗器械制造有限公司。
1.4 实验方法
1.4.1 样品处理
在生物安全柜内打开装有霉菌和酵母菌球的西林瓶,并将霉菌和酵母菌球加入到盛225 mL 0.85%无菌生理盐水的无菌均质袋中,充分均质混匀。再将与西林瓶相同编码的面粉基质加入到上述生理盐水中,充分均质混匀,作为1∶10的样品匀液。
1.4.2 样品稀释
(1)吸取1∶10样品匀液1 mL,加入到盛有9 mL无菌生理盐水的无菌试管中,混匀,制成1∶100的样品匀液,依此法继续用无菌生理盐水进行10倍系列梯度稀释,制备1∶1 000的样品匀液。
(2)分别吸取各稀释级的样品匀液1 mL于无菌平皿内,每个稀释级做2个平皿。同时,分别取1 mL 0.85%无菌生理盐水加入到两个无菌平皿内作空白对照。及时将20~25 mL冷却至46 ℃的孟加拉红琼脂培养基倾注平皿,并转动平皿使其混合均匀,置水平台面待培养基完全凝固。
(3)培养。将上述凝固后培养基,正置平板,放置于28 ℃培养箱中培养至第5天,逐日观察并记录结果。
2 结果与分析
2.1 不同取样方式下霉菌和酵母的计数结果
面粉一般指小麦粉,即由小麦磨成的粉状物。面粉主要成分是淀粉,是不溶于水的,会形成悬浊液[5],面粉在0.85%的无菌生理盐水中也不能完全溶解,会形成悬浊液,放置1~2 min面粉会下沉至底部,所以取样方式对检测结果会有一定影响。本实验设计两种取样方式。第一种是用无菌均质器均质1 min混匀后直接取悬浊液进行后续检测,第二种是用无菌均质器均质1 min混匀后放置1~2 min取上清液进行后续检测。从计数结果来看,第二种取样方式霉菌和酵母数均比第一种取样方式多,详见表1、表2。本实验选取第二种取样方式(上清液)的结果报数,TF03280014的Z值为1.68,TF03280027的Z值为0.66,两份样品|Z|值均小于2.0,|Z|值≤2为满意结果,故两份样品结果均为满意。
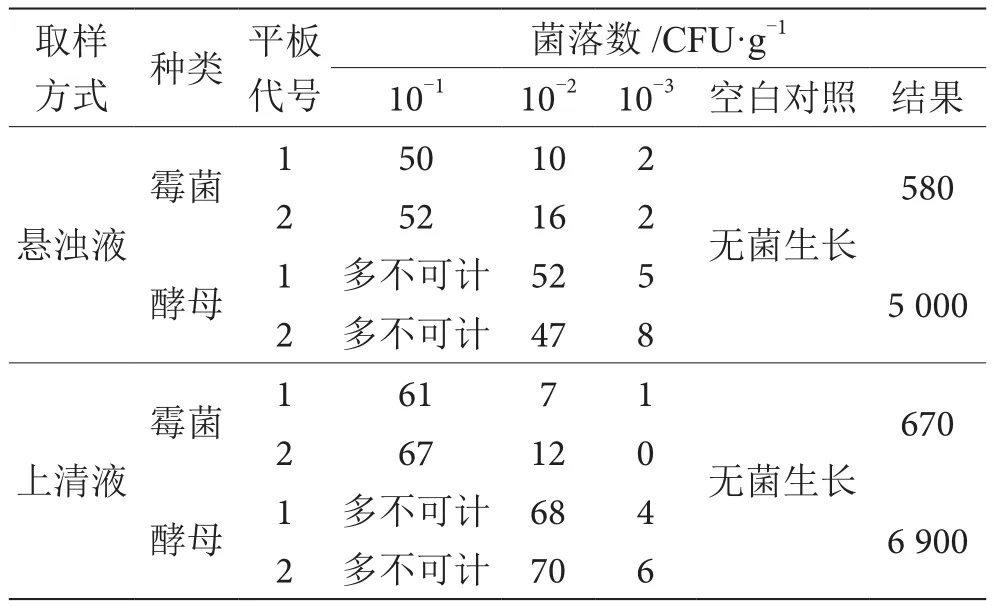
表1 TF03280014霉菌和酵母计数结果表

表2 TF03280027霉菌和酵母计数结果表
2.2 孟加拉红培养基上霉菌和酵母生长形态变化
孟加拉红琼脂培养基中的氯霉素可抑制细菌的生长,孟加拉红是一种选择性抑菌剂,也可抑制细菌的生长,并减缓某些霉菌菌落的蔓延生长。孟加拉红琼脂培养基可选择性地抑制细菌生长而不影响霉菌和酵母的生长,排除细菌生长带来的干扰。
在孟加拉红培养基上培养霉菌和酵母,到第2天才开始有菌落生长,以10-1稀释级霉菌和酵母培养第2~5天的生长形态为例来描述霉菌和酵母生长趋势,见图1。霉菌和酵母均在培养至第2天时可以看到明显的菌落,第3~5天霉菌迅速生长,酵母相对比较小,霉菌菌丝蔓延成片。对于霉菌而言培养至第3天的时候菌落已出现连片现象,从正面不易计数,从背面可以清晰看见菌核,易于计数。实验中发现在菌落数比较少的稀释级平板上(如10-2稀释级),培养至第2天到第5天的菌落数基本没有变化。
综合以上描述,观察结果应逐天进行,尤其是培养2~3 d时,霉菌计数比较关键。酵母相对于霉菌菌落较小,菌落形态清晰,易于计数。

图1 TF03280014霉菌和酵母10-1级两个平行平皿培养后的菌落形态变化图
3 结论与讨论
3.1 影响计数的关键因素
3.1.1 取样方式
本次能力验证设计了两种取样方式来考察霉菌和酵母计数结果。第二种取样方式(取上清液开展后续试验)比第一种取样方式(取悬浊液开展后续试验)计数结果偏多,分析原因有两个方面。①经过均质的样品匀液可认为是菌株均匀分布于0.85%的生理盐水中,放置一会儿面粉颗粒会下沉至底部,此时分别吸取1 mL样品悬浊液和上清液,悬浊液中的面粉颗粒会占据一部分的体积,上清液中面粉颗粒相对较少菌含量相对较高。②面粉颗粒在后续观察时会影响视线,容易少计数,所以本实验选择取上清液的结果报数。
3.1.2 计数方法
(1)培养时间。实验观察发现霉菌和酵母从培养至第2天开始计数,此后霉菌生长速度很快,至第4天菌丝布满整个平板,霉菌和酵母相互覆盖影响准确计数。培养至第5天时,从正面无法计数,只能从背面计数(图2)。此时计数相对来说误差会比较大。同时霉菌会产生菌丝,在观察结果的过程移动平板,会造成菌丝飘散,形成次生菌。

图2 TF03280014培养至第5天霉菌和酵母的菌落形态图
(2)菌落形态。每份样品中都有霉菌和酵母,霉菌生长速度快,后期逐渐形成褶皱,第4天、第5天霉菌布满整个平板,此时霉菌从正面难以计数,从背面计数霉菌主要以菌核计算(如图2),但是有些菌核不明显,此时能不能记为单独菌落又因人而异(如图3中B处)。霉菌培养至第4天时就产生明显的褶皱,从背面看像是两个菌核(如图3中A处),容易计成两个菌落。部分酵母长在培养基内部,部分长在培养基表面,霉菌蔓延至整个平皿的时候掩盖住部分酵母,正面难以准确计数,而从背面计数时因酵母有大有小,小的菌落与面粉颗粒容易混淆,菌落计数存在误差(如图4标识圆圈内)。
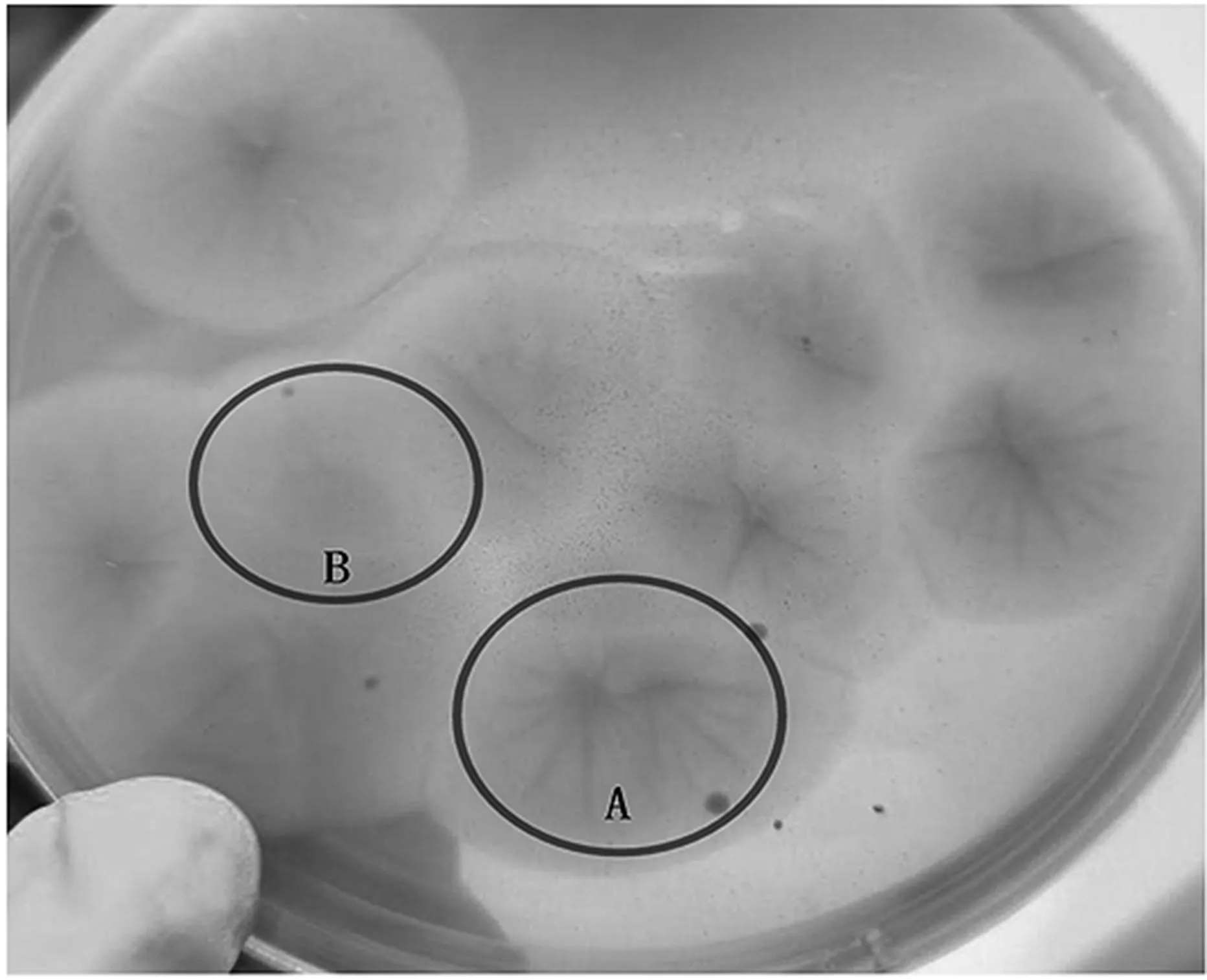
图3 TF03280027 10-2级在孟加拉红琼脂上培养至第4天的形态(背面观察)图

图4 TF03280014 10-2级在孟加拉红琼脂上培养至第4天的形态(背面观察)图
3.2 能力验证中关键控制点
3.2.1 人员
检测人员是影响实验结果准确性和真实性至关重要的因素。食品微生物检测人员需具备食品微生物检测的专业知识,并有相关的实习经验或工作经验,检测人员需通过食品微生物检测相关理论知识和实操技能考试,取得上岗证后方可上岗。检测人员实验操作熟练度和规范性直接影响实验结果,检测人员可每年参加专业机构组织的“生物安全”“食品微生物检测理论和实操”等主题的培训班来提高自身理论知识和检验水平,不断积累总结好的经验,优化自身知识结构,提升自身综合素质。实验室可结合日常工作情况、外部审核、能力验证等对检验人员定期开展监控。对于特殊情况,如新项目、新设备、新人员上岗、投诉和结果偏离等情况应随时开展监控[6]。
3.2.2 实验条件
实验室应配备满足检验要求的仪器设备,设备应检定合格,使用之前应做好确认,并定期做期间核查;实验室应配备符合要求的培养基及试剂,培养基应验收合格,使用之前应完成质量控制,因孟加拉红琼脂培养基见光易分解,配制好的培养基可应避光放置,培养基最好现用现配,不要放置于冰箱中过夜保存。
3.2.3 实验方法
确认样品完好无误后,检测人员应认真阅读相关能力验证作业指导书,严格按要求处理样品,在转移西林瓶里的菌球时,应注意看菌球是否有散落,可用稀释液反复冲洗西林瓶,保证目标菌尽可能完全转移,目标菌的转移对后续菌落计数至关重要。后续检测应严格按照GB 4789.15—2016要求进行,操作要规范。微量移液器卡紧枪头,防止漏液,保持竖直,在转移过程中不要碰到试管内侧;每次稀释要充分混匀,操作过程要规范,防止样液喷溅;培养基温度需冷却至46 ℃,加入培养基后需立即转动平皿混匀,力度不要过大,防止培养基溅出。
3.2.4 结果计数
在本次能力验证中发现,霉菌和酵母一般在48 h以后开始生长,所以本文建议从培养至第2 天开始计数,计数过程中注意轻拿轻放平,勿反复翻转平板,防止霉菌菌丝飘散形成次生菌。霉菌后期生长速度很快,菌丝蔓延,计数比较困难,霉菌在培养至第3天、第4天和第5天时菌落数基本一致,本文建议霉菌计数可密切关注培养至第3天的结果,酵母计数可重点关注培养至第4天、第5天的结果。
