紫草素对UGT1A1*1和UGT1A1*6催化SN-38葡萄糖醛酸化的抑制作用研究
2022-10-20陈银楠陈悦悦
陈银楠 刘 勇 陈悦悦 李 巍▲
1.扬州大学医学院转化医学研究院,江苏扬州 225009;2.大连理工大学生命科学与药学学院,辽宁大连 124221
伊立替康是治疗实体瘤的常用化疗药,在体内发挥活性需先经由羧酸酯酶水解为具有药理活性的代谢产物SN-38 继而发挥出抗肿瘤活性。同时,SN-38 可由UDP-葡萄糖苷酸转移酶1A1(UDP-glucuronosyltransferase 1A1,UGT1A1) 催化为SN-38G 而失去活性。同服UGT1A1 抑制药物与伊立替康是药物相互作用引发不良反应的常见原因。
紫草在《中华人民共和国药典》记载具有清热凉血、活血解毒等功效,在中医典籍《本草纲目》中也记载了紫草有治疗炎症的功效。紫草素是从紫草中提取的具有生物活性的化合物。此外,近年来药理学研究还发现紫草素具有抗肿瘤、抗炎等作用。肿瘤患者有服用含紫草素的中药或紫草茶等保健品的可能,将来研究也可能将紫草素与伊立替康联合使用以提高抗肿瘤药效。因此,有必要评价紫草素与伊立替康同服是否会因抑制UGT1A1 进而引发草药-药物相互作用。
此外,UGT1A1 基因多态性是导致其活性的个体差异的重要原因。UGT1A1*6 突变基因型在亚洲人群中有较高的出现频率。在接受伊立替康治疗时,携带UGT1A1*6 基因型的患者SN-38 血药浓度相对UGT1A1*1 患者更高,更易发生严重毒性(如中性粒细胞减少症)。然而,紫草素对UGT1A1*1 和UGT1A1*6 催化SN-38 的葡萄糖醛酸化反应的抑制作用差异尚无报道。
本研究使用重组人UGT1A1*1 和UGT1A1*6 进行体外研究,探讨紫草素对UGT1A1*1 和UGT1A1*6催化SN-38 代谢的抑制作用,为避免临床药物之间的相互作用提供理论参考依据。
1 材料和方法
1.1 实验试剂和仪器
伞形酮(批号:BCCC1923)、二甲基亚砜(批号:BCBW5664)和甲酸(批号:H2014333)均购自阿拉丁公司(中国上海);六水氯化镁(批号:20150202)购自国药集团化学试剂有限公司(中国上海)。Tris-HCL缓冲液(pH=7.4)和紫草素(批号:1210E021)均购自北京索莱宝科技有限公司; 尿苷葡萄糖醛酸三钠 (5′-diphosphoglucuronic acid trisodium salt,UDPGA)(批号:C13203250) 购自上海麦克林生化科技有限公司;乙腈(批号:SHBN0815)购自德国Merck 公司;重组人UGT1A1*1 和UGT1A1*6 利用本课题组昆虫表达系统表达和制备。
超高效液相色谱QTRAP 6500 三重四级杆质谱联用仪(美国AB SCIEX),配有离子源是电喷雾离子化源(ESI)和Analyst 1.4.2 数据处理软件。AUY120 电子天平来自日本岛津公司; 可调速涡旋混合器来自Scientific Industries 公司;恒温混匀仪(Thermo Mixer C)来自德国艾本德公司;小型台式冷冻离心机(Centrifuge 5424 R)来自德国艾本德公司。
1.2 实验方法
1.2.1 溶液配制 用二甲基亚砜(dimethyl sulfoxide,DMSO)配制40 mmol/L 紫草素储备液,于-20°C 保存;用DMSO 将上述储备液稀释为紫草素浓度分别为0.2、1、2、5、10、50 和100 μmol/L 的工作液待用。UDP GA 用Tris-HCl 缓冲液(50 mmol/L,pH=7.4)稀释成浓度为50 mmol/L 的储备液,于-80°C 保存待用。氯化镁工作液(100 mmol/L)用超纯水配制,4°C 保存待用,保存时间不超过4 h。伞形酮(内标)用乙腈配制成2 μmol/L 的工作液,放置于4°C 待用。SN-38 用DMSO配制成浓度为500 μmol/L 和600 μmol/L 的工作液备用,-20℃冰箱长期避光保存。
1.2.2 超高效液相色谱-串联质谱(ultra-performance liquid chromatography tandem mass spectrometry,UPLC-MS/MS) 分析条件 使用本课题组已建立的UPLC-MS/MS 方法定量检测SN-38葡萄糖醛酸代谢产物SN-38G 的生成速率。色谱和质谱方法简单描述如下:待分析样品进样2 μl 后,使用流动相A(水,含0.1%甲酸)和流动相B(乙腈,含0.1%甲酸)于35℃下采用BEH Ccolumn(50 mm×2.1 mm,1.7 μm Waters 公司,Milford,MA) 色谱柱梯度洗脱分离。洗脱梯度条件为0~2 min,5%的流动相B;2.0~2.4 min,5%→50%的流动相B;2.4~3.0 min,50%的流动相B;3~4 min,50%→5%的流动相B;4~5 min,5%的流动相B。基于多反应监测(multiple-reaction monitoring,MRM)模式下,ESI 电离串联质谱法进行待测样品的检测。ESI 源参数:喷雾电压为5 500 V;碰撞气为medium;离子源雾化器为35 psi;加热辅助器为30 psi;气帘气为30 psi;停留时间为100 msc;离子传输毛细管温度为500℃;伞形酮去簇电压为42 V,碰撞能为31 V);SN-38G(去簇电压为20 V,碰撞能为45 V)。SN-38G 的母离子和子离子质荷比(m/z)分别为569.2和393.2。伞形酮(内标)的母离子和子离子m/z 分别为163.1 和107.1。
1.2.3 紫草素对UGT1A1*1 和UGT1A1*6 催化SN-38葡萄糖醛酸化反应的抑制作用 SN-38 分别与浓度为0、1、10 和100 μmol/L 的紫草素在氯化镁(10 mmol/L)、Tris-HCl(50 mmol/L,pH 7.4)和UGT1A1*1 或UGT1A1*6(5.2 nmol/L) 存在的条件下于37℃预孵育5 min 后,加入10 μL UDPGA(2.5 mmol/L 起始反应)。反应体系总体积为200 μL,其中有机溶剂(DMSO)最终浓度为1% (v/v)。SN-38 的终浓度接近其被UGT1A1 代谢的K值,UGT1A1*1 组为2.5 μmol/L,UGT1A1*6 组为3 μmol/L。37℃反应30 min 后,加入等体积4℃预冷的乙腈(含2 μmol/L 内标伞形酮)终止反应。待测样品在4°C 下以20 500×g 离心30 min,取上清。UPLCMS/MS 检测SN-38G 浓度。所有实验均重复3 次。
1.2.4 紫草素对UGT1A1*1 和UGT1A1*6 催化SN-38代谢抑制的半抑制浓度 (half-maximal inhibitory concentration,IC) 浓度梯度为0、0.2、1、2、5、10、50 和100 μmol/L 的紫草素分别与SN-38 在氯化镁(10 mmol/L)、Tris-HCl(50 mmol/L,pH 7.4)和UGT1A1*1 或UGT1A1*6(5.2 nmol/L)存在的条件下,于37℃预孵育5 min 后,加入UDPGA(2.5 mmol/L)起始反应。反应体系总体积为200 μl,其中有机溶剂(DMSO)最终浓度为1%(v/v)。SN-38 的终浓度接近其被UGT1A1 代谢的K值,UGT1A1*1 组为2.5 μmol/L,UGT1A1*6 组为3 μmol/L。37℃反应30 min 后加入200 μl 含内标(伞形酮浓度为2 μmol/L)的乙腈终止反应。样品在4℃条件下用20 500 r/min离心30 min 去除蛋白沉淀,UPLC-MS/MS 检测上清中SN-38G 的含量。使用GraphPad prism 7.0 对剩余酶活性与药物浓度之间的关系绘图,获得相应的IC。所有实验均重复3 次。
1.3 统计学方法

2 结果
2.1 紫草素对UGT1A1*1 和UGT1A1*6 催化SN-38葡萄糖醛酸化反应的抑制作用
紫草素可抑制UGT1A1 催化的SN-38 葡萄糖醛酸化反应。当其浓度为1、10 和100 μmol/L 时,UGT1A1*1催化SN-38 葡萄糖醛酸化的反应速率均低于对照组(未加紫草素)的反应速率,差异有统计学意义(P<0.05,图1A)。而且随着紫草素浓度的升高,UGT1A1*1催化的SN-38 葡萄糖醛酸化反应速率降低,1、10和100 μmol/L 紫草素组的反应速率分别为对照组的80.044%、29.318%和4.906%,各组差异均有统计学意义(P<0.05,图1A)。相似的,对于UGT1A1*6 催化的SN-38 葡萄糖醛酸化反应,紫草素浓度在1 至100 μmol/L 范围也可显著抑制SN-38G 的生成。紫草素在1、10 和100 μmol/L 浓度下SN-38 代谢产物(SN-38G)的生成速率均低于对照组(未加紫草素)的生成速率,差异有统计学意义(P<0.05,图1B)。同时,随着紫草素浓度的升高,UGT1A1*6 催化的SN-38G 的生成速率降低,1、10 和100 μmol/L 紫草素组中的反应速率分别为对照组的86.462%、43.145%和5.248%,且各组间差异有统计学意义(P<0.05,图1B)。紫草素对UGT1A1*1 和UGT1A1*6 催化SN-38 葡萄糖醛酸化的抑制作用均随紫草素浓度的升高而增强。
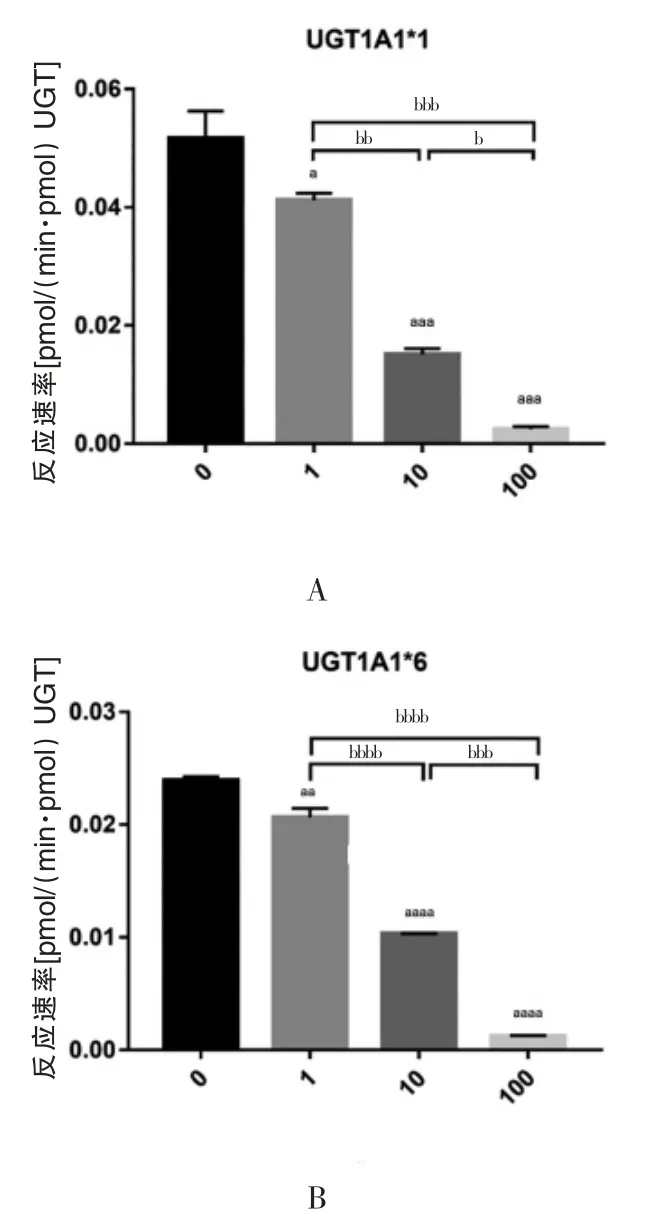
图1 不同浓度的紫草素对UGT1A1*1 和UGT1A1*6 催化的SN-38G 生成速率的影响
2.2 紫草素对UGT1A1*1 和UGT1A1*6 催化SN-38代谢抑制的IC50
在进一步定量分析紫草素对UGT1A1 催化SN-38 葡萄糖醛酸化的研究中发现,在0.2~100 μmol/L内,紫草素对UGT1A1*1 和UGT1A1*6 均表现出了随着紫草素浓度升高而增强的抑制作用,IC值分别为4.357 μmol/L 和7.353 μmol/L(图2)。紫草素对UGT1A1*1和UGT1A1*6 催化的SN-38 葡萄糖醛酸化均具有抑制作用。
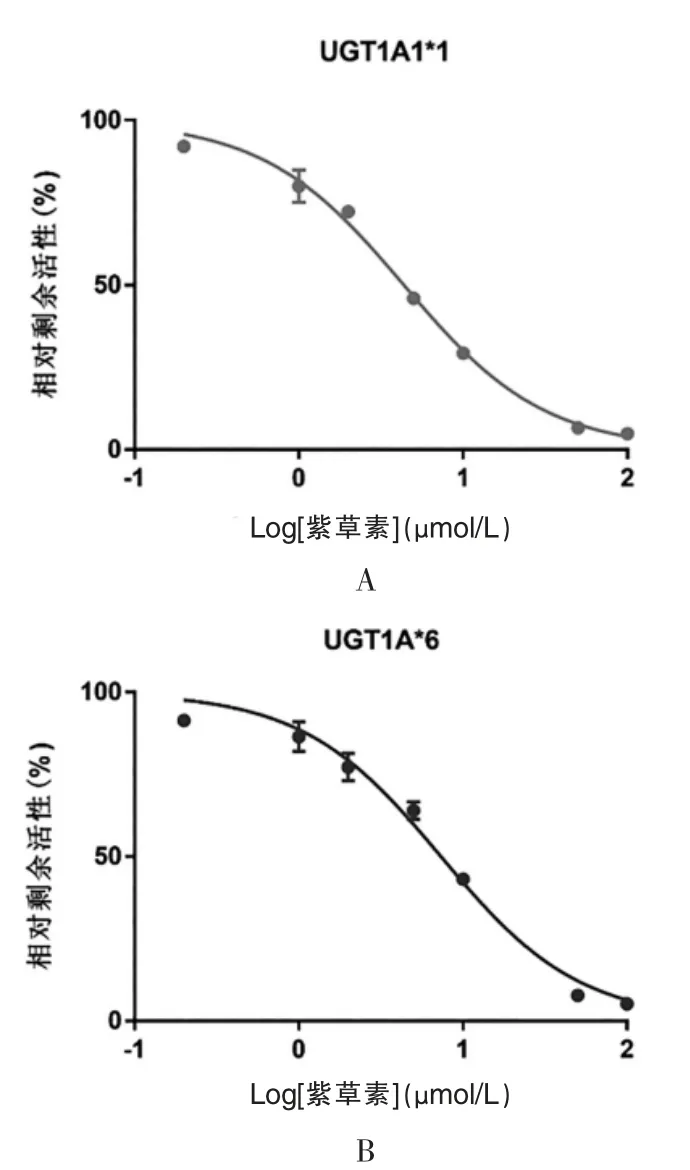
图2 紫草素对UGT1A1*1(A)和UGT1A1*6(B)催化的SN-38 葡萄糖醛酸化反应活性的抑制作用
3 讨论
目前草药或其主要活性成分和西药间的相互作用被广泛关注,已有报道证实了部分草药可能通过抑制药物代谢酶而引发草药-药物相互作用。UGT1A1是人体内代谢伊立替康活性代谢产物SN-38 的关键酶,多种影响因素例如其基因单核苷酸多态性或同服药物相互作用等皆可影响UGT1A1 酶的活性,进而导致体内过度蓄积伊立替康活性代谢产物SN-38,引发中性粒细胞减少、腹泻等不良反应。值得注意的是,在人和大鼠肝微粒体的体外研究中发现,紫草素也可抑制UGT1A1 催化的β-雌二醇-3-葡萄糖醛酸化。该结果表明紫草素是UGT1A1 的抑制剂,提示了伊立替康与含紫草素的制剂联合使用时,紫草素可能会通过抑制UGT1A1 活性,进而增加SN-38 血药浓度并导致伊立替康不良反应的发生。但目前尚无定量研究评价紫草素是否抑制SN-38 的葡萄糖醛酸化,是否存在引发草药-药物相互作用的风险。
本研究发现紫草素对野生型UGT1A1(即UGT1A1*1)催化SN-38 的葡萄糖醛酸化存在抑制作用,且该抑制作用随紫草素浓度的升高而增强,IC值为4.357 μmol/L。中药对药物代谢酶的抑制程度可以分为强抑制、中等抑制和弱抑制,当IC值小于10 μmol/L时为强抑制,IC值在10~50 μmol/L 之间为中等抑制,IC值大于50 μmol/L 时为弱抑制。根据本研究结果,紫草素对野生型UGT1A1 存在强抑制作用,当含紫草素的制剂与伊立替康同服时,需注意引发草药-药物相互作用的风险。
UGT1A1*6 这种UGT1A1 编码区突变的突变体在亚洲人群中出现频率较高(为16%~40%),该突变会导致SN-38 的代谢清除降低。研究发现紫草素对UGT1A1*6 也存在较强的抑制作用,IC值为7.353 μmol/L,尽管该值高于对UGT1A1*1 抑制的IC,对其抑制作用弱于UGT1A1*1,但仍处在强抑制作用范围内。此外,临床研究发现,基因型为UGT1A1*6纯合突变的个体SN-38 存在约二倍的血浆浓度-时间曲线下面积(area under the plasma concentrationtime curve,AUC)升高。因此,基因型为UGT1A1*6的患者服用紫草素制剂会进一步增加SN-38 的血药浓度,造成因SN-38 在体内的过多积累,存在进一步加重伊立替康不良反应的风险。因此,联合使用紫草素制剂与伊立替康时更需注意患者的基因型,以免引发不良发应。
综上所述,紫草素与伊立替康共同服用时,可能通过抑制UGT1A1 催化的SN-38 的代谢,从而增加SN-38 的血药浓度,存在引发草药-药物相互作用的风险。紫草素对UGT1A1*1 和UGT1A1*6 的抑制均属于强抑制作用,但对前者的抑制作用更强。同时考虑到UGT1A1*6 纯合基因型患者本身SN-38 代谢清除降低,对此类基因型联用紫草素制剂和伊立替康更需注意草药-药物相互的潜在风险。本研究结果为科学指导紫草素制剂和伊立替康合理联用提供理论基础,避免因UGT1A1 抑制而导致的药物不良反应的发生,具有重要参考的价值。
