乌骨藤总苷对肺腺癌NCI-H1299细胞糖酵解、凋亡和自噬作用的影响
2022-10-20王晨亮刘浩茹李观华
王晨亮 张 菁 刘浩茹 李观华
江西省九江市第一人民医院病理科,江西九江 332000
肺腺癌(lung adenocarcinoma,LUAD)是非小细胞肺癌的主要亚型之一,是恶性程度最高的癌症之一,通常在晚期被诊断出,临床预后较差,5年生存率低。研究发现,糖酵解与非小细胞肺癌的增殖和转移密切相关,并受到Kirsten 大鼠肉瘤病毒癌基因同源物(Kirsten rats arcoma viral oncogene homolog,KRAS)的调控,KRAS 是引发肺癌的关键基因之一,近年来针对KRAS 为分子治疗靶点的研究越来越多。乌骨藤总苷是乌骨藤辅助抗癌的主要成分,对胃癌、肉瘤、白血病、肝癌等肿瘤具有抑制作用。有研究发现,复方乌骨藤胶囊对Lewis 肺癌小鼠具有抑瘤作用, 并能够增强其肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和自然杀伤(natural killer,NK)细胞活性,从而提高荷瘤小鼠的免疫功能。目前关于乌骨藤总苷的研究还较少,乌骨藤总苷的一些作用机制也尚不明确,本研究主要就乌骨藤总苷对肺癌细胞的影响及机制进行研究,为乌骨藤总苷的进一步开发应用奠定基础。
1 材料与方法
1.1 细胞株
人非小细胞肺癌细胞NCI-H1299 购自ATCC。将H1299 细胞置于37℃、5% CO的培养箱中,使用含有10%胎牛血清和1%青/链霉素的RMPI-1640 培养液培养。及时更换培养液,当细胞融合度达到80%~90%时用胰酶消化后进行传代。
1.2 仪器与试剂
乌骨藤总苷(自制,C21 甾体苷类成分含量>80%);MTT 噻唑蓝(北京索莱宝科技有限公司,批号:303HO510);二甲基亚砜(上海钰博生物科技有限公司,货号:YB60313ES60);RPMI 1640 培养基[爱必信(上海)生物科技有限公司,货号:abs9468];葡萄糖定量试剂盒(美国AAT Bioquest 公司,货号:AAT-40004);胎牛血清[爱必信(上海)生物科技有限公司,批号:190A19];Trizol(上海研卉生物科技有限公司,批号:50175111);磷酸缓冲盐溶液(上海梵态生物科技有限公司,货号:FT21046yy);通用反转录试剂盒[金克隆(北京)生物技术有限公司,货号:RE0510-50T];Lactate Colorimetric Assay Kit Ⅱ乳酸试剂盒(深圳欣博盛生物科技有限公司,货号:K627-100);KRAS 抗体(英国Abcam 公司,货号:ab275876);GAPDH(5174)、Bax 抗体(5023)、Bcl-2 抗体(3498)、LC3A/B 抗体(4108)、beclin-1 抗体(3495)、HRP 标记的羊抗兔二抗(7074)均购于美国Cell Signaling Technology 公司。荧光定量PCR 仪(美国伯乐Bio-rad 公司,型号:CFX96Touch);全自动凝胶成像分析仪(上海鄂禾仪器有限公司,型号:SH-EHE-288);多功能酶标仪(美国赛默飞世尔科技公司,型号:Varioskan LUX);流式细胞仪(美国贝克曼库尔特有限公司,型号:CytoFLEX)。
1.3 方法
1.3.1 实验分组与处理 取对数生长期的H1299 细胞,随机分为对照组、乌骨藤总苷低剂量组、乌骨藤总苷高剂量组、 乌骨藤总苷+Vector 组和乌骨藤总苷+KRAS 组。乌骨藤总苷低剂量组和乌骨藤总苷高剂量组分别用终浓度为5、20 mg/ml 的乌骨藤总苷处理H1299 细胞; 乌骨藤总苷+Vector 组先转染阴性对照载体,再用20 mg/ml 的乌骨藤总苷处理; 乌骨藤总苷+KRAS 组先转染KRAS 过表达载体,再用20 mg/ml的乌骨藤总苷处理;对照组不转染,用正常培养基正常培养。
1.3.2 qRT-PCR 检测各组H1299 细胞KRAS 表达水平 取各组生长状态良好的细胞,吸弃培养液,胰酶消化后离心,将细胞用PBS 清洗后离心,收集细胞。用Trizol 法提取细胞总RNA,然后使用反转录试剂盒将总RNA 反转录为cDNA,使用qRT-PCR 法检测KRAS 的相对表达水平,所用引物为:F:5′-CCA ATTGTGAATGTTGGTGTG-3′,R:5′-CCAATTAGA AGGTCTCAACTG-3′。根据2的方法计算目的基因的相对表达水平。
1.3.3 MTT 检测各组H1299 细胞增殖抑制率 将各组细胞接种于96 孔板中,每组3 次重复。在每孔中加入MTT 20 μl,37℃下培养4 h,弃上清液,然后再加入150 μl 的二甲基亚砜 (dimethyl sulfoxide,DMSO),摇床振荡10 min,充分混匀,使用酶标仪在490 nm 波长处测定各孔的吸光值(optical density,OD),实验重复3 次。细胞抑制率计算公式为: 细胞抑制率=对照组OD-处理组OD/空白对照组OD×100%。
1.3.4 葡萄糖消耗量和乳酸含量 取各组细胞离心,收集细胞上清液,葡萄糖消耗量使用葡萄糖定量试剂盒进行检测,采用Lactate Colorimetric Assay Kit Ⅱ乳酸试剂盒检测细胞培养基中的乳酸含量,具体实验操作按照试剂盒说明书进行。
1.3.5 流式细胞术检测各组H1299 细胞凋亡率 取各组细胞,加入胰酶消化,弃上清液,加入PBS 液洗涤2次,离心收集细胞,转移至EP 管中,加入200 μl 1×的结合缓冲液重悬细胞,然后在细胞悬液中加入5 μl的Annexin V 和5 μl 碘化丙锭(propidine iodide,PI)混匀,避光反应15 min,流式细胞仪上样检测各组细胞凋亡情况。实验重复3 次。
1.3.6 Western blot 检测KRAS 蛋白和凋亡和自噬相关蛋白表达水平 将已弃去培养液的细胞用预冷的PBS 清洗3 次,加入蛋白裂解液提取各组细胞总蛋白,BCA 法对提取的蛋白质进行定量检测。用SDSPAGE 凝胶电泳分离蛋白质,电泳结束后使用PVDF膜进行转膜,室温封闭1 h。加入一抗稀释液:KRAS(1∶1 000),Bcl-2(1∶1 000),Bax(1∶1 000),LC3A/B(1∶1 000)和beclin-1(1∶2 000),4℃冰箱过夜。回收一抗,TBST 洗膜后,加入二抗稀释液(1∶5 000),室温孵育1 h,洗膜,采用增强化学发光(enhanced chemiluminescence,ECL)试剂显影,拍照并进行分析。
1.4 统计学方法

2 结果
2.1 各组H1299 细胞KRAS 表达水平的比较
乌骨藤总苷低剂量组和高剂量组KRAS mRNA和KRAS 蛋白表达水平低于对照组,差异有统计学意义(P<0.05)。乌骨藤总苷高剂量和乌骨藤总苷+Vector组KRAS mRNA 和KRAS 蛋白表达水平比较,差异无统计学意义(P>0.05)。乌骨藤总苷+KRAS 组KRAS mRNA 和KRAS 蛋白表达水平高于乌骨藤总苷+Vector组,差异有统计学意义(P<0.05)(图1,表1)。

图1 Western blot 检测各组H1299 细胞KRAS 表达水平

表1 各组H1299 细胞KRAS 表达水平比较(n=9,±s)
2.2 各组H1299 细胞增殖水平的比较
乌骨藤总苷不同剂量组细胞增殖抑制率均高于对照组,克隆形成数均低于对照组,差异有统计学意义(P<0.05)。乌骨藤总苷+KRAS 组细胞增殖抑制率低于乌骨藤总苷+Vector 组,克隆形成数高于乌骨藤总苷+Vector 组,差异有统计学意义(P<0.05)(图2,表2)。

表2 各组H1299 细胞增殖水平比较(n=9,±s)

图2 各组H1299 细胞克隆形成情况
2.3 各组H1299 细胞糖酵解水平的比较
乌骨藤总苷低剂量组和高剂量组的葡萄糖消耗量和乳酸含量低于对照组,差异有统计学意义(P<0.05);乌骨藤总苷+KRAS 组葡萄糖消耗量和乳酸含量高于乌骨藤总苷+Vector 组,差异有统计学意义(P<0.05)(表3)。

表3 各组H1299 细胞葡萄糖消耗量和乳酸含量的比较(n=9,±s)
2.4 各组H1299 细胞凋亡水平的比较
乌骨藤总苷不同剂量组细胞凋亡率高于对照组,差异有统计学意义(P<0.05)。乌骨藤总苷+KRAS 组细胞凋亡率低于乌骨藤总苷+Vector 组,差异有统计学意义(P<0.05)(图3,表4)。

表4 各组H1299 细胞凋亡水平的比较(n=9,±s)
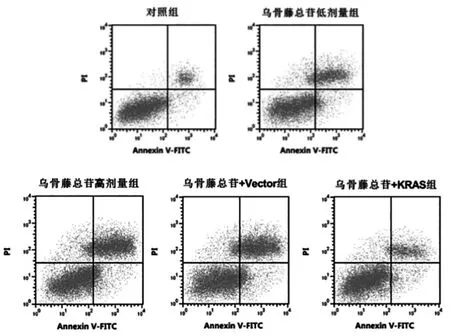
图3 流式细胞术检测各组H1299 细胞凋亡率
2.5 各组H1299 细胞凋亡与自噬相关蛋白表达水平
乌骨藤总苷低剂量组和高剂量组Bax、LC3-Ⅱ/Ⅰ和beclin-1 蛋白水平高于对照组,Bcl-2 蛋白水平低于对照组,差异有统计学意义(P<0.05)。乌骨藤总苷+KRAS 组Bax、LC3-Ⅱ/Ⅰ、beclin-1 蛋白水平低于乌骨藤总苷+Vector 组,Bcl-2 蛋白水平高于乌骨藤总苷+Vector 组,差异有统计学意义(P<0.05)。乌骨藤总苷高剂量组和乌骨藤总苷+Vector 组的蛋白表达水平比较,差异无统计学意义(P>0.05)(图4,表5)。

图4 Western blot 检测各组H1299 细胞Bax、Bcl-2、LC3-Ⅱ/Ⅰ、beclin-1 蛋白表达

表5 各组H1299 细胞Bax、Bcl-2、LC3-Ⅱ/Ⅰ、beclin-1 蛋白表达水平比较(n=9,±s)
3 讨论
肺癌是常见的呼吸系统恶性肿瘤,其病因结构复杂,早期很难发现且转移性高,在全球范围内都表现出高发病率和高死亡率。肺癌主要有两种:小细胞肺癌和非小细胞肺癌,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)在原发性肺癌中的占比更大,约占85%。乌骨藤又名通关藤,为萝藦科多年生攀援植物,主要以干燥藤茎入药,具有祛风湿、通经活血、止血等作用。现代研究表明,乌骨藤提取物对多种肿瘤细胞的增殖都具有良好的抑制作用,且毒副作用小。
KRAS 是非小细胞肺癌中一种最常见的突变基因,约20%~30%的非小细胞肺癌存在KRAS 突变。研究发现,当KRAS 基因发生突变,会导致其编码的蛋白持续活化,进而激活MAPK 信号通路、AKT 信号通路等下游信号通路,驱动细胞生长和增殖。周琳等在临床研究中发现,Adagrasib 作为一种针对KRAS G12C 突变的口服小分子共价抑制剂,对NSCLC 治疗方案起到了补充作用,且不良反应少,耐受性较好,是一种具有潜力的NSCLC 治疗药物。本研究结果显示,乌骨藤总苷可明显抑制KRAS 的表达水平,且当KRAS 过表达时肺腺癌细胞增殖抑制率和细胞凋亡率会明显降低,提示乌骨藤总苷可能通过抑制KRAS 的表达抑制肺腺癌细胞的生长和增殖,且抑制作用会随着乌骨藤总苷所用剂量的升高而增强。
肿瘤细胞即使是在氧气充足的条件下亦表现出明显的糖酵解活性,消耗大量葡萄糖并产生乳酸,此种异常代谢现象被称为Warburg 效应,Warburg 效应在大多数恶性肿瘤细胞中均存在,可以为肿瘤细胞提供大量增殖所需的能量,还可以提供对肿瘤细胞转移有利的酸性环境,因此抑制糖酵解水平可在一定程度上发挥抗癌作用。本研究通过检测各组细胞的葡萄糖消耗量和乳酸含量可以发现,高、低剂量的乌骨藤总苷对肺腺癌细胞的糖酵解过程具有抑制作用,可以明显抑制肺腺癌细胞的Warburg 效应,减少肿瘤细胞能量供给,从而抑制肿瘤细胞的增殖能力。郭舜等研究发现,黄芩素可同时参与肝癌细胞糖酵解及谷氨酰胺代谢从而抑制肝癌细胞的增殖降低肝癌细胞能量代谢水平。且研究发现,DEPDC1 可能通过调节KRAS/MEK/ERK 信号通路来影响糖酵解,进而影响肝细胞癌进展。上述实验结果与本文结果具有一致性。
肿瘤细胞往往具有无限复制潜能、凋亡抵抗等能力,因此诱导肿瘤细胞凋亡和自噬也是治疗肿瘤的重要策略之一。Bcl-2 家族蛋白是在凋亡过程中起重要作用的蛋白家族,其中Bax 有促进细胞凋亡的作用,而Bcl-2 具有抗凋亡作用。LC3-Ⅱ、LC3-Ⅰ和beclin-1 是参与调控细胞自噬过程的重要蛋白,Beclin-1 是自噬重要的正调节因子,在自噬起始阶段起关键作用;LC-3 是自噬体膜的标记物,有LC3-Ⅰ和LC3-Ⅱ两种形式,且LC3-Ⅱ含量的多少在某种程度上反映了细胞的自噬活性。在本研究结果中可以发现,乌骨藤总苷低剂量组和高剂量组对肺腺癌细胞凋亡和自噬过程的相关蛋白具有调控作用,且过表达KRAS 时会反转乌骨藤总苷的作用效果,即乌骨藤总苷可能通过调控KRAS 的表达从而对凋亡和自噬相关蛋白的表达起调控作用,促进肺腺癌细胞的凋亡和自噬,从而控制肿瘤细胞数量。
综上所述,乌骨藤总苷可以通过抑制KRAS 的表达,调控肺腺癌细胞的糖酵解、凋亡和自噬过程,从而对肺腺癌细胞的增殖起到抑制作用,且乌骨藤总苷对肺腺癌细胞增殖的抑制作用具有剂量依赖性。
