ABC转运蛋白介导鳞翅目害虫调控Bt抗性的研究进展
2022-10-19顾俊文张珀瑞王月琴李学海王靖怡张琪
顾俊文,张珀瑞,王月琴,李学海,王靖怡,张琪
(1.沈阳农业大学 植物保护学院,沈阳 110161;2.中国农业科学院植物保护研究所/植物病虫害国家重点实验室,北京 100193)
1 苏云金芽孢杆菌及其杀虫机制
苏云金芽孢杆菌(Bacillus thuringiensis,Bt)属芽孢杆菌科,是土壤中自然存在的革兰氏阳性细菌,对多种幼虫具高效的毒杀效果,具有安全高效,使用广谱等特点[1]。Bt主要以转基因活性成分和微生物菌剂的方式应用于微生物农药市场,约占全球微生物杀虫剂市场的95%以上[2]。Bt最大的特点就是有效地避免了化学农药对环境的污染,通过降低害虫种群密度增加农作物的产量,提高农民的经济效益[3]。截至2018年,世界上26个国家种植的转Bt基因作物已超过1.917亿hm2,相比1996年增加100多倍,为全世界带来了显著的环境改善和经济效益[4]。
鉴于其具备很高的宿主特异性和环境安全性,近几十年来,Bt已然成为应用最广泛、农业生产上最具竞争力的杀虫剂[3],然而,阻碍该优秀微生物杀虫剂长效利用的主要原因是害虫对其产生了抗药性。目前,已经报道的对转Bt基因作物产生抗药性的农业害虫包括小菜蛾(Plutella xylostella)[5]、粉纹夜蛾(Trichoplusia ni)[6]、入侵害虫草地贪夜蛾(Spodoptera frugiperda)[7]、玉米蛀茎夜蛾(Busseola fusca)[8]、玉米根萤叶甲(Diabrotica virgifera)[9]、棉红铃虫(Pectinophora gossypiella)[10]等。尽管世界范围内的科学家对Bt抗性机理研究不断深入,研究者发现Bt毒蛋白的不同晶体对害虫的抗性机制存在差异,作用机制尚未透彻解析。生产上的解决办法主要集中在结合两种或两种以上的整合Bt毒蛋白来增强杀虫效力,但这种方法常因害虫对一种毒蛋白产生抗性进而对其他多种Bt毒蛋白具有交叉抗性而成效甚微。因此,深入了解产生Bt抗药性的遗传学基础可以更有效地监测、阻碍和管理害虫对Bt毒蛋白抗药性的综合治理难题。Bt的杀虫活性成分来源于产孢过程中的伴胞晶体(parasporal crystal),其主要成分为crystal(Cry)、cytolytic(Cyt)和vegetative(Vip)蛋白[1,11]。在已鉴定的294个Cry毒蛋白中,有262个毒蛋白属于三结构域蛋白(约占89%)[1]。其中结构域I由7~8个α螺旋组成,结构域II由3个ß折叠构成,结构域III由两个反向平行的ß折叠组成[12]。Cry毒蛋白均含有5个保守的序列区段(conserved blocks),含有全部或部分保守区段的Cry毒蛋白具有相同的三结构域分子模型。
目前,关于Bt作用机制主要存在3种不同的解析模型。第1种是穿孔模型,该模型阐述了Bt芽孢萌发期产生的70~130kDa的Cry毒蛋白在肠道碱性环境溶解成原毒蛋白(protoxin),经活化酶从C-和N-端酶切大约43个氨基酸成为55~65kDa的核心活化毒蛋白(activated toxin),与中肠上皮细胞刷状缘膜囊泡(brush border membrane vesicles,BBMV)上的靶标蛋白作用,促进其在脂筏上的聚集和穿孔,继而导致细胞渗透性死亡。经过多年探索,被研究者们筛选出的参与结合的受体蛋白主要包括钙粘蛋白、GPI-anchored氨基肽酶N(APN)、碱性磷酸酶(ALP)、糖脂(glycolipid)等中肠分子[13],以及近几年发现的三磷酸腺苷结合盒转运蛋白(ATP-binding cassette transporter subfamily,ABC转运蛋白)[14]。第2种是信号转导学说,该学说认为,毒蛋白先与钙粘蛋白结合激活Mg2+诱导的信号传导通路,刺激G蛋白和腺苷酸环化酶在胞内的表达,最终导致细胞因离子失衡凋亡[1]。第3种假说则报道了肠道共生菌对毒蛋白在鳞翅目的杀虫作用直接相关[15]。随后几项研究又称共生菌与Bt毒蛋白的作用相关,但是在多种虫体内差异较大[15],随后有报道称共生菌与Bt作用机制没有直接关联[16]。
2 ABC转运蛋白研究进展和存在的问题
ABC转运蛋白是一类广泛存在于原核、真核生物和古细菌中的跨膜蛋白。ABC基因家族现在被认为是所有生命体中最大的转运蛋白家族之一。ABC转运蛋白的大多数蛋白质作为主要的活性转运体,结合和水解ATP,跨脂膜运输大量不同的底物,除了作为转运蛋白底物,ABC转运蛋白调控离子通道,影响受体蛋白和核糖核酸酶抑制剂的翻译及组装[17]。在人体表达的48种ABC转运蛋白中,其中17个被报道与人类遗传性疾病相关,如囊性纤维化、肾上腺脑白质营养不良和胆固醇代谢等,且与患肿瘤病人的耐药反应相关[18]。
使用Phyre2[19]构建了亚洲玉米螟ABC家族中ABCG1的跨膜结构域的拓扑结构(图1),用以直观展现预测的ABC转运蛋白跨膜结构。并根据PyMOL软件预测了ABCG1蛋白的三维结构(图2),同时预测的不同氨基酸的空间位置以红黄绿3种不同颜色将ABC转运蛋白的三维结构进行标记。如图2中,红色区域显示蛋白的胞外区,黄色区域显示跨膜区,红色区域显示胞内区。
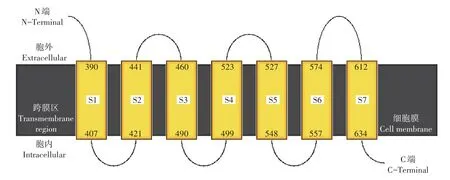
图1 亚洲玉米螟ABCG1蛋白跨膜结构域拓扑结构Figure 1 Topology of transmembrane helices of O.furnacalis ABCG1 protein
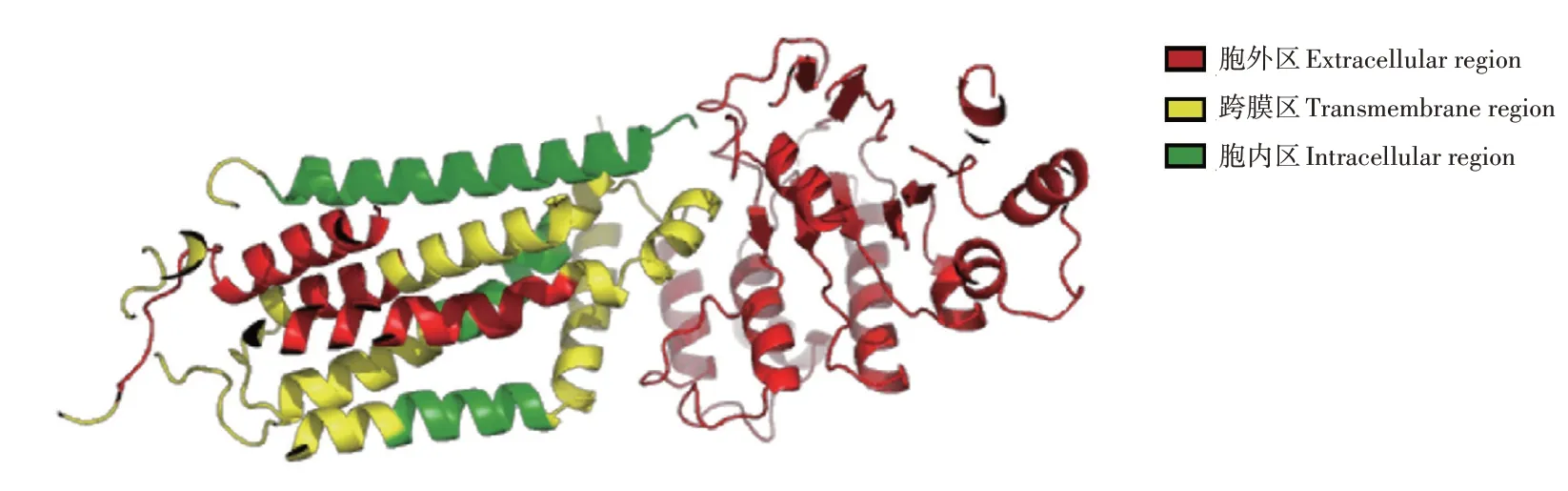
图2 亚洲玉米螟ABCG1蛋白三维结构Figure 2 Three-dimensional structure of O.furnacalis ABCG1 protein
在结构上,ABC转运蛋白由两个胞内核苷酸结合域(nucleotide binding domain,NBD)和两个跨膜蛋白区域(trans-membrane domain,TMD)组成,其中NBD通过与ATP结合和水解来转运底物穿越细胞膜。依据系统发育分析、核苷酸结合域的同源性和重要的功能性作用,研究者将ABC转运蛋白分为A~H共8个亚科。第1个被鉴定的昆虫ABC转运蛋白基因来自黑腹果蝇的White基因,研究发现其参与眼睛色素前体的转运[20]。在人类、细菌和线虫的研究中,ABC转运蛋白已被确认与多种药物的耐药性有关,人们对该家族在节肢动物内源性和外源性物质转运中的作用和在害虫抗药性中的功能作用研究近几年来取得了杰出进展[1]。
Bt毒蛋白抗性的形成与受体基因的突变、氨基酸缺失、蛋白表达量变化有关[21]。与抗性调控相关的蛋白主要包括钙粘蛋白、APN、ALP、V-ATP酶和ABC转运蛋白等[1,14]。研究者发现,ABC转运蛋白具有向胞外转运毒性分子的功能,其表达量的改变参与了昆虫对化学农药的抗性调节[22-23]。研究者通过分子连锁图谱定位了高抗烟芽夜蛾(Heliothis virescens)中的一个ABC转运蛋白,其基因序列中的一个碱基突变导致蛋白序列变化引起了害虫对Cry1Ac的抗性,该报道开启了发现Bt抗性机制脱离传统受体的先河[14]。与烟芽夜蛾同源的一种敏感品系家蚕(Bombyx mori)的ABC转运蛋白基因被转入到抗性家蚕体内后,毒性生物测定显示家蚕对Cry1Ab失去了抗性,此报道证明ABC转运蛋白为Cry1Ab毒蛋白的功能性受体蛋白[24]。与敏感品系相比,抗性小菜蛾中ABC转运蛋白基因缺失了30个碱基,此缺失删除了最后的第十二跨膜域并使得羧基端异常异位,导致此蛋白留在了非功能区的细胞外[25]。细胞水平实验提出家蚕ABC转运蛋白可以作为Cry1Ac的作用靶标,使果蝇细胞对毒蛋白的敏感性因该蛋白的转化入细胞而由抗性变感性[24,26]。对ABC家族中不同蛋白的分析表明,ABCC2和ABCC3两种蛋白的转录水平差异与甜菜夜蛾(Spodoptera exigua)对Cry1Ac和Cry1Ca毒蛋白的抗性有关[27]。后期研究报道称,ABCC2作为Cry1Ac的受体活性要比ABCC3高100倍以上,同时在小菜蛾中ABCC2也显示出比ABCC3相对强的受体功能,但两种ABCC蛋白均参与虫体对Cry1Ac的抗性调节过程,均为不完全隐性[25]。该基因的突变不仅使棉铃虫(Helicoverpa armigera)对Cry1Ac敏感性降低,还对阿维菌素产生负交叉抗性,使虫体对其更加敏感[28]。
此外,由CRISPR/Cas9基因编辑系统介导的ABCC2和ABCC3的共同敲除导致棉铃虫(H.armigera)对Cry1Ac的抗性提升超过15000倍,而单独敲除任意一种几乎对Cry1Ac的抗性没有提升效果,证明单独一种ABCC2或ABCC3即可起到Cry1Ac的受体功能,且抗性遗传为常染色体上的隐性遗传[28]。对小菜蛾进行ABCC2和ABCC3的基因敲除后发现,该两种ABCC蛋白中任意一个突变体都使得小菜蛾对Cry1Ac和Cry1Fa产生2.9倍的抗性,但当同时敲除两个受体后,小菜蛾显示出对Cry1Ac毒蛋白1000倍以上的抗性,对Cry1Fa毒蛋白显示出380倍的抗性,可见ABC转运蛋白作为Cry毒蛋白的潜在受体的独立和协同作用[29]。对粉红棉铃虫易感APHIS-S种群的ABCA2基因进行编辑研究报道,缺失ABCA2基因的粉红棉铃虫显著增加对Cry2Ab毒蛋白的抗性[30]。在粉纹夜蛾里通过CRISPR/Cas9介导的反向功能性研究也证实了ABCC2突变体对Cry1Ac抗性的直接作用[31]。通过基因编辑技术对亚洲玉米螟(Ostrinia furnacalis)的抗性研究发现8个碱基的突变可使ABCC2提前终止其转录并使玉米螟对Cry1Fa的抗性上升300多倍,证明ABCC2对Cry1Fa的功能性作用,但此突变使玉米螟对Cry1Ab的敏感性变化较小,仅提高3.6倍抗性[32],此微小敏感性变化也许是同Cry1Fa交互抗性的结果。进一步研究发现,对亚洲玉米螟的ABCG4基因进行编辑显著提高了对Cry1毒蛋白的抗性,由此可推测,不同的ABC转运蛋白可以作为不同Cry毒蛋白的特异性受体[33]。
针对转基因玉米的重要活性成分Cry1Ab的抗性机制研究首次由ATSUMI S等[34]于2012年在模式昆虫家蚕中报道,研究发现家蚕对Cry1Ab的抗性是由单个氨基酸酪氨酸(Tyrosine)在ABCC2蛋白胞外loop2的234位上插入引起的。进一步研究确定了ABCC2作为Cry1Ab抗性靶点的重要作用,且对不同Cry家族内的不同毒蛋白如Cry1Aa、Cry1Ab、Cry1Ac、Cry1Fa、Cry3Bb甚至Cry8Ca毒蛋白均有不同程度的靶标特异性[26]。Loop2上234位点的突变可以破坏ABCC2作为Cry1Ab的受体功能,影响细胞对Cry1Ab和Cry1Ac的敏感性,但对Cry1Aa毒蛋白无影响。不同于Cry1Ab和Cry1Ac的是,ABCC2对Cry1Aa的抗性靶点不在loop2,而是在loop4上,证明了毒蛋白结构的差异会影响ABCC2的作用靶点以及作为受体的功能性作用[35]。近期在草地贪夜蛾上分析了SfABCC2和SfABCC3在害虫中对Cry1Fa和Cry1Ab毒蛋白毒性中的作用。利用CRISPR/Cas9基因组编辑系统,建立了两个编码潜在功能性Bt受体的SfABCC2和SfABCC3基因敲除草地贪夜蛾品系。与敏感菌株相比,两种基因敲除菌株对Cry1Fa和Cry1Ab毒蛋白均表现出抗性。与SfABCC3基因敲除菌株相比,SfABCC2基因敲除菌株对这两种Cry毒蛋白表现出更高的抗性,表明SfABCC2在这些Cry毒蛋白的作用模式中起主要作用[36]。
在细胞水平上对烟芽夜蛾ABC转运蛋白的靶标特性的研究也发现,在果蝇细胞中过表达ABCC2使得该细胞对Cry1Aa、Cry1Ab和Cry1Ac 3种毒蛋白由抗变感,且3种毒蛋白的作用机制与ALP无直接关联,证明ABCC2作为毒蛋白受体的靶标作用[37]。通过对小菜蛾感性与抗性品系分析亦发现ALP与ABCC2均有不同程度的转录水平差异,预示了它们可能参与抗性调控,但对小菜蛾Cry1Ac的高抗机制研究中否定了钙粘蛋白、APN和ALP等经典肠道受体的突变与抗性机制的相关性[38]。ABC基因的突变不仅使虫提对Cry蛋白敏感性发生变化,还使其虫体对化学农药产生负交互抗性[28],这使ABC转运蛋白与Bt毒蛋白和化学农药之间的交互抗性调节作用机制更加复杂,是否因具有共同靶点而产生交叉抗性有待深入探讨。对于上述结果分析,不难发现,Cry毒蛋白在幼虫体内的作用机制主要依赖于与受体蛋白结合激活信号传导通路或使得细胞穿孔,最终导致细胞死亡。其抗性形成可能是由于靶标受体蛋白转录水平的变化使得毒蛋白无法锚定在肠膜的上皮细胞表面,进而导致毒性消失;也有可能是由于靶标蛋白突变体的形成使得受体与毒蛋白结合位点消失,引起毒蛋白失活。近期关于ABC转运蛋白在几种昆虫中的抗性研究可以预见,ABC转运蛋白很有可能是Bt毒蛋白的通用受体[23],所有针对ABC转运蛋白研究的开展为明确受体与毒蛋白互作机制研究提供了同源建模模板和关键氨基酸突变的参考。
3 亚洲玉米螟ABC基因家族生物信息学分析
玉米螟是全球玉米的主要害虫,每年会造成6×106~9×106t的产量损失,严重阻碍了玉米作为主粮、饲料和工业产品的原料的高质与高产[39]。在中国,亚洲玉米螟是对玉米最具破坏性的重要害虫,分布范围向北横跨中国北部,向东从印度横跨中国南部、韩国、日本、菲律宾、澳大利亚和所罗门群岛[40-42]。亚洲玉米螟以幼虫钻蛀为害为主,既取食寄主的嫩叶和花丝,又可取食寄主植物的籽粒部位,导致玉米受到严重破坏[42-43]。除了取食玉米外,亚洲玉米螟也会为害其他作物,如粮食作物中的高粱、小米等[44-45]。在过去的20年中,表达Bt毒素的转基因作物已被用于控制一系列农业害虫[4]。然而由于大规模种植,不可避免地导致目标昆虫对毒素产生抗性,Bt作物面临着巨大威胁[46-48]。对Bt作物的田间抗性在玉米螟中尤为突出。以转基因Bt作物为食的田间采集的欧洲玉米螟已被证明对Bt毒素具有抗性[47],在实验室环境中以人工环境喂养时,亚洲玉米螟也表现出对Cry1A毒素的高抗性[49]。
近几年来,随着生物信息学技术的迅速发展,特别是新一代测序技术的低成本和高效的特点,大大促进了昆虫生物信息学分析和昆虫关键基因筛选的进程。依据基因组测序,研究者们建立了一系列昆虫基因组数据库[50-53]。亚洲玉米螟基因组的测序成功为分析其功能性基因提供了生物信息平台和分析基础[54]。本研究利用生物信息学方法对玉米螟ABC家族成员进行鉴定,将亚洲玉米螟ABC基因家族基因通过与部分物种的ABC基因聚类,并对玉米螟ABC家族基因进行分组,并构建其系统发育树(图3),发现ABC基因因为具有高度同源序列聚类在一起,同时对这些基因的序列(图4)分析能够发现这些物种的ABC基因都包含同源部分,这表明ABC家族基因具有高度保守性。
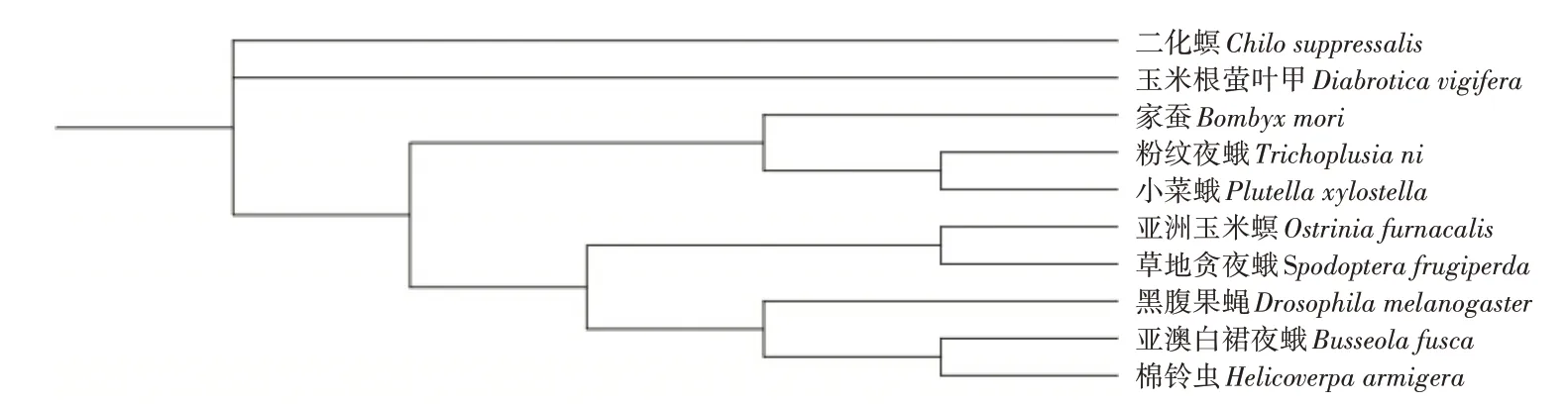
图3 ABC基因系统发育树分析Figure 3 Phylogenetic analysis of ABC genes

图4 ABC家族基因成员序列对比Figure 4 Sequence alignment of ABC family gene
本研究旨在提供玉米螟ABC基因家族基本信息,为进一步研究ABC家族成员在玉米螟抗Bt方面的调控作用提供参考。为了鉴定亚洲玉米螟中的ABC家族基因,从Insectbase2.0数据库中获得了亚洲玉米螟基因组数据(http://v2.insect-genome.com),使用HMM模型(PF0005)对基因组进行隐马尔可夫模型和Blast搜索,以确定亚洲玉米螟的候选ABC基因。在获得了初步的鉴定结果后,需要对结果进行筛选,阈值为E-value<0.001,之后为了确认鉴定序列的真实性,将这些序列上传至SMART(http://smart.embl-heidelberg.de/)与PFAM(https://pfam.xfam.org/)[55-56]数据库进行对比分析。这样获得了62个ABC基因,其鉴定的ABC基因如表1。

表1 亚洲玉米螟ABC家族基因筛选。Table 1 ABC gene family in Ostrinia furnacalis
为检验系统发育关系并对亚洲玉米螟ABC基因家族进行分类,基于保守的ABC结构域构建了亚洲玉米螟ABC家族基因的系统发育树(图5),同时添加了果蝇的部分ABC基因家族作为分组依据,根据基因树的分枝将所有ABC基因分为8个亚族,其中有10个来自A亚族,10个来自B亚族,12个来自C亚族,3个来自D亚族,2个来自E亚族,4个来自F亚族,14个来自G亚族,3个来自H亚族,同时G亚族的成员最多,E亚族成员最少,此分析结果与果蝇的ABC基因家族亚族数目关系基本一致。
4 展望
种群的潜在抗性发展是阻碍转Bt基因作物长期使用的重要因素,不同虫体内对相同毒蛋白的抗性机制亦不同。人们对田间长期使用Bt导致害虫产生抗性的分子机理的认识仍远远不足,甚至在关键的作用模式和受体结合方式的结论上争议不断[11]。一旦抗性种群在田间爆发,对抗性机制作用靶标的不明确将使人们无法作出对害虫的长期有效防控策略,对玉米产量造成重大影响,对国家粮食储备造成巨额损失。亚洲玉米螟基因组的测序成功为研究田间昆虫对Bt抗性产生的因素提供了强有力的证据,本研究基于亚洲玉米螟基因组的测序数据,共鉴定出62个亚洲玉米螟ABC基因家族成员,其中10个ABCA家族成员,10个ABCB家族成员,12个ABCC家族成员,3个ABCD家族成员,2个ABCE家族成员,4个ABCF家族成员,14个ABCG家族成员,3个ABCH家族成员,本次对亚洲玉米螟ABC基因家族成员的鉴定以及分组,不但有利于研究亚洲玉米螟Bt抗性产生的来源,更为其他物种对Bt抗性的研究提供了方向。
转基因玉米自1996年起在美国开始广泛种植,高效防治了欧洲玉米螟(Ostrinia nubilalis)的危害,但也不可避免地出现了抗性[47]。2020年1月21日,农业农村部发布2019年农业转基因生物安全证书批准清单,其中包括转Cry1Ab/Cry2Aj、G10evo(EPSPS)基因抗虫耐草甘膦玉米(瑞丰125)和转BtCry1Ab/epsps抗虫玉米(DBN9936)。尽管中国尚未开放对转Bt基因粮食作物的种植政策,然而该品种的批准为商业生产转基因玉米发出信号并提供商业化的先决条件。在田间针对亚洲玉米螟的抗性演化试验也证明了长期施用的抗性风险[57]。鉴于此,本研究针对ABC转运蛋白的序列分析和综述将为ABC转运蛋白调控害虫对Cry毒蛋白抗性机制的研究提供重要依据,为探索害虫在田间的抗性演化机理和治理决策解决机理问题。关于抗性机制的研究和探索是农业种植和科技发展中为推动转基因作物的长效发展和Bt生物农药的合理利用迫切需要解决的科学问题,并对害虫综合治理决策提供重要理论和实践指导。
