泰山海棠抗旱基因MhDREB2A的克隆与功能鉴定
2022-10-19党明青王京平冉昆刘加芬李慧峰
党明青,王京平,冉昆,刘加芬,李慧峰
(1.南京农业大学植物保护学院,南京 210095;2.栖霞市寺口镇综合服务站,山东 烟台 265300;3.山东省果树研究所,山东 泰安 271000)
转录因子作为一类关键的调控因子,通过结合下游基因的启动子区域,调控相关基因的表达。越来越多研究表明,转录因子在植物应答逆境胁迫的信号途径中起着重要的作用[1]。DREB转录因子(dehydration responsive element binding protein)是AP2/EREBP(APETALA 2/an ethylene responsive element binding protein)转录因子家族的一个亚家族,此类转录因子含有保守的AP2结构域,能够特异性地结合到抗逆基因启动子区域的DRE顺式作用元件上[2-3]。在拟南芥中,DREB转录因子可分为DREB1/CBF和DREB2两类,目前对DREB1/CBF类成员的功能研究比较透彻,主要与低温胁迫应答反应有光;而DREB2类成员则主要参与干旱、高盐、高温等胁迫应答反应[4-6]。在逆境胁迫条件下,DREB2转录因子被迅速诱导表达,然后与下游抗逆性相关的功能基因的启动子的DRE元件特异结合,调控下游基因的表达,提高植物对非生物胁迫的抗性[1-2,6]。例如,过量表达At-DREB2A能够提高拟南芥的抗旱性[7];OsDREB2A和OsDREB2B的转基因水稻和大豆增强了植株对干旱和盐胁迫的耐受性[8-9];在小麦和大麦中过表达TaDREB2基因能够提高植株在干旱条件下的存活率[10]。在苹果中,Mp-DREB2A和MdDREB2A都能够受到多种逆境胁迫诱导,转基因拟南芥表型分析发现,转基因材料的抗旱能力也不同程度提高[11-12]。
泰山海棠(Malus hupehensis)是我国特有的苹果属种质资源,具有抗旱等优良性状。研究组前期以泰山海棠为材料,分析了干旱和非干旱条件下泰山海棠的转录组数据,发现干旱条件下MhDREB2A基因明显受到诱导表达。采用RACE方法成功克隆了完整的MhDREB2A基因,并通过遗传转化获得MhDREB2A转基因烟草植株,并对干旱胁迫处理下植株的表型和生理指标变化进行鉴定,为选育苹果属植物抗旱资源提供基础依据。
1 材料与方法
1.1 材料
供试泰山海棠(Malus hupehensis)保存在山东省果树研究所。供试ABA(分析纯)购于博奥拓达公司。
1.2 方法
2018年盆栽定植,对8a生盆栽苗外源喷施脱落酸(100μMol·L-1ABA),处理后0,1,2,6,12,24h分别采集样品;干旱胁迫以盆栽土壤相对含水量为70%时为干旱处理起始点,处理后0,1,2,3,4,5d取样。每个处理大于5株盆栽苗,所有处理均在玻璃温室中进行,培养条件为16h(光照)/8h(黑暗)和(25±1)℃。所有的样品采集后,放入液氮中迅速冷冻后置于-80℃冰箱保存。
1.2.1MhDREB2A的克隆及序列分析取泰山海棠幼苗0.1g,利用Trizol的方法提取总RNA,参照大连宝生物(TaKaRa)的PrimeScript™RT reagent Kit with gDNA Eraser(RR047A)的说明书,将RNA反转录成cDNA。根据之前转录组测序结果中的序列信息,利用Primer 5软件设计特异性引物,扩增MhDREB2A全长CDS(表1)。利用宝生物的高保真酶PrimeSTAR®Max DNA Polymerase(R045Q),以反转录的cDNA产物为模板进行PCR扩增。反应程序:98℃变性10s,55℃退火10s,72℃延伸15s,30个循环。扩增后,PCR产物用1%的琼脂糖凝胶进行电泳,根据预测的目的条带的大小,切下相应的条带,连接到pEasy(北京全式金)克隆载体进行测序。
从NCBI(http://www.ncbi.nlm.nih.gov/)数据库中下载所有拟南芥的AP2蛋白序列,使用MEGA 6.0软件构建系统进化树;从NCBI数据库中下载AtDREB1A(ABD42992.1)、AtDREB2A(AED90871.1)、MdDREB2A(XP_008354169.1)、MpDREB2A(MG488272)、FvDREB2A(XP_004307690.1)、PbDREB2A(XP_009345422.1)、Pp-DREB2A(XP_020413813.1)和VvDREB2A(XP_002273838.1),使用DNAMAN进行多序列比对。
1.2.2 基因表达分析在8a生的泰山海棠树上分别取根、茎、叶、花(盛花期)和果实(花后60d),将样品放入液氮中速冻,然后提取RNA,反转录合成第1链cDNA后,使用实时荧光定量PCR进行组织表达分析。内参基因选用MdActin[13]。烟草转基因和野生型植株提取RNA和反转录方法同上,内参基因选用NtActin[14]。
荧光定量分析参照ChamQTM Universal SYBR® qPCR Master Mix(Q711,Vazyme,南京)的说明书,反应体积为20μL:SYBR qPCR Master Mix 10μL,上、下游引物各1μL,cDNA 1μL,ddH2O 7μL。反应条件为:95℃30s,95℃10s,60℃20s,40次循环。并采用2-ΔΔCT计算基因的相对表达量[15]。试验设至少3个生物学重复。引物序列见表1。
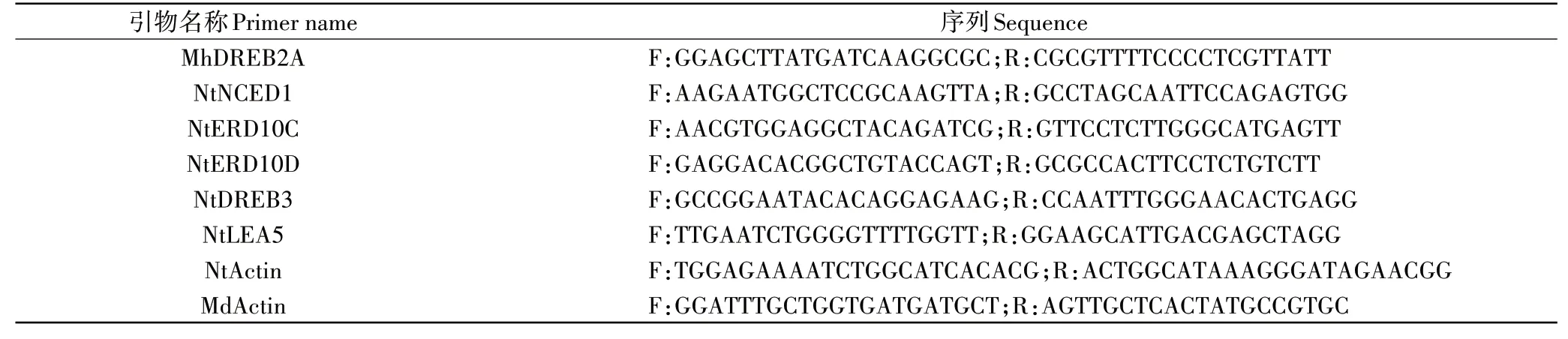
表1 供试引物Table 1 Primers used in this study
1.2.3 亚细胞定位将MhDREB2A的CDS序列(去掉终止密码子)构建到pRI101-eGFP载体上,然后将重组质粒转化至农杆菌EHA105,挑选阳性克隆摇菌。将农杆菌溶液注射到本氏烟的叶片中,放置2~3d后,使用激光共聚焦显微镜观察荧光定位情况。
1.2.4 MhDREB2A过量表达载体的构建和烟草的转化将MhDREB2A的CDS序列构建到植物过量表达载体pRI101上,得到35S::MhDREB2A过量表达载体。将重组质粒通过冷冻法转入农杆菌EHA105感受态细胞。采用叶盘法[16],将带有重组质粒的农杆菌转入烟草叶片中,经过共生培养和筛选培养后将抗性芽转入1/2培养基中继代、生根,获得T0代转基因植株,移栽后,单株收种,选取T3代植株进行后续试验。
2 结果与分析
2.1 MhDREB进化树及序列比对分析
从NCBI网站(http://www.ncbi.nlm.nih.gov/)的数据库中下载拟南芥全部AP2蛋白序列,利用MEGA 6.0软件,进行系统进化树分析,结果表明本研究中克隆得到的泰山海棠DREB属于DREB2亚家族,与DREB2A亲缘关系最近,因此将此基因命名为MhDREB2A(图1A)。
将不同物种中的DREB2蛋白序列从NCBI中下载下来,包含拟南芥(AtDREB2A,AED90871.1),苹果(Md-DREB2A,XP_008354169.1)、海棠(MpDREB2A,MG488272),草莓(FvDREB2A,XP_004307690.1)、白梨(Pb-DREB2A,XP_009345422.1)、桃(PpDREB2A,XP_020413813.1)和葡萄(VvDREB2A,XP_002273838.1)。利用DNAman软件进行氨基酸序列比对,结果表明泰山海棠MhDREB2A和其他物种的DREB2A蛋白在N端有保守性的AP2结构域(图1B)。
2.2 MhDREB2A基因的表达分析
由图2a和2b可知,干旱和100μMol·L-1ABA处理均可不同程度地诱导MhDREB2A基因的表达。Mh-DREB2A基因的表达量在干旱处理后3 d达到最高值(12.3倍),然后下降;100μMol·L-1ABA处理后,MhDREB2A基因的表达量在2h时达到最高值(15.8倍),6h降至最低;表明MhDREB2A可能在苹果应对干旱胁迫中起着重要作用。
进一步通过qRT-PCR检测MhDREB2A在泰山海棠根、茎、叶、花(盛花期)和果实(花后60d)的相对表达水平。由图2c可知,MhDREB2A在泰山海棠不同组织中均有表达,其中在花中的表达量最高,在叶中表达最低。
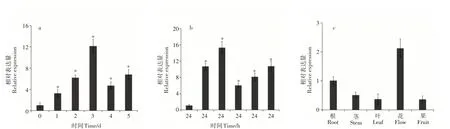
图2 MhDREB2A的在泰山海棠中的表达水平分析Figure 2 Analysis in expression level of MhDREB2A in Malus hupehensis
2.3 MhDREB2A的亚细胞定位分析
将含有MhDREB2A基因的农杆菌注射到本氏烟叶片中,利用激光共聚焦显微镜观察烟草叶肉细胞中的荧光信号分布,发现绿色荧光(GFP)标记的MhDREB2A蛋白集中分布于细胞核上(图3)。
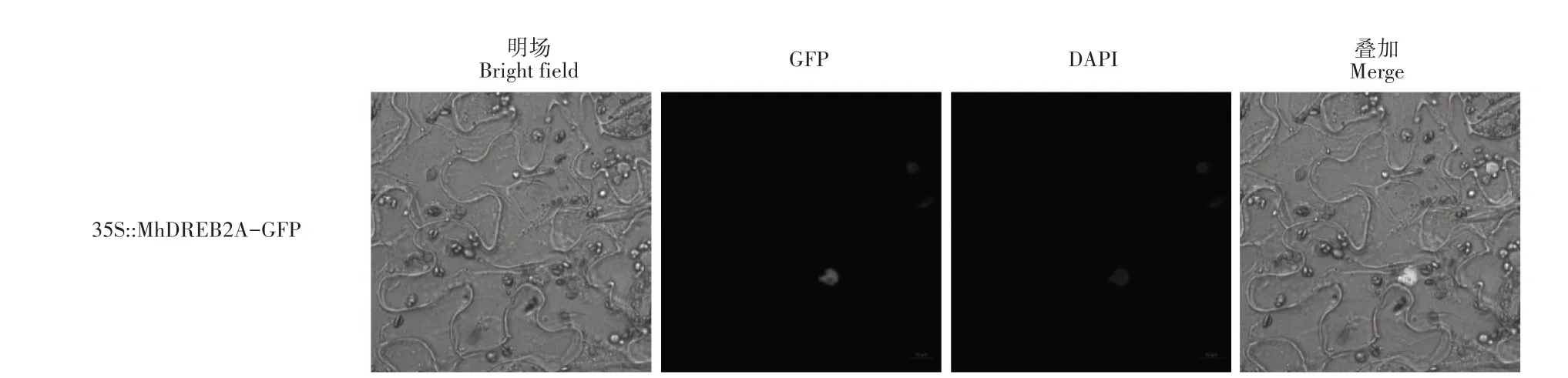
图3 MhDREB2A的亚细胞定位分析Figure 3 Subcellular localization of MhDREB2A
2.4 MhDREB2A转基因烟草抗旱性分析
为了快速验证MhDREB2A基因在植物抗旱中的作用,在烟草中过量表达MhDREB2A基因,qRT-PCR结果表明在3个转基因株系(L1、L2和L3)中MhDREB2A基因表达量均明显高于对照(图4a)。对生长了35d的烟草植株进行干旱处理,观察其表型变化,结果表明,野生型烟草早于转基因株系出现叶片萎蔫和变黄的现象(图4b)。在对照组中,转基因株系和野生型植株中叶绿素总含量、电导率(EL)和丙二醛(MDA)均没有显著差别;而在干旱条件下,转基因株系中的叶绿素总含量明显高于野生型植株,电导率(EL)和丙二醛(MDA)则明显低于野生型植株(图4c~图4f)。
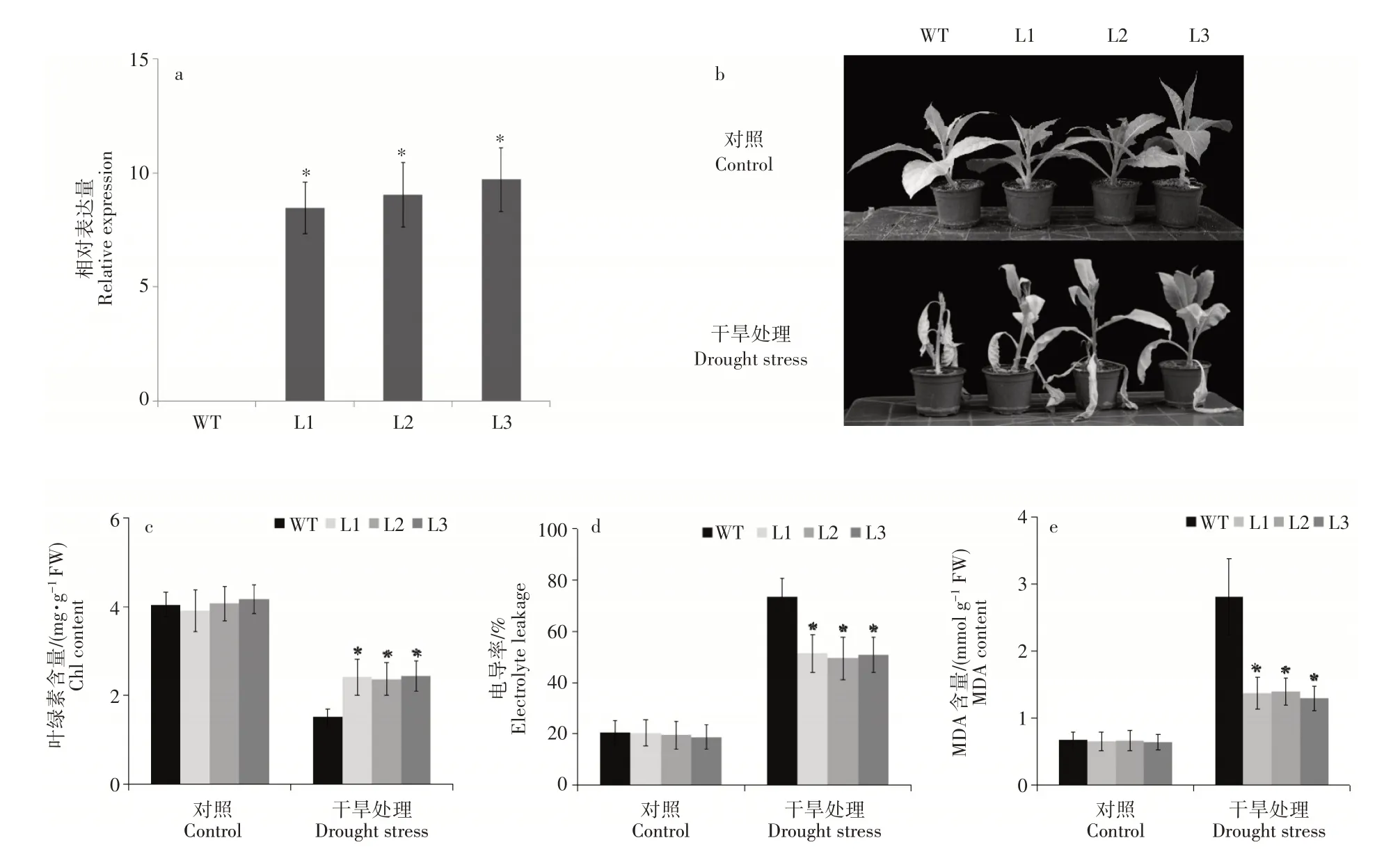
图4 MhDREB2A转基因烟草干旱处理表型及叶绿素含量、电导率和丙二醛含量分析Figure 4 Phenotype of the transgenic tobaco with MhDREB2A and analysis on Chl,electrolyte leakages and MDA contents
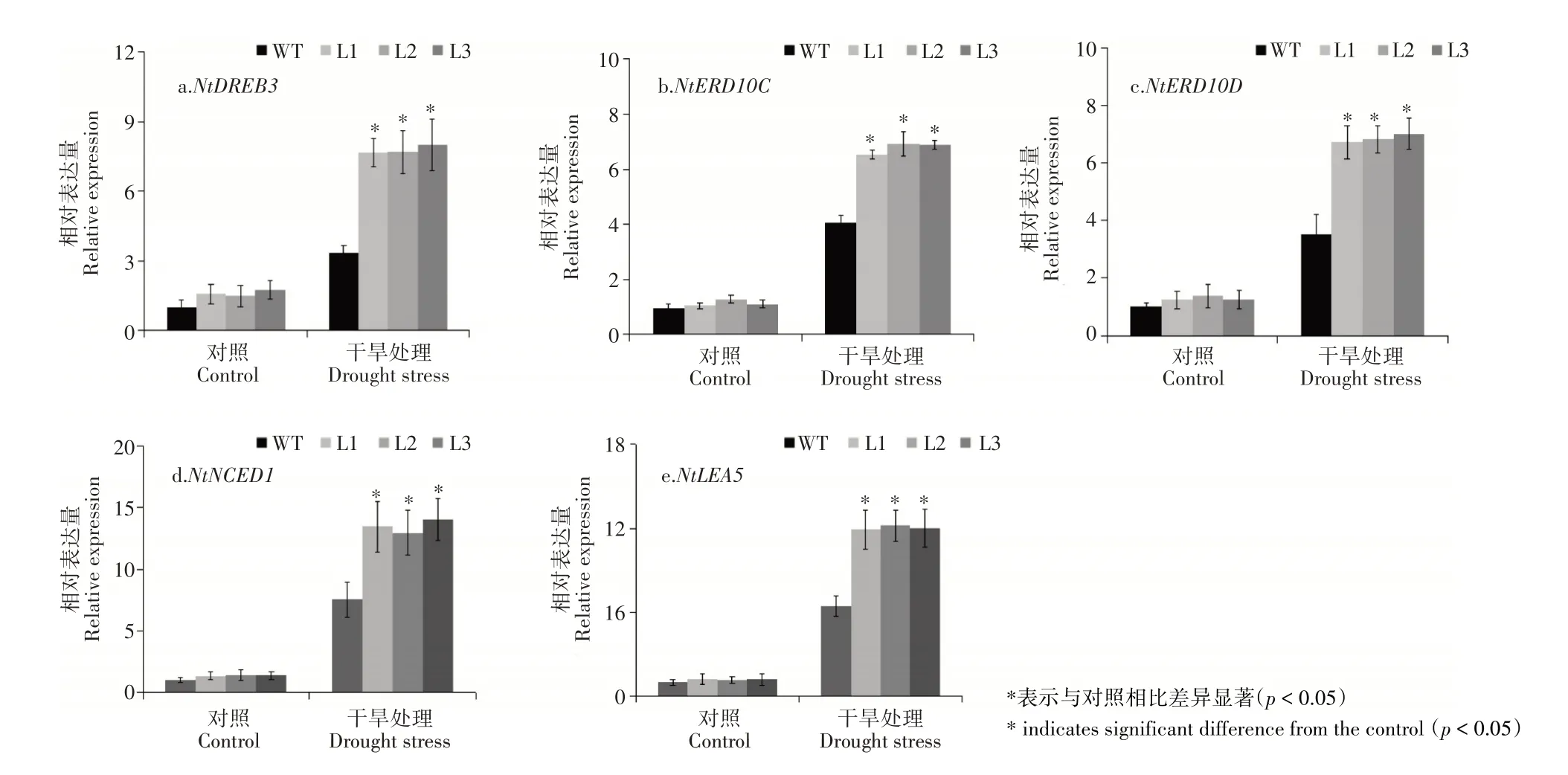
图5 转基因烟草逆境相关基因的表达分析Figure 5 Expression analysis of resistance-related genes in transgenic tobacco
为了进一步揭示MhDREB2A基因提高植物抗旱性的机制,检测了胁迫相关基因的表达。由图5可知,正常条件下逆境相关基因NtDREB3、NtERD10C、NtERD10D、NtNCED1和NtLEA5在转基因烟草和野生型中表达量没有差异;在干旱处理下,NtDREB3、NtERD10C、NtERD10D、NtNCED1和NtLEA5的表达均有所增强,且转基因植株的表达水平均显著高于野生型植株。综上可知,过量表达MhDREB2A能够显著提高植物的抗旱性。
3 讨论与结论
AP2/ERF家族是植物特有的一类转录因子,包含一个或者多个AP2结构域,该家族广泛参与调控植物干旱、高盐或低温、高温等非生物胁迫应答过程[6]。本试验中对泰山海棠MhDREB2A在干旱胁迫方面的作用进行了研究。通过对泰山海棠DREB和拟南芥AP2/ERF蛋白进行系统发育树分析,发现该泰山海棠DREB蛋白属于DREB2亚家族,与AtDREB2A亲缘关系最近,因此将此基因命名为MhDREB2A。随后进一步对MhDREB2A序列进行比对,发现MhDREB2A蛋白包含1个非常保守的AP2结构域,起始于第79个氨基酸,结束于第130个氨基酸,属于AP2类家族成员。
在无任何处理条件下,拟南芥DREB2A基因在根、茎、叶都有表达[17],在本研究中,采用RT-PCR检测Mh-DREB2A在根、茎、叶、花、果的表达情况,结果表明苹果MhDREB2A基因主要在花和根中表达,这种表达的差异可能与草本和木本植物中DREB2A基因参与了不同组织抗性有关。不同物种的大多数DREB2基因都能够响应干旱、高盐和高温等胁迫,少数DREB2对低温和ABA有响应,并且不同物种以及在不同组织部位对非生物胁迫的响应是不一样。例如,OsDREB2A基因的表达均受干旱和高盐胁迫的诱导;AtDREB2正常生长条件下表达较弱,但受干旱、极端温度或高盐的诱导[6]。本研究干旱胁迫处理时,MhDREB2A的表达量在处理后3d时达到峰值,同时其表达量还受ABA的诱导,暗示了MhDREB2A基因在苹果响应干旱胁迫起着重要作用。一般而言,转录因子大多数定位于细胞核中,在本研究中亚细胞定位结果显示MhDREB2A定位于细胞核中,但Mh-DREB2A发挥功能的机制目前还不清楚,可能与其他蛋白或者直接调控下游基因响应干旱胁迫,有待进一步试验验证。
多数报道显示,DREB2转录因子对生物和非生物胁迫具有正向调控作用。由于泰山海棠遗传转化体系尚不成熟,所以本研究中将MhDREB2A转入烟草中进行过量表达以探索其功能。当干旱胁迫条件下野生型植株叶片萎蔫变黄时,转基因株系仍处于相对较好的生长状态。电导率和丙二醛是研究植物抗性的关键指标,反应植物细胞膜脂过氧化程度及膜受损程度,植株丙二醛含量较低,表明膜脂受损较轻,具有较强的抗性[18-19]。本试验中,转基因烟草在干旱胁迫下的电导率和丙二醛含量均低于野生型(对照),表明其细胞膜的受损程度较低,其抗旱性相应提高。另外,NtDREB3、NtERD10C、NtERD10D、NtNCED1和NtLEA5均是逆境胁迫相关基因,与植物细胞的耐逆性相关。本研究发现,干旱处理条件下这些抗逆相关基因在转基因株系中的表达量高于野生型,暗示MhDREB2A可能正调控这些基因的表达来响应干旱胁迫,但对于MhDREB2A能否直接调控这些表达,还有待通过遗传学及分子生物学试验进一步验证。
ABA最重要的功能是作为信号分子激发一系列调节机制,提高植物在干旱、高温、低温、高盐、重金属等胁迫下的耐受力,因此又被称为应激激素或胁迫激素。低浓度ABA能够增强水稻、马铃薯、番茄等作物对低温、干旱、高盐等逆境的耐受力。逆境胁迫下,植物体内会大量积累ABA,进而增强植物体对逆境胁迫的抵抗能力。苹果矮化基因MbDREB1可以通过依赖ABA和不依赖ABA的途径以增强对低温、干旱和盐胁迫的耐受性[20]。
综上所述,MhDREB2A基因过量表达提高了转基因植株对干旱胁迫的抗性,为干旱胁迫响应过程中的正调控因子,可以作为苹果抗旱育种的候选基因。
