驱动蛋白家族成员15在非特殊型浸润性乳腺癌中的表达及意义
2022-10-19王枝红刘红何楠邓柳娅
王枝红,刘红,何楠,邓柳娅
(贵州医科大学附属肿瘤医院 乳腺外科,贵州 贵阳 550003)
乳腺癌是女性常见的恶性肿瘤之一,已经成为45岁以下女性恶性肿瘤死亡原因的首位。2018年全球新确诊乳腺癌病例大约209万,死亡人数大约63万[1]。非特殊型浸润性乳腺癌(invasive carcinoma of no special type,IC- NST)是最常见的浸润性乳腺癌类型,占40%~75%[2]。乳腺癌的生物学机制尚未完全明确,寻找新型分子生物学标志物对其早期诊治有重要意义。驱动蛋白超家族(kinesin superfamily,KIF)属于分子马达的一种,在细胞内运输、细胞形成、细胞分裂和细胞功能等方面起到重要作用[3]。KIF包含45个成员,KIF15可促进双极纺锤体形成、质膜运输和细胞分裂[4]。既往研究显示,KIF15高表达与多种癌症的发生和发展有关,包括前列腺癌[5]、胃癌[6]和膀胱癌[7]等。KIF15在乳腺癌中的表达及临床意义既往少有报道。为了排除特殊性浸润性乳腺癌的一些特殊生物学行为、预后因素带来的影响,本研究以IC- NST为研究对象。本研究采用免疫组织化学染色法检测IC- NST组织中KIF15的表达,观察KIF15与临床病理特征及预后的关系,另外采用RNA干扰技术沉默乳腺癌MDA- MB- 231和MCF- 7细胞中KIF15的表达,观察细胞增殖、侵袭、凋亡及Notch1信号通路的变化,旨在探究KIF15在IC- NST中的意义。
1 材料与方法
1.1 材料
正常乳腺细胞(MCF- 10A)和乳腺癌细胞(MDA- MB- 231和MCF- 7细胞)均购于中国科学院上海生命科学研究院细胞资源中心;DMEM培养基和胎牛血清购于海沪震实业有限公司;质粒由上海吉凯基因科技有限公司设计并提供;LipofectamineTM2000转染试剂盒、反转录试剂盒、2×SYBR Green PCR Mastermix试剂盒购于美国 Invitrogen公司;CCK- 8试剂盒、Annexin- V- FITC/PI凋亡检测试剂盒和Transwell小室均购于美国Sigma公司;KIF15、hes1、hes5、NICD和GAPDH抗体均购于美国 Invitrogen公司。
1.2 组织样本
选取2014年6月至2019年12月本院收治的IC- NST患者126例,年龄36~67岁,平均(52.09±5.29)岁。所有患者术前均未接受过放化疗,并且未合并其他部位肿瘤。术中留取癌组织及其配对的癌旁组织(与癌组织病灶距离≥5 cm)。选取同期80例导管内癌组织为对照,患者年龄28~59岁,平均(47.82±8.12)岁。术后对IC- NST患者进行电话和门诊随访,随访至2021年1月,记录无进展生存时间(手术至乳腺癌进展或者因任何原因致患者死亡的时间)。
1.3 免疫组化检测组织中KIF15的表达
石蜡切片(厚度为4 μm)由本院病理科制备,在70 ℃下烤片30 min,随后进行脱蜡处理。用Tris/EDTA修复液进行抗原修复,羊血清封闭30 min,加入鼠抗人KIF15单克隆抗体(1∶500)4 ℃过夜,加入辣根过氧化物酶标记的山羊抗小鼠IgG,37 ℃孵育30 min。随后用辣根标记的链霉素卵白素工作液和DAB显色液处理,苏木紫复染。经过脱水、透明、封片处理后在显微镜下观察。细胞核染色为棕黄色视为KIF15阳性。阳性染色细胞≤10%为阴性表达,>10%为阳性表达。
1.4 细胞培养及转染
将MCF- 10A、MDA- MB- 231和MCF- 7细胞接种于含10%胎牛血清的DMEM培养基中,置于37 ℃、5% CO2恒温箱中进行培养。待细胞融合度达80%时进行传代,取5~15代对数生长期细胞进行后续实验。将MDA- MB- 231和MCF- 7细胞分别分为NC- siRNA组和KIF15- siRNA组,分别用Lipofectamine®2000转染NC- siRNA和KIF15- siRNA。NC- siRNA序列:5′- GGACUCGAAGUUAGACCGAGA- 3′;KIF15- siRNA序列:5′- GGAUGAGAGACAAAGGAAGUU- 3′。转染步骤严格按照试剂盒说明书进行。
1.5 沉默KIF15对细胞增殖、侵袭、凋亡及Notch1信号通路的影响
1.5.1 KIF15基因表达水平检测 采用TRIzol法提取细胞中的总RNA,通过反转录获取cDNA,随后用实时荧光定量试剂盒进行PCR扩增。反应条件:95 ℃ 30 min;94 ℃ 15 s、55 ℃ 30 s、70 ℃ 30 s,共40个循环。操作步骤严格按照试剂盒说明书进行,用2-ΔΔCt法计算KIF15 mRNA相对表达量。
1.5.2 CCK- 8法检测细胞增殖活力 转染48 h后取对数生长期细胞,接种于96孔板。待细胞贴壁后,分别于培养24、48、72 h加入10 μl CCK- 8溶液,孵育2 h后用酶标仪检测光密度(optical density,OD)值,检测细胞增殖能力。设置5个复孔。
1.5.3 Transwell实验检测细胞侵袭能力 在Transwell小室的上室铺基质胶,随后将细胞接种于24孔板,以2×105个·ml-1密度将细胞加入上室,每孔加量100 μl;下室中加入培养基,每孔加量250 μl。待细胞贴壁后更换上室培养液,继续培养24 h。用无菌棉签拭去小室滤膜上的细胞,甲醛固定15 min,HE染色,光镜下统计膜背面侵袭的细胞数。设置5个复孔。
1.5.4 Annexin- V- FITC/PI流式细胞术检测细胞凋亡 取转染后细胞,用500 μl预冷1×结合缓冲液将其制成1×106个·ml-1的悬液。加入5 μl异硫氰基荧光素,混匀后孵育10 min。随后加入2.5 μl碘化丙啶,孵育5 min。用流式细胞仪检测细胞凋亡率。设置5个复孔。
1.5.5 蛋白质印迹法检测蛋白表达水平 RAPI裂解液提取总蛋白,10% SDS- PAGE分离蛋白,用半干转移法将蛋白转至PVDF膜。5%脱脂奶粉封闭2 h,加入KIF15(1∶500)、hes1(1∶1 000)、hes5(1∶1 000)、NICD(1∶500)和GAPDH(1∶1 000)一抗,4 ℃过夜孵育,次日用TBST缓冲液洗涤3次后加入二抗,封闭1 h。最后用ECL法显色,凝胶成像系统拍照,用Image J软件分析灰度值。
1.6 统计学处理
采用SPSS 22.0软件进行统计学分析,计量资料用均数±标准差表示,组间比较采用单因素方差分析或t检验。用COX多因素模型分析影响患者无进展生存时间的因素。P<0.05为差异有统计学意义。
2 结 果
2.1 KIF15在组织及细胞中的表达
IC- NST癌组织中KIF15阳性表达率为70.63%(89/126),高于导管内癌组织[38.75%(31/80),P<0.05]和癌旁组织[23.01%(29/126),P<0.05]。乳腺癌MDA- MB- 231和MCF- 7细胞的KIF15蛋白表达水平分别为1.89±0.34、1.33±0.21,均高于正常乳腺细胞MCF- 10A(0.29±0.10,P<0.05)。见图1。
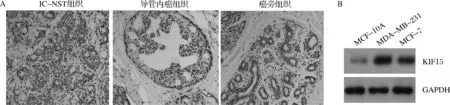
A.免疫组化检测组织中KIF15表达 ×200;B.蛋白质印迹法检测细胞中KIF15蛋白表达图1 KIF15在组织及细胞中的表达
2.2 KIF15表达与IC- NST临床病理特征的关系
KIF15表达与组织学分级、TNM分期、淋巴结转移有关(P<0.05),与年龄、绝经状态、手术方式、肿瘤直径、脉管侵犯、分子分型无关(P>0.05)。见表1。
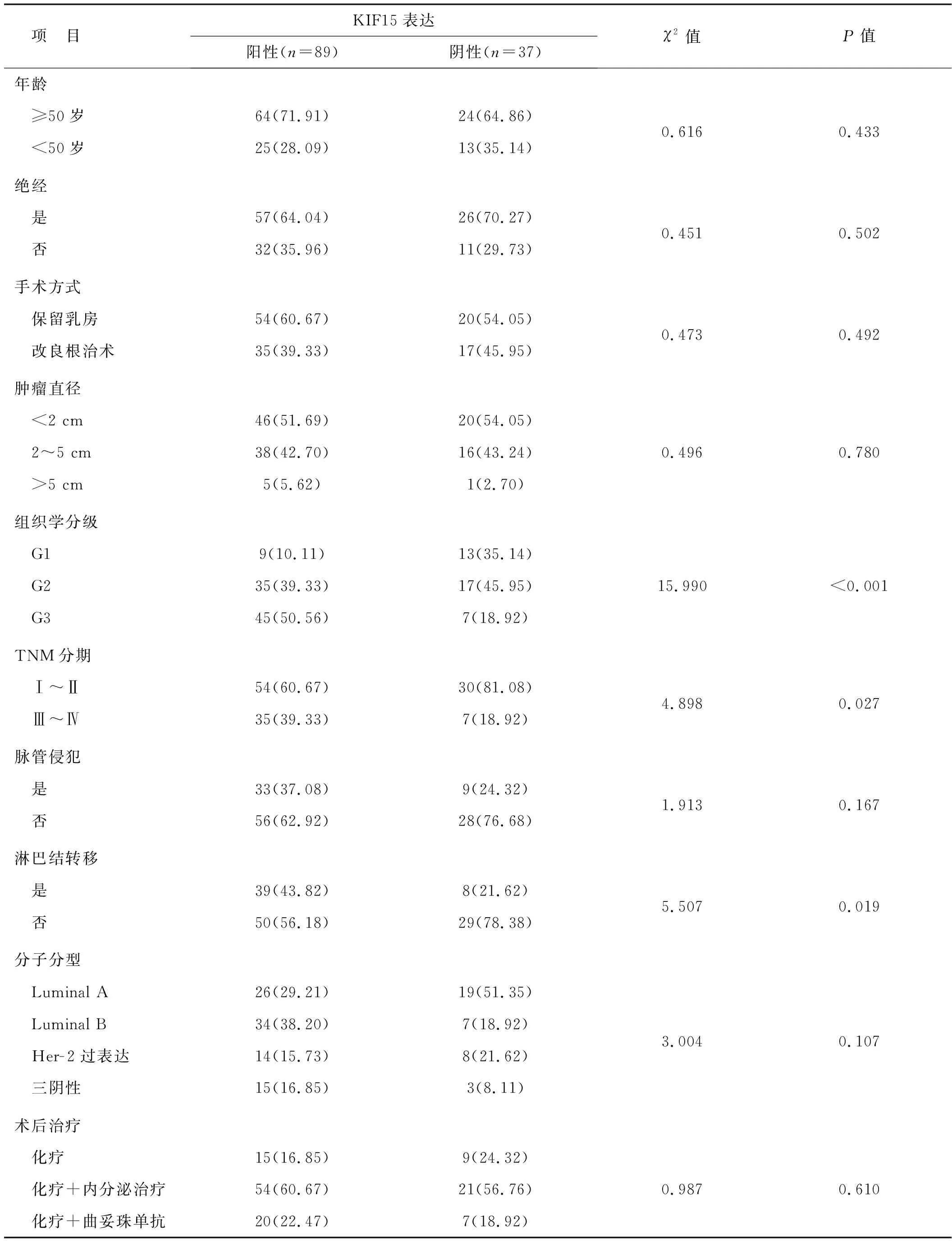
表1 KIF15表达与IC- NST临床病理特征的关系 例
2.3 IC- NST患者无进展生存时间的单因素和COX多因素分析
单因素和COX多因素分析结果显示,TNM分期、淋巴结转移、KIF15表达是IC- NST患者无进展生存时间的影响因素(P<0.05),见表2、3。
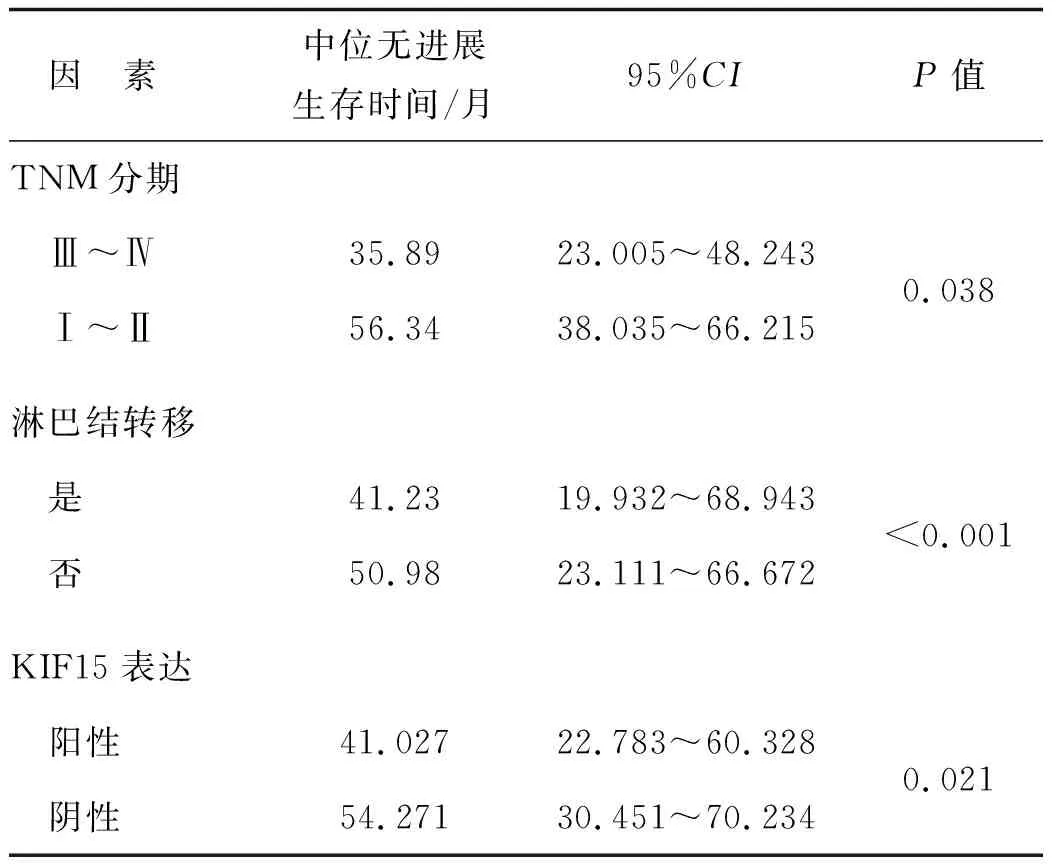
表2 IC- NST患者无进展生存的单因素分析
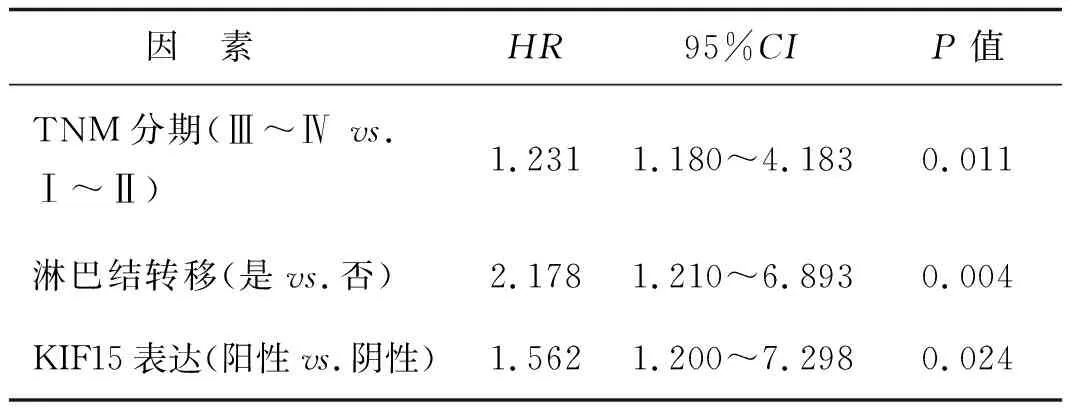
表3 IC- NST患者无进展生存的COX多因素分析
2.4 沉默KIF15对癌细胞增殖、侵袭和凋亡的影响
沉默KIF15基因后MDA- MB- 231、MCF- 7细胞的KIF15 mRNA和蛋白表达水平均下降(P<0.05),见表4。沉默KIF15基因后MDA- MB- 231、MCF- 7细胞的增殖和侵袭力均受到抑制,而凋亡水平升高(P<0.05),见表5、6和图2。
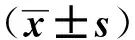
表4 沉默KIF15对MDA- MB- 231和MCF- 7细胞KIF15基因和蛋白表达的影响
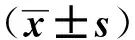
表5 沉默KIF15对MDA- MB- 231细胞增殖、侵袭和凋亡的影响
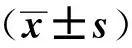
表6 沉默KIF15对MCF- 7细胞增殖、侵袭和凋亡的影响
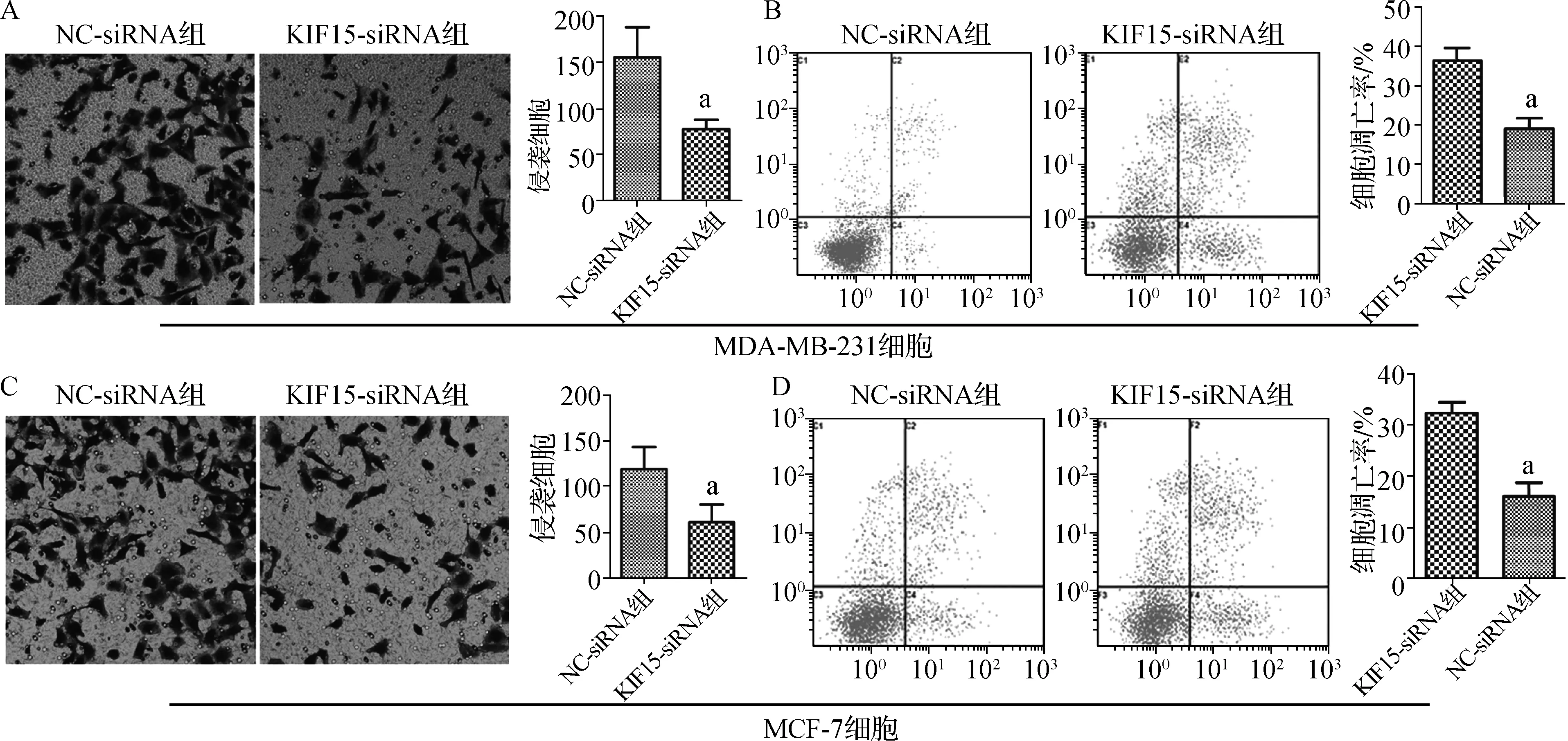
与NC- siRNA组比较,a P<0.05A.沉默KIF15对MDA- MB- 231细胞侵袭的影响;B.沉默KIF15对MDA- MB- 231细胞凋亡的影响;C.沉默KIF15对MCF- 7细胞侵袭的影响;D.沉默KIF15对MCF- 7细胞凋亡的影响图2 沉默KIF15对癌细胞侵袭和凋亡的影响
2.5 沉默KIF15对癌细胞Notch1信号通路的影响
沉默KIF15基因后MDA- MB- 231、MCF- 7细胞的hes1、hes5、NICD蛋白表达水平均下降(P<0.05),见表7、图3。
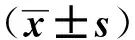
表7 沉默KIF15对癌细胞Notch1信号通路蛋白表达的影响
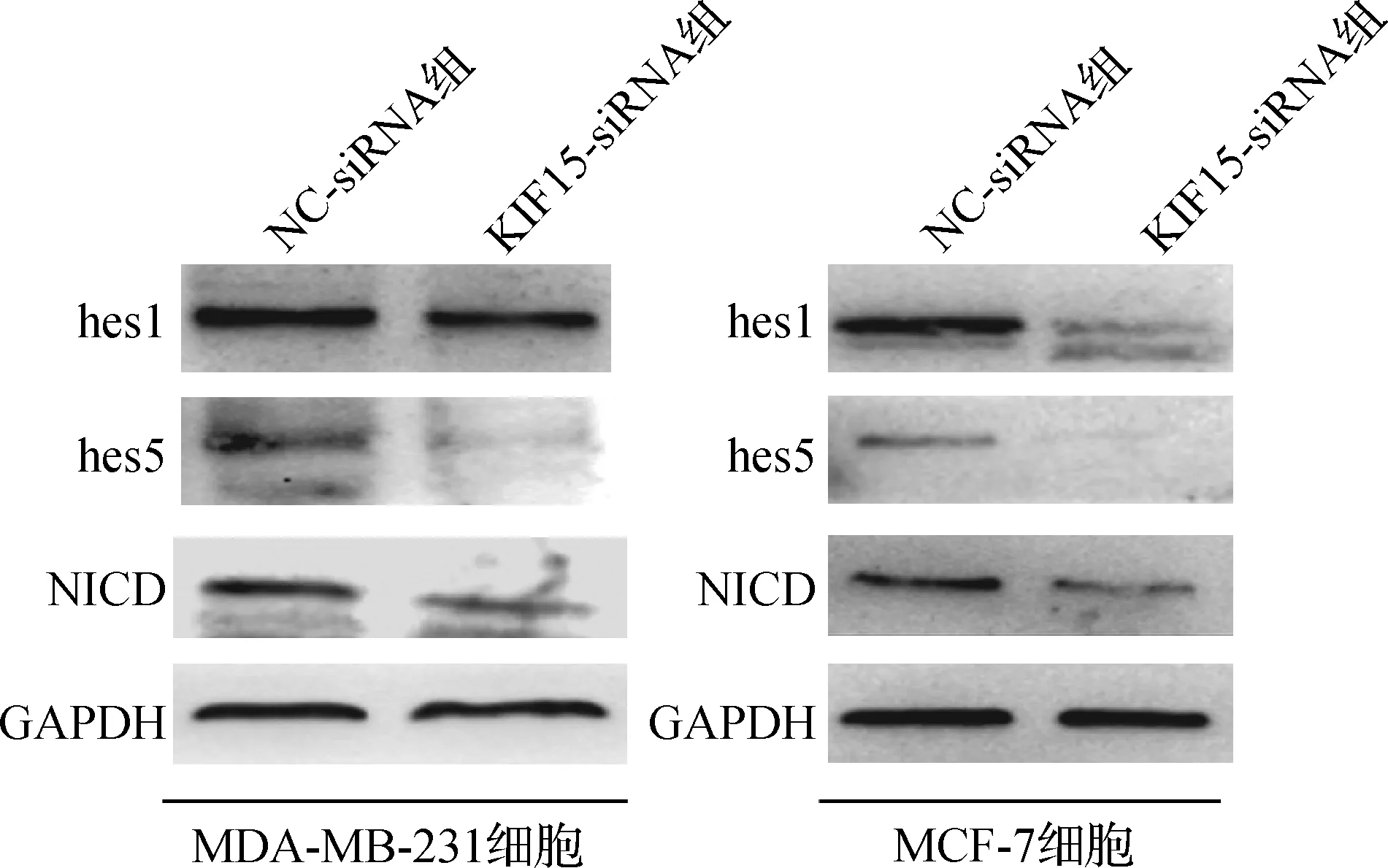
图3 蛋白质印迹法检测Notch1信号通路蛋白表达
3 讨 论
KIF在细胞内负责沿着微管向其正极运送不同分子货物,例如细胞器、蛋白质和RNA等[8]。KIF15是KIF家族成员之一,是除KIF5之外的第2个四聚体纺锤体马达[9]。KIF15与多种癌症密切相关,例如KIF15可通过丝裂原活化蛋白激酶- 细胞外调节蛋白激酶(MAPK- ERK)通路促进胰腺癌细胞增殖[10],通过调控细胞周期影响肺癌细胞死亡[6]。另外,KIF15还能通过影响氧化应激促进肝癌细胞的增殖和侵袭[11]。KIF15在乳腺癌中的表达及意义既往少有报道。Song等[12]发现,KIF15在乳腺癌组织中高表达,并且与患者不良预后有关。本研究结果显示,IC- NST癌组织中KIF15阳性表达率高于导管内癌组织和癌旁组织,另外乳腺癌MDA- MB- 231和MCF- 7细胞的KIF15蛋白表达水平均高于正常乳腺细胞MCF- 10A,KIF15表达与组织学分级、TNM分期、淋巴结转移有关,以上提示KIF15参与IC- NST的发生和发展。
KIF15高表达与多种癌症的预后有关,包括肝细胞癌[13]、胃癌[6]、前列腺癌[14]和骨肉瘤[15]。Sheng等[16]发现,KIF15高表达与三阴性乳腺癌患者不良生存预后有关。本研究也发现,KIF15阳性IC- NST患者的无进展生存时间为41.027个月,低于阴性患者的54.271个月。并且KIF15表达是IC- NST患者无进展生存时间的影响因素(HR=1.562,95%CI1.200~7.298)。细胞侵袭和凋亡是影响癌症进展的重要因素[17]。本研究发现,沉默KIF15基因后MDA- MB- 231和MCF- 7细胞的增殖、侵袭受到抑制,并且凋亡水平明显升高。Notch1信号通路与乳腺癌细胞的增殖、侵袭和凋亡密切相关[18- 19]。hes1、hes5、NICD是Notch1信号通路的关键蛋白[20]。沉默KIF15基因后MDA- MB- 231、MCF- 7细胞的hes1、hes5、NICD蛋白表达水平均下降,提示KIF15可能通过Notch1信号通路影响乳腺癌细胞的增殖、侵袭和凋亡,但是具体的调控机制需要未来深入分析。
综上,KIF15在IC- NST中高表达,与患者不良生存预后有关,沉默KIF15基因后乳腺癌细胞的增殖、侵袭均受到抑制,凋亡水平升高。本研究也存在一些局限性,例如未分析KIF15对IC- NST早期诊断的价值,未分析KIF15的具体作用机制;为了排除特殊性浸润性乳腺癌的一些特殊生物学行为、预后因素带来的影响,本研究仅以IC- NST为研究对象。未来需要进一步分析KIF15在乳腺癌中的作用机制及意义。
