CLU基因多态性与缺血性脑卒中后癫痫风险的关系分析
2022-10-19罗佳文潘家兴李建红
罗佳文,潘家兴,李建红
(1.万宁市人民医院 神经内科,海南 万宁 571500;2.海南医学院第二附属医院 神经内科,海南 海口 570216)
癫痫是由于大脑中(特别是丘脑- 皮质系统和上中脑)高度同步的神经元异常放电引起的一种神经系统疾病,是缺血性脑卒中的常见并发症之一[1],可增加脑卒中患者的死亡风险[2]。因此,研究卒中后癫痫的发病原因及易感因素具有重要意义。炎症和细胞凋亡是缺血性脑卒中和癫痫发展的共病基础[2-4]。聚集素蛋白(CLU)也被称为载脂蛋白J,是一种多功能伴侣蛋白,参与多种组织的发育、细胞死亡和脂质运输(CSF)等[5]。动物研究表明,CLU表达降低与癫痫神经元细胞凋亡和炎症机制有关[6]。从遗传学机制分析,单核苷酸多态性(SNPs)可能通过改变相关基因的表达来影响疾病的易感性[7]。CLU基因位于染色体8p21- p12上,包含9个外显子。据报道,CLUSNPs与神经系统疾病相关,如阿尔茨海默病(AD)、帕金森病、多发性硬化和假性剥脱[7-10]。目前7个SNPs(rs9331908、rs11136000、rs867231、rs867230、rs9331888、rs9314349和rs484377)已被识别,它们参与了≥90%CLU基因突变[11],然而CLUSNPs与脑卒中后癫痫之间的关系仍未确定。通过对国际人口数据库和中国人口数据库的检索发现,rs11136000、rs9314349和rs9331949位点的突变频率相对较高。因此,本研究旨在探讨CLUSNPs(rs11136000、rs9314349和rs9331949)与缺血性脑卒中后癫痫易感性的关系。
1 对象与方法
1.1 研究对象
本研究方案经万宁市人民医院伦理委员会批准(2017021),所有参与者都提交了书面知情同意书。这项研究是根据《赫尔辛基宣言》进行的。2017年1月至2021年8月,从万宁市人民医院神经内科的病房和门诊招募缺血性脑卒中患者,通过持续超过24 h的局部神经体征或血管源性症状来定义缺血性脑卒中,并通过基线脑部计算机断层扫描(CT)和(或)磁共振成像(MRI)以及48~72 h后使用对比剂的脑CT来确诊[12]。根据临床症状(肢体抽搐、颈部僵硬等癫痫发作症状)和阳性脑电图(EEG)检查诊断卒中后癫痫[13],最终共收集249例卒中后癫痫患者作为癫痫组,其中男137例,女112例,平均年龄(56.51±15.25)岁。另外选取250例没有继发癫痫的脑卒中患者作为对照组,其中男157例,女93例,平均年龄(57.32±11.24)岁。在脑卒中事件发生之前,所有病例都没经历过癫痫发作。纳入标准:(1) 入院时年龄在18岁以上;(2) 汉族;(3) 急性首发缺血性脑卒中;(4) 完整的医疗和护理资料。排除标准:(1) 短暂性脑缺血发作或原发性出血性脑卒中;(2) 既往有癫痫病史;(3) 抗癫痫药物治疗以预防癫痫发作或其他疾病(如精神病和偏头痛);(4) 潜在致痫性共病,包括颅内肿瘤、脑手术史或重症创伤性脑损伤、脑静脉血栓、大型脑动脉瘤、脑动脉畸形、脑积水和脑血管炎。
1.2 DNA提取和基因分型
使用血液基因组DNA提取试剂盒(北京天根生物科技)从外周血样本中分离基因组DNA,并在基因分型前储存于-80 ℃。使用SNaPshot基因分型技术(美国ABI公司)对CLU基因的3个SNPs(rs11136000、rs9314349 和 rs9331949)进行基因分型,确定最小等位基因频率(MAFs)分别为0.146、0.171和0.232。这些SNPs在多重聚合酶链反应(PCR)和SNaPshot分析中使用的引物序列见表1。另外,随机抽取5%的样品进行质量控制。
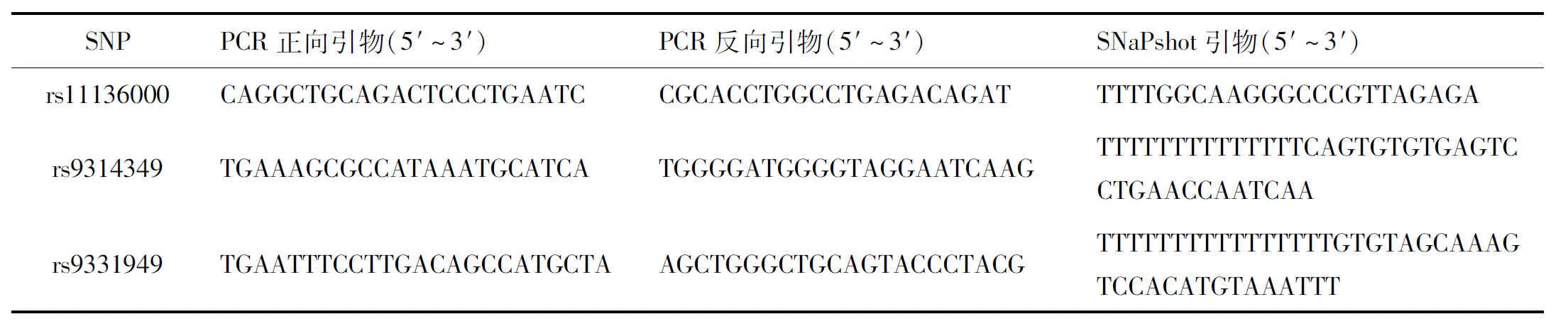
表1 用于SNPs的多重PCR和SNaPshot引物序列
1.3 血清CLU水平检测
使用脑卒中诊断时(症状发作24 h内)的血清样本。采集静脉血样后在室温下凝结30 min,然后在实验室离心(1 000 r·min-1,4 ℃,15 min)。采用人凝集素定量酶联免疫吸附试剂盒测定血清CLU浓度。每个样本重复测试3次,取平均值。
1.4 统计学处理
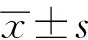
2 结 果
2.1 2组患者CLU SNP基因型和等位基因分布
癫痫组与对照组rs11136000位点基因型和等位基因分布频率差异有统计学意义(P<0.05),但是rs9314349位点和rs9331949位点基因型分布及等位基因频率差异均无统计学意义(P>0.05),见表2。与TT基因型相比,CC基因型和TC基因型与脑卒中后癫痫风险降低相关,而且这种影响在CC纯合子中更为明显(P<0.05)。这些结果与等位基因C的加性保护效应相一致。

表2 癫痫组和对照组患者CLU基因型和等位基因频率的分布 例
2.2 性别分层分析
根据性别分层,女性和男性CLUrs11136000位点TC/CC基因型频率降低与脑卒中后癫痫的关系显著(P<0.01,表3)。在男性患者中未观察到C等位基因与脑卒中后癫痫的关系(P>0.05,表4)。

表3 rs11136000位点SNPs与女性脑卒中后癫痫的关系 例
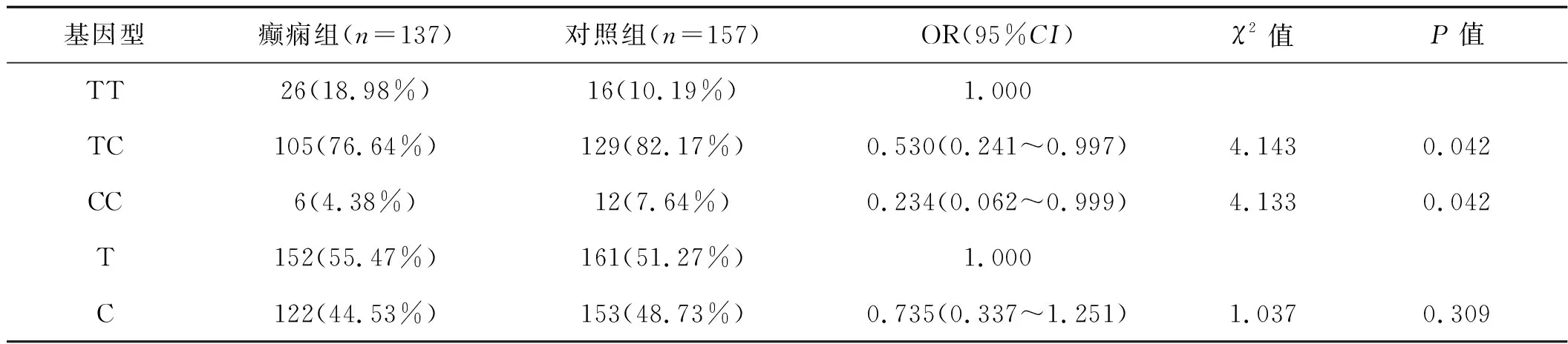
表4 rs11136000位点SNPs与男性脑卒中后癫痫的关系 例
2.3 2组患者临床特征和血清CLU水平比较
单因素分析显示,癫痫组与对照组在Charlson’s共病指数>2、卒中偏侧性、大动脉粥样硬化性脑卒中及溶栓治疗方面差异有统计学意义(P<0.05),其余变量差异无统计学意义(P>0.05)。见表5。

表5 癫痫组与对照组患者基线临床资料的比较
2.4 多因素Logistic回归分析
选择Charlson’s共病指数>2、血清CLU水平、卒中偏侧性、大动脉粥样硬化性脑卒中、性别、年龄、溶栓治疗作为自变量,纳入多因素Logistic回归模型,结果显示,右侧脑卒中、大动脉粥样硬化性、溶栓治疗是脑卒中后癫痫易感性的独立危险因素(P<0.05),而CLU基因rs11136000位点TC基因型和CC基因型都是脑卒中后癫痫发病风险的独立保护因素(P<0.05)。见表6。

表6 多因素Logistic回归分析与脑卒中后癫痫发病风险有关的危险因素
2.5 脑卒中后癫痫患者rs11136000位点基因型与血清CLU水平的关系
癫痫组患者血清CLU水平显著低于对照组[66.86(54.60,82.60)μg· ml-1vs.73.10(57.70,100.50)μg· ml-1,Z=-3.619,P<0.001]。在癫痫组中CLU基因rs11136000位点TC/CC基因型患者(C等位基因携带者)血清CLU水平显著高于TT基因型患者(Z=-3.765,P<0.05)。见图1。
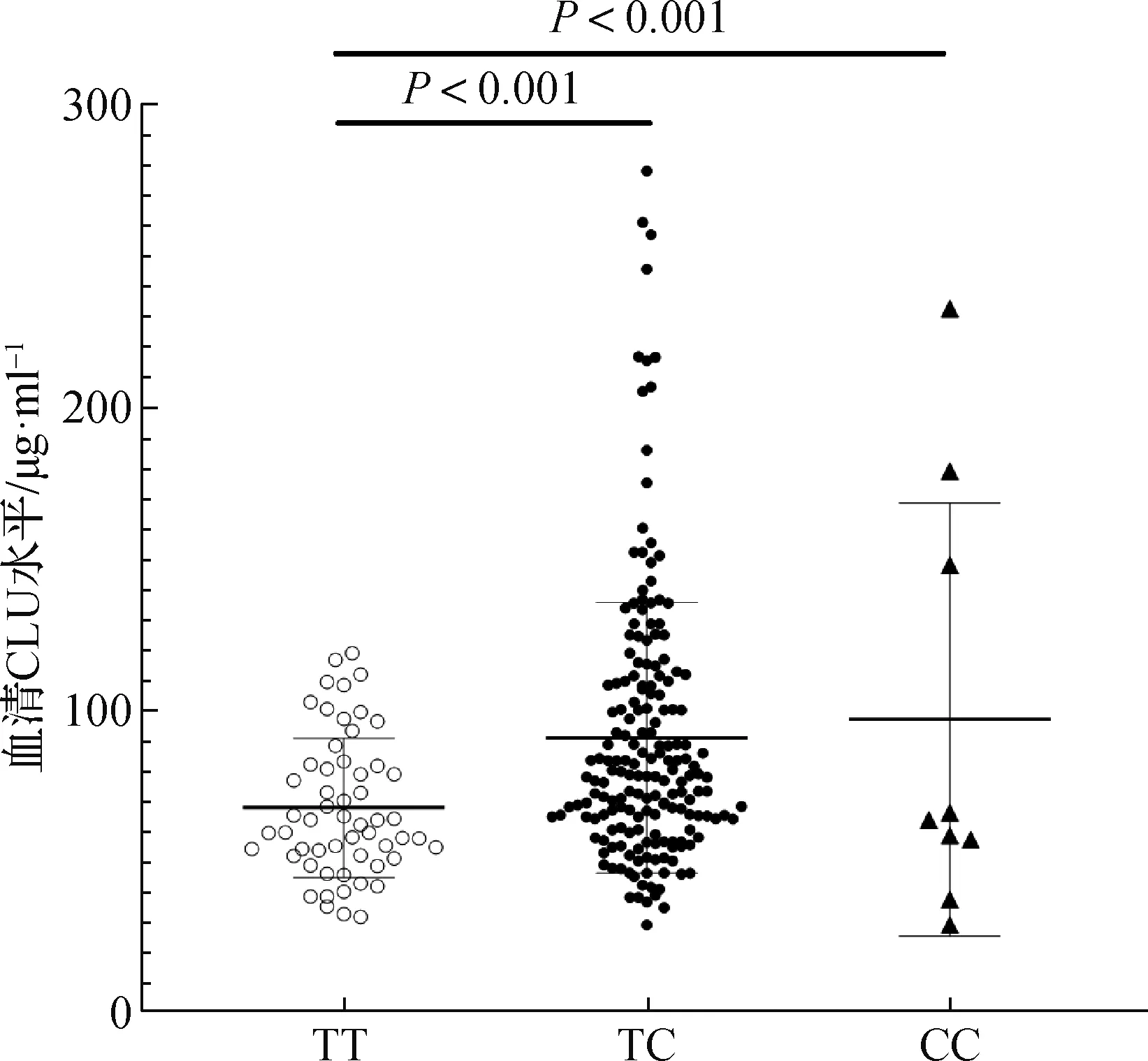
图1 脑卒中后癫痫患者CLU基因rs11136000位点基因型与血清CLU水平的关系
3 讨 论
研究表明,大鼠癫痫持续状态后垂死的海马神经元中的CLU mRNA和蛋白水平显著降低[14]。此外,海马神经元中核CLU表达降低已被证明伴随海马酸诱导的癫痫发作后广泛的海马细胞死亡和细胞凋亡[15]。此外,耐药癫痫患者脑脊液中CLU水平也低于药物反应性癫痫患者[16]。因此,CLU可能与癫痫的发病机制有关。在本研究中,我们评估了CLU基因rs11136000、rs9314349和rs9331949位点SNPs对脑卒中后癫痫易感性的影响,并发现了rs11136000位点CC/TC基因型和C等位基因频率增加与缺血性脑卒中后癫痫发病风险呈正向关联。
CLU基因位于染色体8p21- p12上,包含9个外显子。SNPs可能通过改变相关基因的表达来影响疾病的易感性。据报道,CLUSNPs与神经系统疾病相关[8- 10]。CCG单倍型(rs2279590- rs11136000- rs9331888)已被成功鉴定为AD的遗传易感性因子[17]。rs9331949 C等位基因已被证明与汉族迟发性AD风险增加显著相关[18]。然而,CLUSNPs与脑卒中后癫痫之间的关系仍未确定。我们的研究是首次在小样本中国汉族人群中调查CLUSNPs与脑卒中后癫痫之间的遗传学关系,结果显示携带 rs11136000位点C等位基因(保护性等位基因)的脑卒中患者继发癫痫的风险较低。与上述发现一致的是,一项针对澳大利亚人群的研究中,rs11136000位点C等位基因的携带者在穹窿、腰带、胼胝体和纵向神经束中显示出明显的低白质完整性特征,而这些区域是已知的癫痫样放电的易感区域[19]。癫痫被认为是一种由神经元和(或)神经元群之间结构和功能连接紊乱引起的神经系统疾病。最近基于中国人群的神经成像研究则发现CLU基因rs11136000位点SNPs对旁海马回灰质萎缩以及海马的功能连接都有显著影响[20]。上述遗传学数据均说明CLU基因rs11136000位点C等位基因频率降低与缺血性脑卒中后癫痫易感性增加有关。
此外rs11136000位点SNPs也与患者血清CLU水平有关。有报道称rs11136000可能通过影响可变剪接、mRNA结构稳定性以及随后的蛋白质生成而增加脑卒中后癫痫风险[21]。在本研究中rs11136000位点CC/TC基因型(C等位基因携带者)患者血清CLU水平高于TT基因型患者。CLU是人体内一类重要的蛋白聚糖,可参与多种生物学过程,包括精子成熟、组织分化、组织重塑、膜循环、脂质运输、细胞增殖和死亡、肿瘤进展和神经退行性疾病等[16]。CLU通过稳定应激蛋白和抑制细胞凋亡从而对脑损伤有一定的保护作用。在AD小鼠模型(PDAPP小鼠)中,上调CLU表达可抑制淀粉样蛋白沉积并增加神经炎毒性,相关神经炎性营养不良也减少[22]。与野生型小鼠相比,CLU敲除小鼠在永久性大脑中动脉闭塞后愈合过程中组织重塑较慢[23]。这意味着CLU基因与细胞凋亡和炎症机制有关。此外,CLU也参与癫痫持续状态后神经细胞死亡过程。人CLU基因主要编码分泌型异二聚糖蛋白。最近的研究表明,CLU可以分泌到脑脊液和循环血中[24]。Xiao等[25]通过蛋白质组学分析发现,癫痫患者的脑脊液中CLU水平明显降低。这与本研究结果基本一致。我们亦发现癫痫组患者血清CLU水平显著低于对照组,因此我们推测,CLU水平降低可能会减弱抗凋亡效应,从而导致缺血性脑卒中后脑神经元死亡,进而增加继发性癫痫的发作风险。与基础研究证据一致,当前研究中发现的CLU基因rs11136000位点TC/CC基因型与较高的血清CLU水平之间的正向关系进一步支持了它们对神经元的保护作用。
然而,在这项研究中,我们无法支持CLU基因rs9314349和rs9331949位点SNPs与脑卒中后癫痫易感性之间的联系。这可能是由于与全基因组关联研究(GWAS)相比,样本量相对较小。在我们的研究中,这3个位点的MAF分别为0.146、0.171和0.232,而白种人的MAF报道均>0.349[19,21]。中国人群中MAF较低,因此需要更大的样本量来检测SNPs的小或中度遗传效应。在未来的研究中,通过更大的样本量或荟萃分析可能会获得积极的结果。
综上,在本研究人群中,我们证实了CLU基因rs11136000位点TC/CC基因型分布频率降低与缺血性脑卒中后癫痫易感性增加有关。但是本研究存在样本量小、种族背景和病理生理异质性等局限性,我们还需要对不同种族进行更大样本量的实验研究或荟萃分析,以阐明CLU多态性与癫痫之间的遗传关联。随着对癫痫发病机制的深入了解,未来也可能会得到不同的结果。
